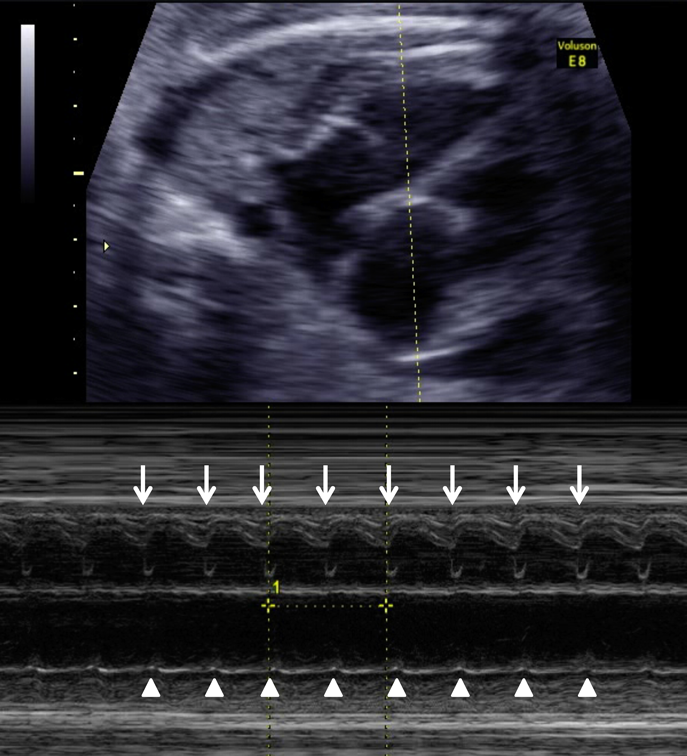
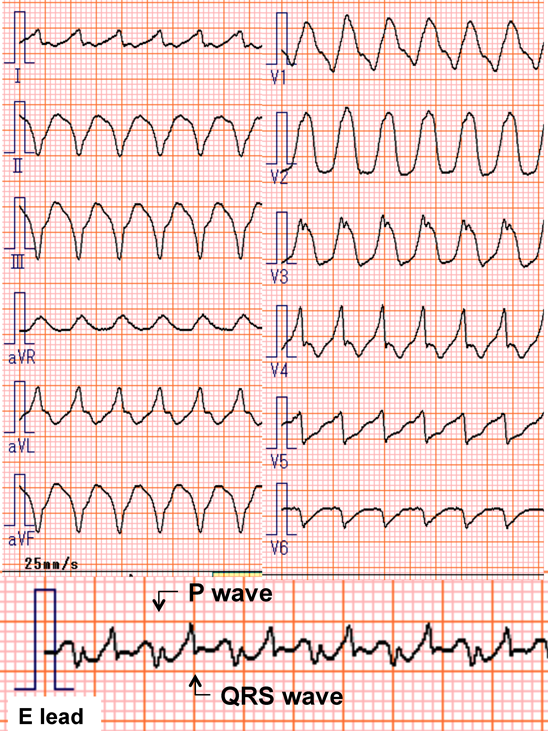
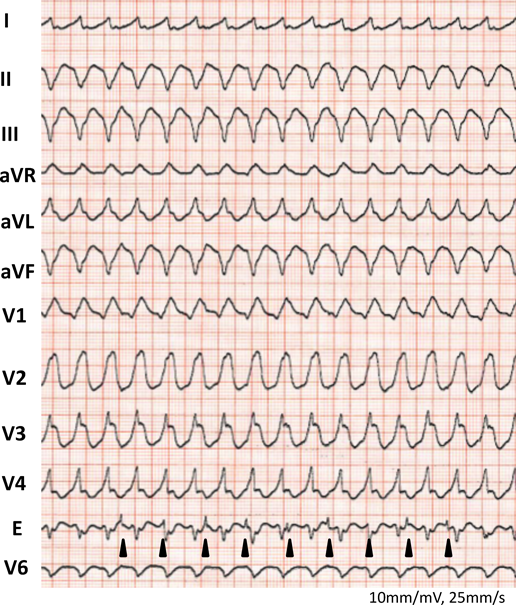
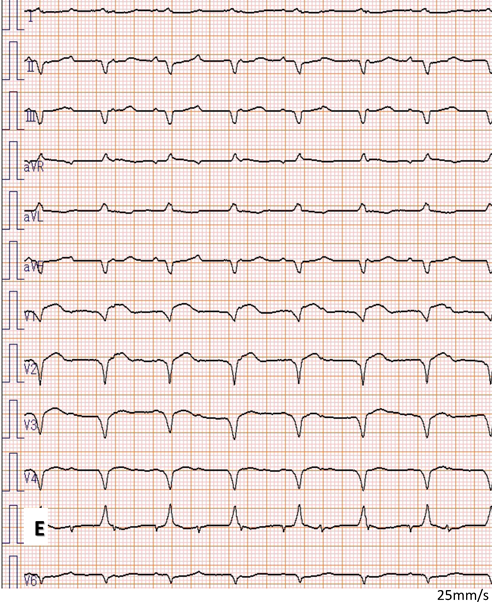
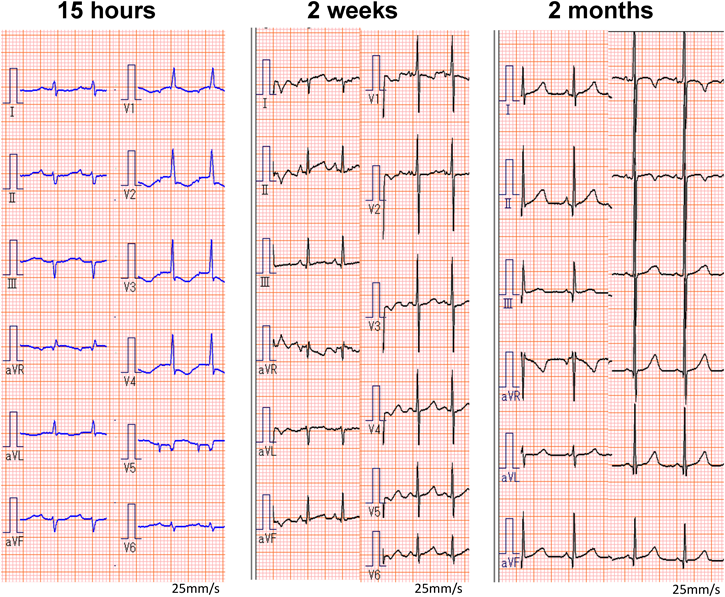
室房伝導を伴う胎児期心室頻拍症から生後高度房室ブロックとなった1例Advanced Atrioventricular Block after Postnatal Cardioversion for Fetal Ventricular Tachycardia: A Case Report
1 独立行政法人地域医療機能推進機構九州病院小児科Department of Cardiology, Japan Community Healthcare Organization Kyushu Hospital ◇ Fukuoka, Japan
2 独立行政法人地域医療機能推進機構九州病院産婦人科Department of Gynecology and Obstetrics, Japan Community Healthcare Organization Kyushu Hospital ◇ Fukuoka, Japan