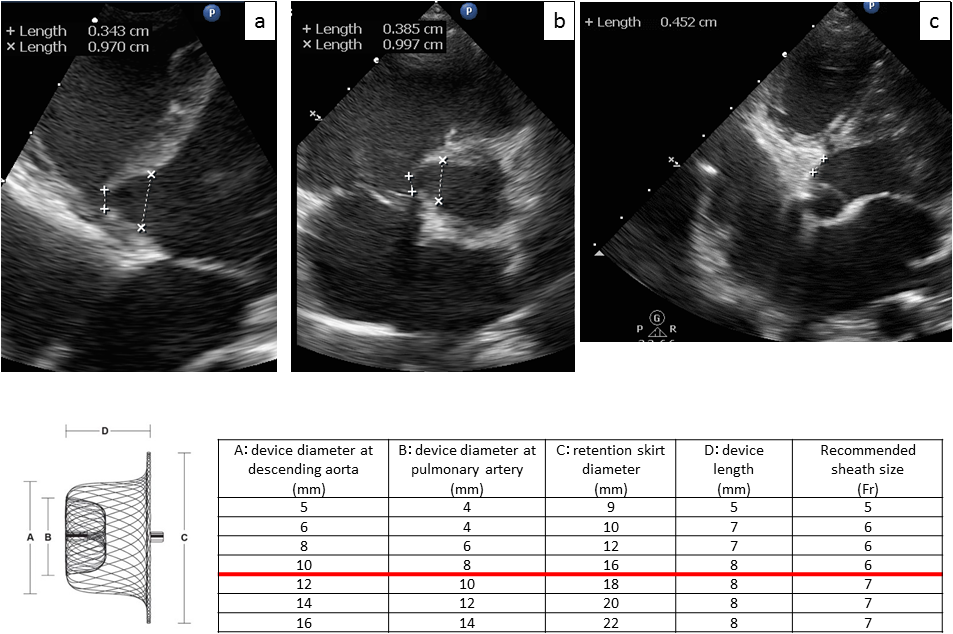
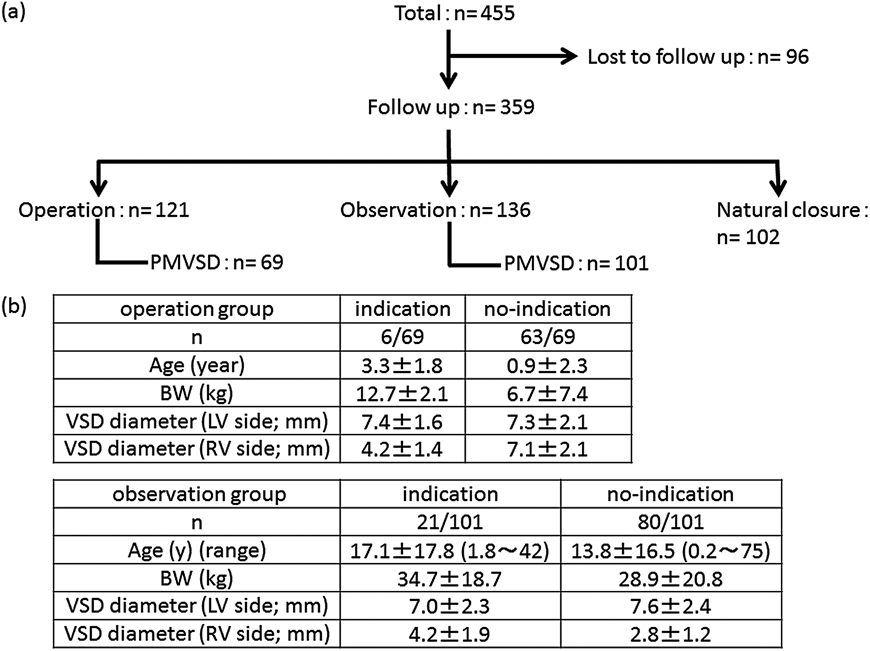
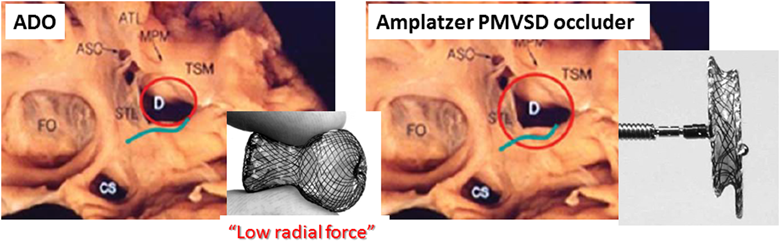
本邦における心室中隔欠損に対する経皮的カテーテル閉鎖術の可能性Percutaneous Transcatheter Closure of Ventricular Septal Defects in Japan
1 京都府立医科大学小児科Department of Pediatrics, Kyoto Prefectural University of Medicine ◇ Kyoto, Japan
2 昭和大学小児循環器・成人先天性心疾患センターPediatric Heart Disease & Adult Congenital Heart Disease Center, Showa University Hospital ◇ Tokyo, Japan
3 昭和大学横浜市北部病院循環器センターCardiovascular Center, Showa University Northern Yokohama Hospital ◇ Kanagawa, Japan