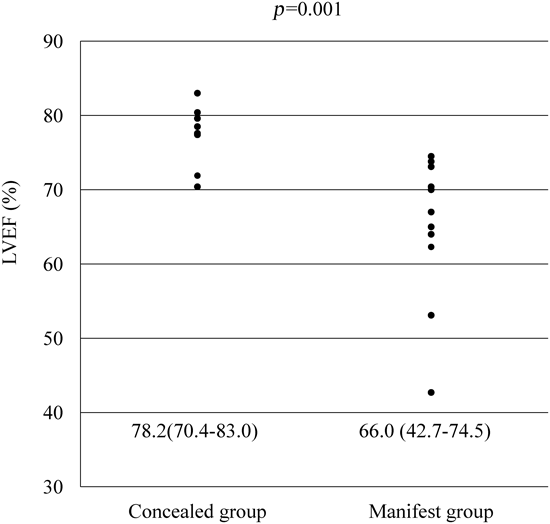
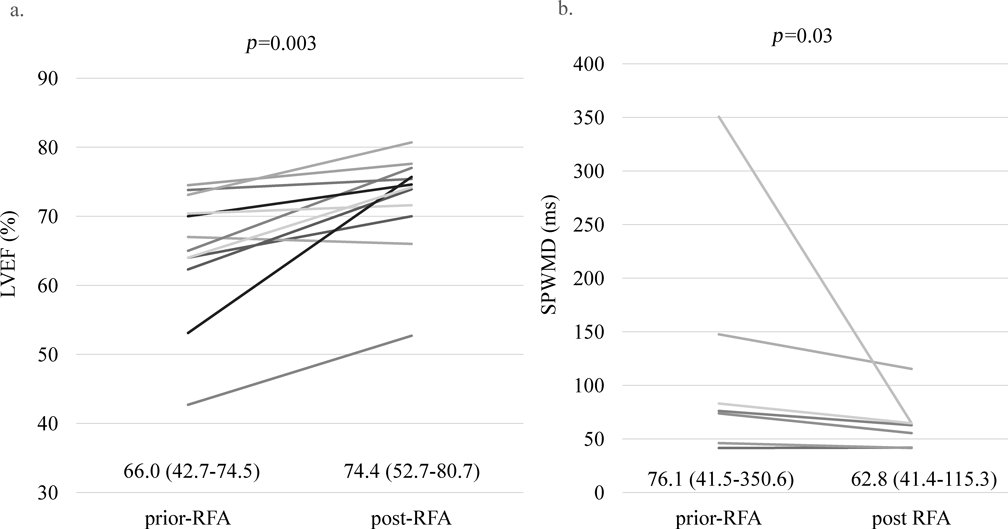
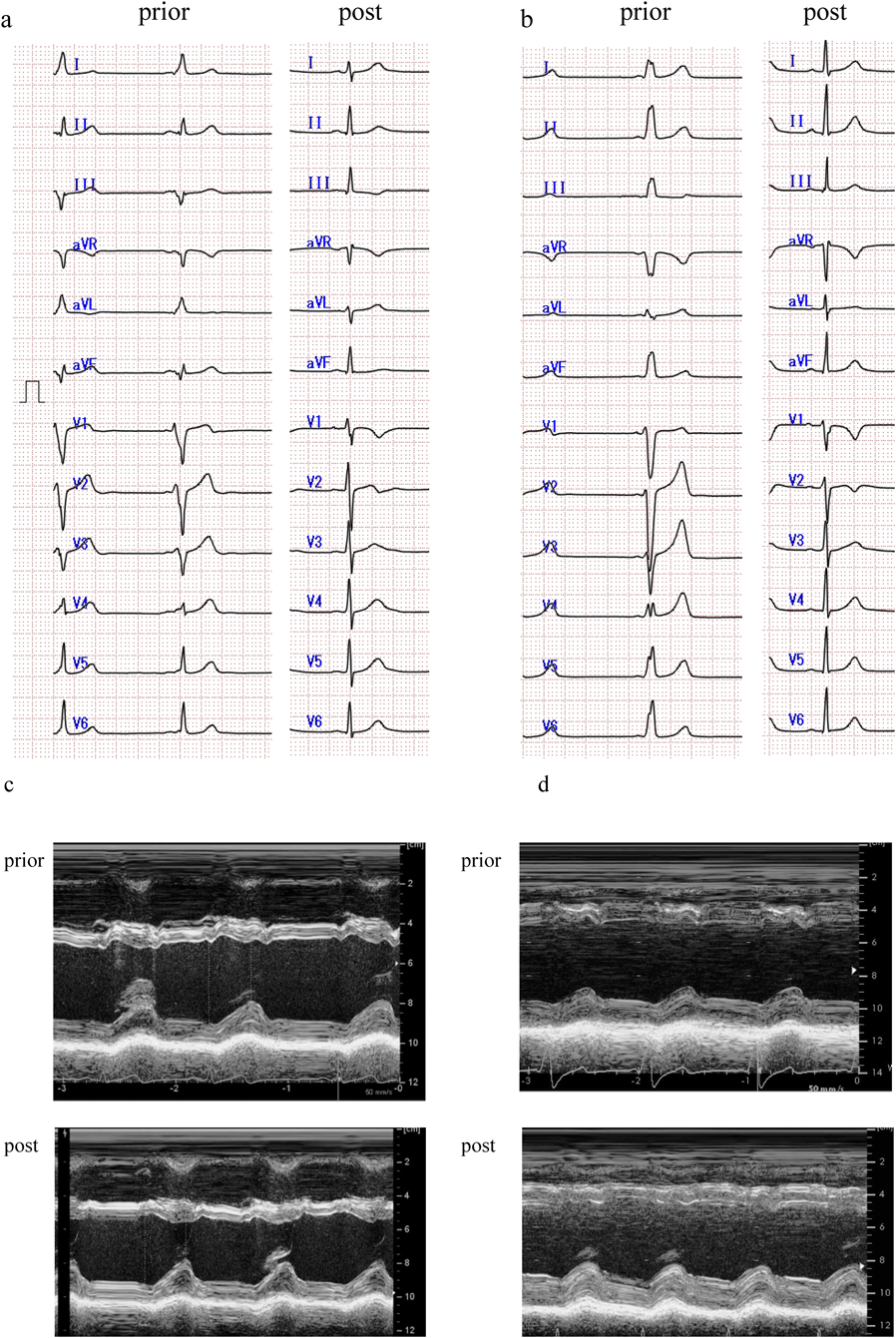
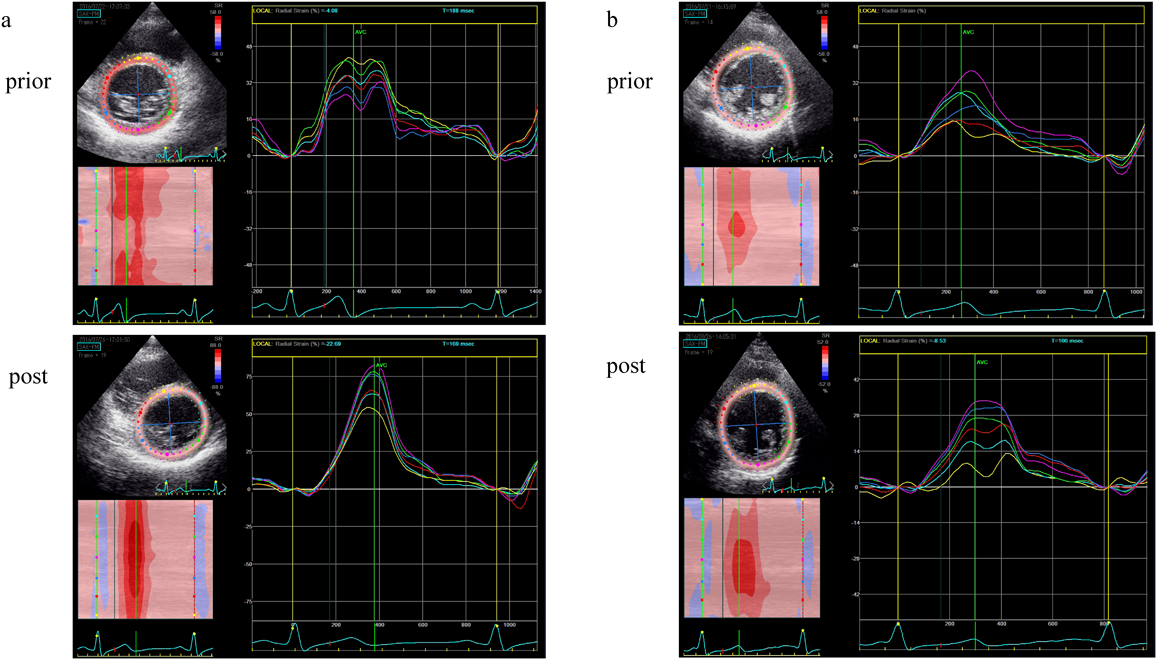
Wolff–Parkinson–White症候群における心室早期興奮が心機能に及ぼす影響Effect of Ventricular Preexcitation on Left Ventricular Function in Pediatric Patients with Wolff–Parkinson–White Syndrome
1 富山県立中央病院小児科Department of Pediatrics, Toyama Prefectural Central Hospital ◇ Toyama, Japan
2 富山県立中央病院内科(循環器)Department of Internal medicine, Toyama Prefectural Central Hospital ◇ Toyama, Japan
3 富山大学医学部小児科Department of Pediatrics, University of Toyama Graduate School of Medicine ◇ Toyama, Japan