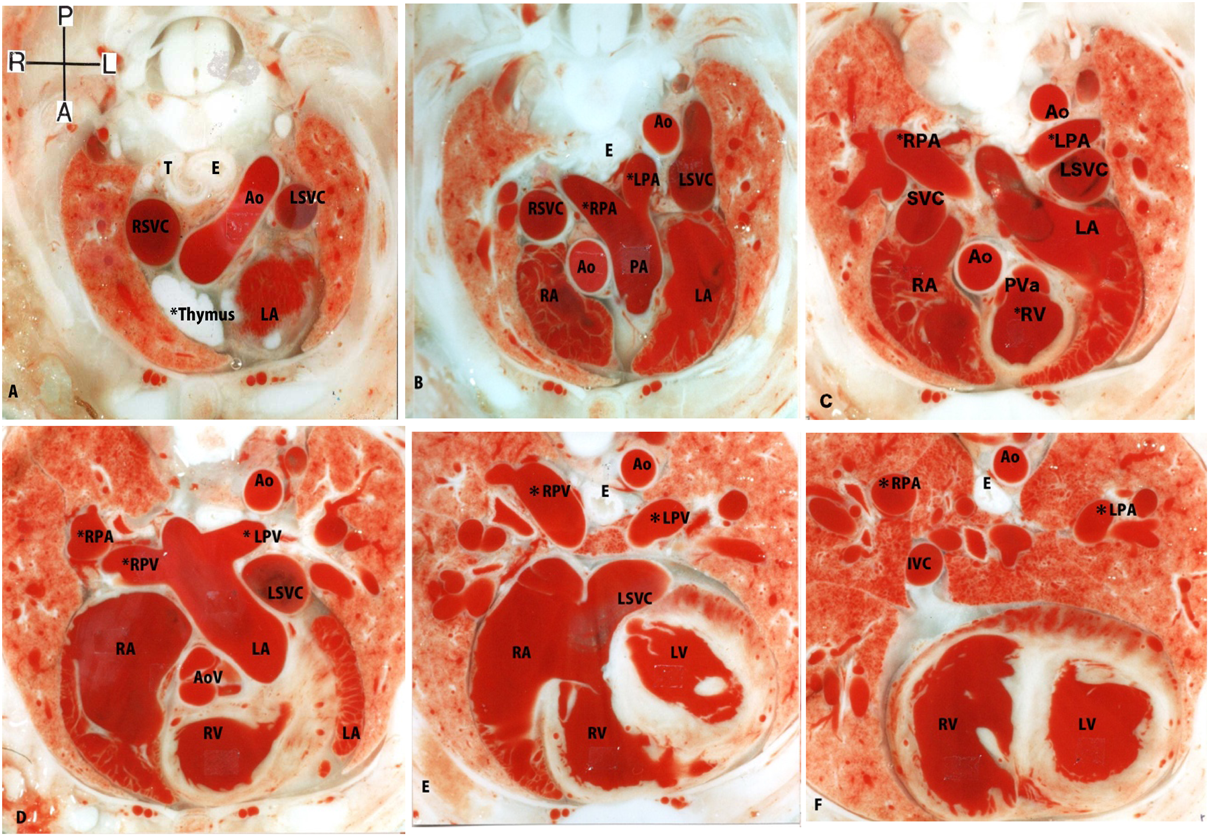
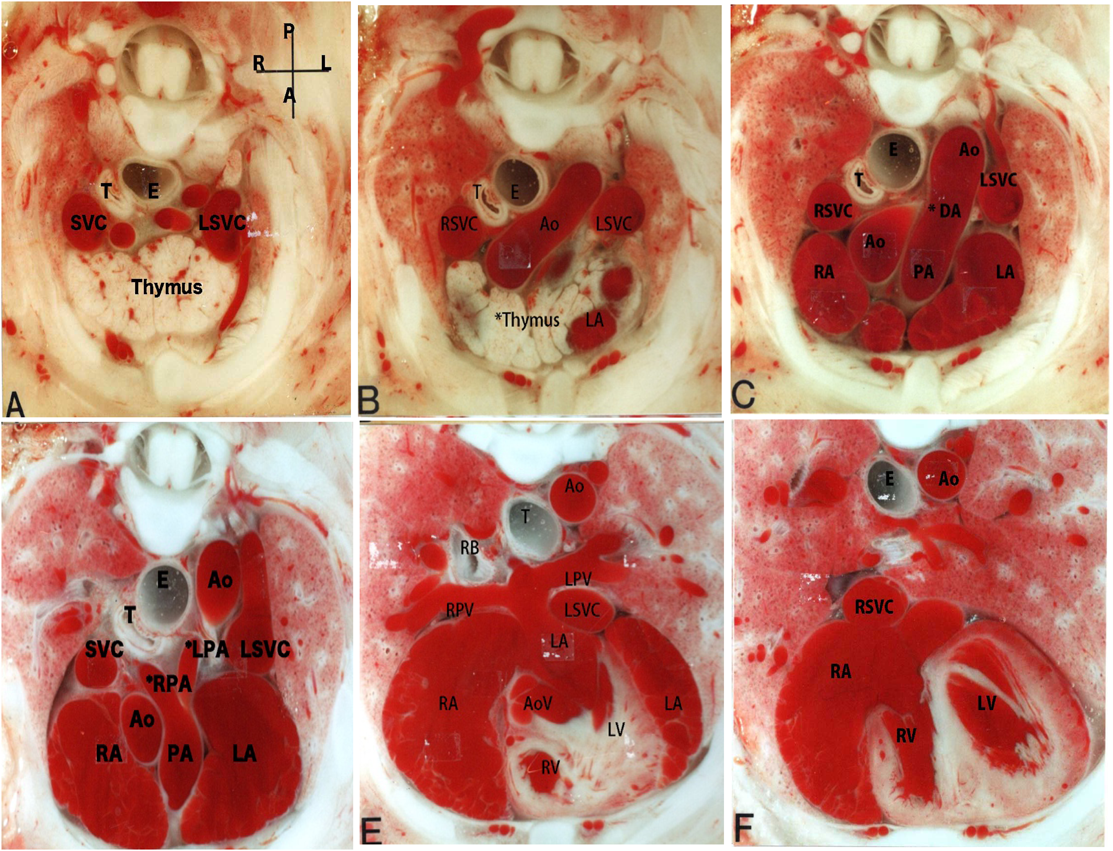
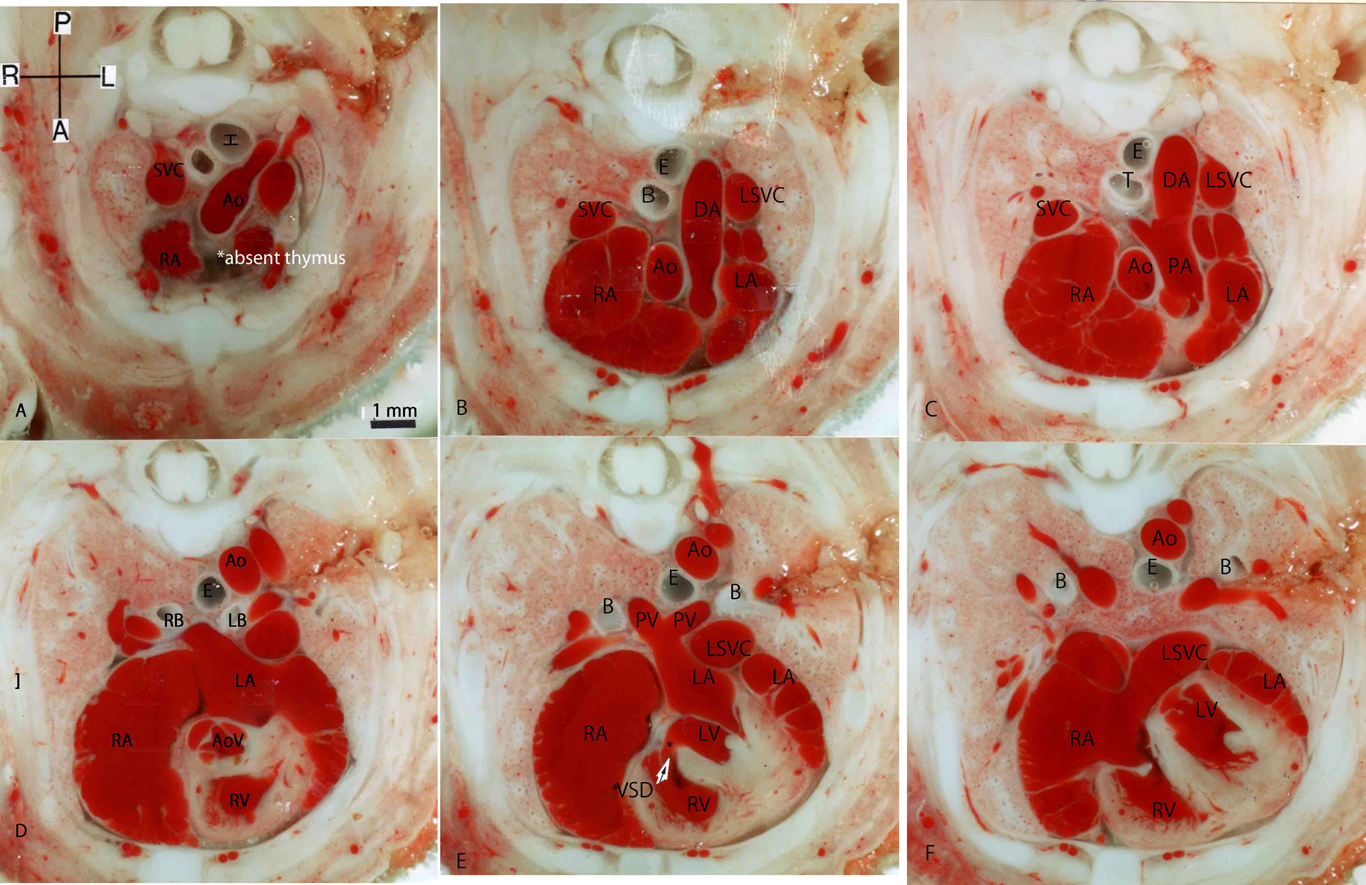
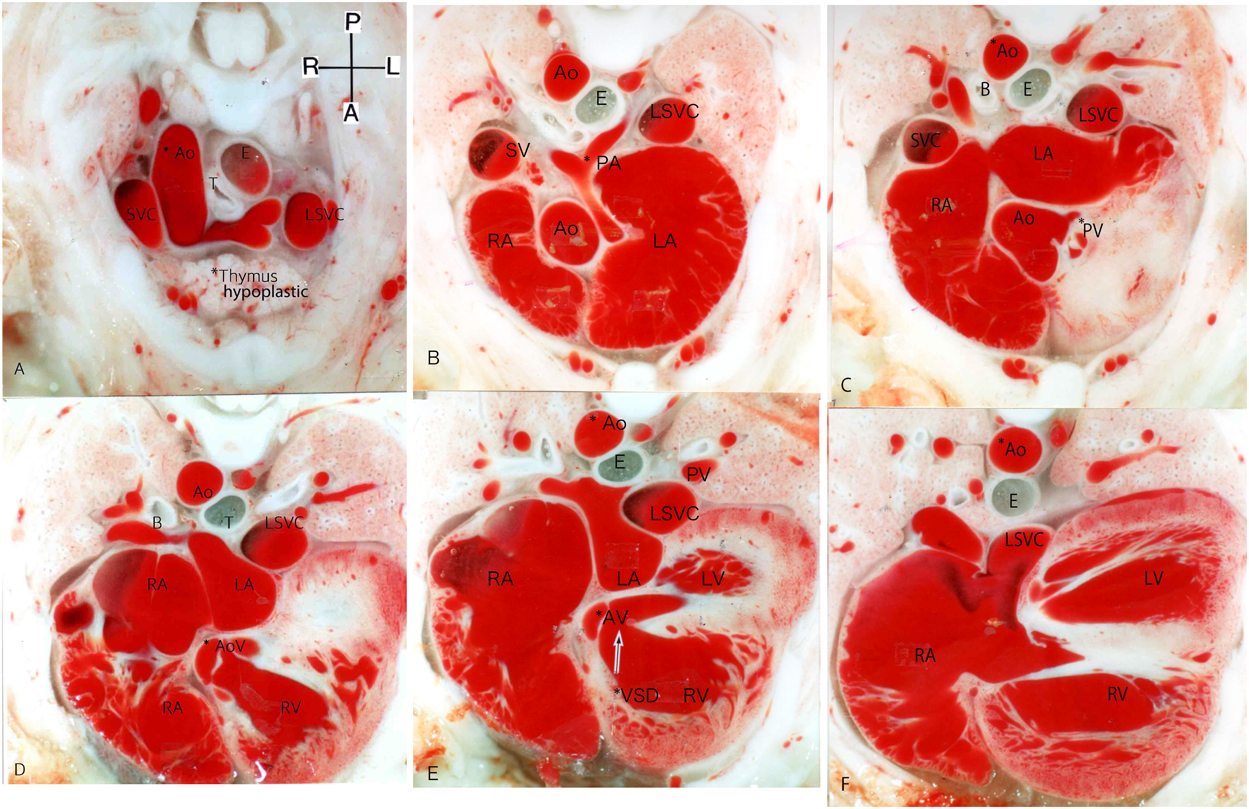
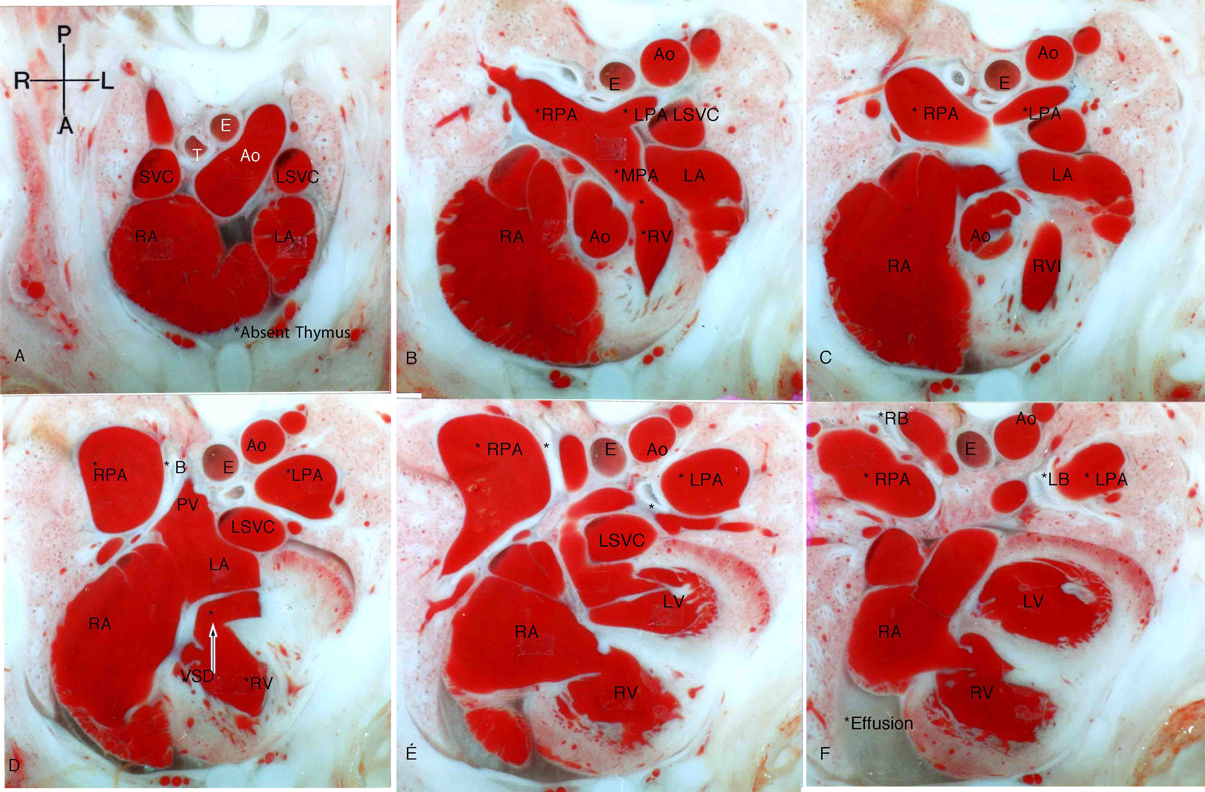
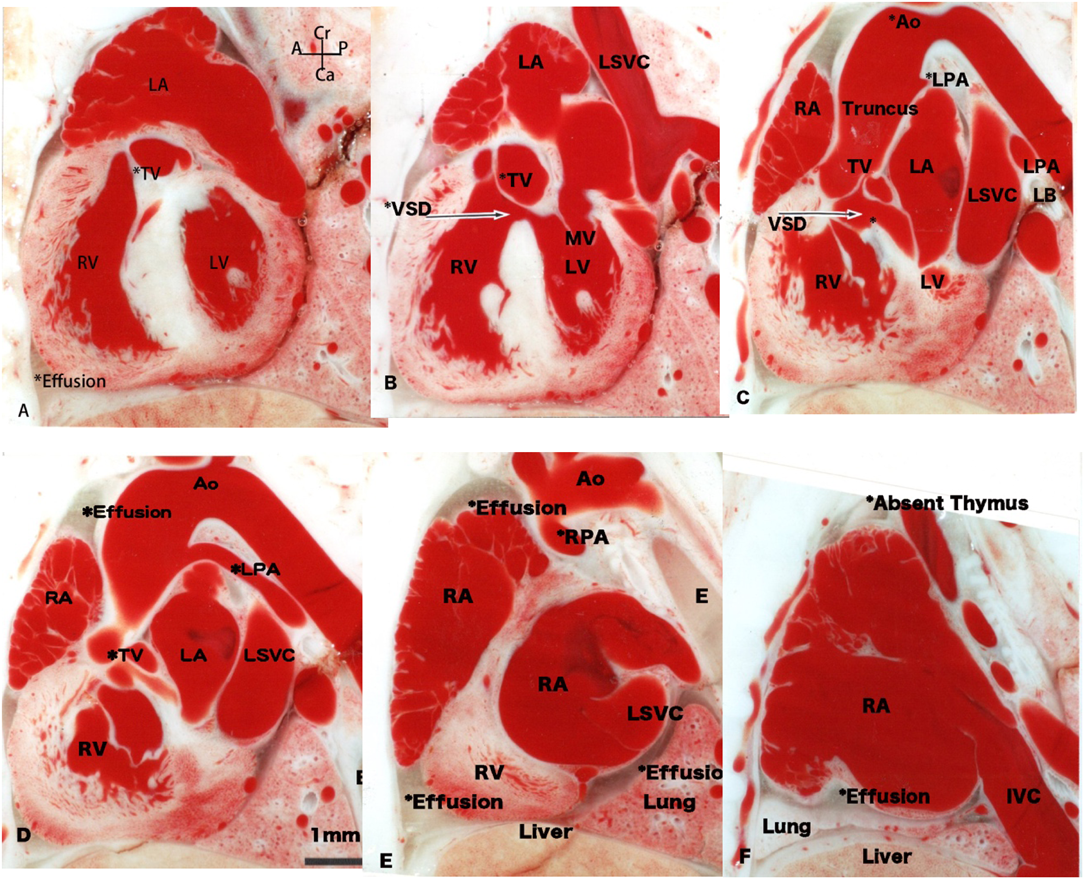
ラット胎仔先天性心疾患の断面像:胎児心エコーのための22q11.2欠失症候群モデル動物図譜としてCross-sectional Morphology of Congenital Heart Disease: Fetal Echocardiography Indicating Chromosome 22q11.2 Deletion Syndrome in Rat Model
東京女子医科大学循環器小児科Department of Pediatric Cardiology, Tokyo Women’s Medical University ◇ Tokyo, Japan