左心低形成症候群(HLHS)は,心臓・大血管形態のうち左心系(左房,僧帽弁,左室,大動脈弁,上行大動脈および大動脈弓)が著しく低形成で,左室から大動脈への順行性血流によって体循環が維持できない症候群である.HLHSは心室中隔欠損(VSD)を伴わない典型的左心低形成症候群(typical HLHS)と両大血管右室起始症などを含む非典型的左心低形成症候群(non-typical HLHS)に大別される.前者では大動脈弁および僧帽弁は狭窄と閉鎖の組み合わせとなる.通常typical HLHSにおいて左室は痕跡的であり,心内膜線維弾性症がみられ,左室への冠動脈の異常交通を合併することがある.
この25年で病態生理の研究と理解の深化,胎内診断の普及,術後急性期に肺血管抵抗と全身血管抵抗を両方とも低下させることで肺体血流比の変動を抑えて管理を行うlow resistance strategyの確立など周術期管理の進歩,手術手技の開発と改良が絶え間なく行われ,さらに個々の症例に応じた外科治療戦略の選択により,治療成績は改善しつつある1, 2).しかし現在でも機能的単心室群で最も救命率およびFontan到達率の悪い疾患群である.これまでに死亡に対する危険因子として,早産児,低出生体重児,心外合併奇形,上行大動脈径2 mm以下,狭小心房間交通,術後ECMOの使用,予期せぬ再手術などが挙げられている3, 4).さらに近年,僧帽弁/大動脈弁の性状によるtypical HLHSサブグループ別解析で,僧帽弁狭窄–大動脈弁閉鎖(MS/AA)が他のサブタイプに比べ生存率が低いという報告がみられ,MS/AAがHLHSの死亡率に対する危険因子であると指摘されている5, 6).
本検討はtypical HLHSを対象とし僧帽弁/大動脈弁のサブタイプ別に死亡率を比較し,さらに死亡に影響する要因を明らかにし,今後の管理に役立てることを目的とした.
周術期におけるlow resistance strategyの確立した1998年1月から2015年12月までに福岡市立こども病院で出生あるいは他院より紹介され治療を行った左房,左室,上行大動脈および大動脈弓の低形成があり,心室中隔欠損を伴わない,typical HLHS 119例を対象とした1).九州大学循環器内科と共同管理している機能的単心室症例のdatabase[Research Electronic Data Capture(REDCap)]および診療録を用いた後方視的検討を行った.入院時の経胸壁心エコー検査をもとに僧帽弁と大動脈弁の性状をそれぞれ狭窄(stenosis)か閉鎖(atresia)に分類し,僧帽弁狭窄–大動脈弁閉鎖(MS/AA),僧帽弁閉鎖–大動脈弁閉鎖(MA/AA),僧帽弁狭窄–大動脈弁狭窄(MS/AS),僧帽弁閉鎖–大動脈弁狭窄(MA/AS)の4群に分けた.今回,両弁性状が予後に与える影響を検討するため,typical HLHSのみを対象とし,HLHS variant, Hypoplastic Left Heart Complex(HLHC)などのnon-typical HLHSは除外した.他の心内合併奇形による予後への影響を除くため,総肺静脈還流異常や三心房心などの肺静脈閉塞性疾患合併例は除外した.
患者特性(僧帽弁/大動脈弁サブタイプ別)
患者特性として症例数,性別(男性),胎内診断の有無(率),出生体重2,500 g未満で出生した症例数(率),出生時に中等度以上の房室弁閉鎖不全を来した症例数(率),心外合併奇形数(率),狭小心房間交通数(率),および初回手術後のIntensive Care Unit(ICU)滞在日数を調べた.
生存率,死亡症例数および死亡原因(僧帽弁/大動脈弁サブタイプ別)
主要評価項目として僧帽弁/大動脈弁サブタイプ別に生存率を検討した.まず,MS/AS, MA/AAおよびMS/AA群別生存率を比較検討した.さらに,typical HLHS全体の治療内容,死亡症例数と死亡原因を調べた.
死亡率に影響を与える交絡因子として初回手術後のICU滞在日数,胎内診断,MS/AA,低出生体重(<2,500 g),中等度以上房室弁逆流,心外合併奇形,狭小心房間交通および初回手術時のICU滞在日数,初回術式を挙げ,それぞれ変量として死亡に関するリスク比についてCox proportional hazard分析を行った.
手術手技
通常,初回手術としてNorwood術を選択し,肺循環の維持を目的として患者の状態によりBlalock–Taussig shunt(BTS)法かright ventricle-pulmonary artery conduit(RV-PA)法かを選択した.生存している症例ではその後bidirectional Glenn(BDG)術を行い,心臓カテーテル検査結果をふまえて,Fontan術として心外導管法によるtotal cavopulmonary connection(EC-TCPC)術を行った.
一方,低出生体重児や術前のショックなど侵襲の大きなNorwood術に耐えられない症例にはbilateral pulmonary artery banding(BPAB)術を先行し,体重増加を待ち,Norwood術あるいはNorwood+BDG術を行い,その後EC-TCPC術を行った.
統計解析
患者の特性はMS/AA, MS/AS, MA/AA, MA/ASの4群に分類した.しかし,MA/ASは4例と症例数が非常に少なかったため統計処理からは除外した.生存率の解析は最終生存確認日か死亡日を打ち切りとした.3群間の名義変数の比較にはFischer’s exact test,中央値の比較にはKruskal–Wallis testを用いた.生存に対するKaplan–Meier曲線を作成し,累積生存率はMS/AA, MA/AA,およびMS/ASの3群で比較検討を行い,log-rank testで検定を行った.多変量解析には,Cox proportional hazards分析を行った.すべて有意水準を5%として解析した.解析はR version 3.3.1を用いて行った.
1998年から2015年までにtypical HLHSと診断された症例総数は119例で全例経過観察が可能であった.死亡日または最終受診日を打ち切りとし,追跡期間の中央値は2.6年(6日~17.6年)であった.
Table 1に全症例と各群の患者特性の詳細を示す.typical HLHSは僧帽弁と大動脈弁によるサブタイプ分類においてMS/AA =24例(20%),MA/AA =61例(51%),MS/AS =30例(25%),MA/AS=4例(3%)に分類された.性別,胎内診断の有無,出生体重,初回手術までの中等度以上の房室弁閉鎖不全,心外合併奇形,狭小心房間交通,初回術後ICU滞在日数において各群間で有意差はみられなかった.心外合併症はKabuki syndrome 3例,消化管閉鎖3例,その他はTurner syndrome, Dandy–Walker syndromeなど様々であった.
Table 1 Patient characteristics by MV/AV subtype classification | Overall n=119 | MS/AA n=24 (20.2%) | MA/AA n=61 (51.2%) | MS/AS n=30 (25.2%) | MA/AS* n=4 (3.4%) | p value |
|---|
| Male, n (%) | 72 (60.5) | 16 (66.7) | 33 (54.1) | 20 (66.7) | 3 (75) | 0.38 |
| Prenatal diagnosis, n (%) | 70 (58.8) | 14 (58.3) | 38 (62.3) | 18 (60.0) | 0 | 1.00 |
| Birth weight, median, g (range) | 2835 (1160–3982) | 2590 (1160–3160) | 2906 (1650–3798) | 2779 (1650–3982) | 3037 (2810–3700) | 0.64 |
| Birth weight <2,500 g, n (%) | 22 (18.5) | 7 (29.2) | 8 (13.1) | 7 (23.3) | 0 | 0.18 |
| AVVR (≧moderate), n (%) | 6 (5.0) | 2 (8.3) | 3 (4.9) | 1 (3.3) | 0 | 0.73 |
| Extracardiac anomaly, n (%) | 12 (10.1) | 2 (8.3) | 8 (13.1) | 2 (6.7) | 0 | 0.72 |
| Restrictive PFO, n (%) | 6 (5.0) | 3 (12.5) | 1 (1.6) | 2 (6.7) | 0 | 0.08 |
| ICU stay after the 1st operation (median, day) | 15 (0–177) | 16 (0–177) | 18 (1–125) | 15 (0–36) | 10 (4–23) | 0.20 |
| MA: mitral atresia, MS: mitral stenosis, AA: aortic atresia, AS: aortic stenosis. *Stastical analysis was performed in the MS/AA, MA/AA and MS/AS subtype except MA/AS subtype because the number of MA/AS subtype is limited. |
Fig. 1はMS/AA, MA/AA, MS/ASの3群のKaplan–Meier生存曲線である.MS/AA, MA/AAおよびMS/AS群別の累積生存率は,それぞれ1年33%,68%および77%,5年が33%,59%および72%であり,log-rank検定で有意にMS/AA群の生存率が他2群より低値であった(p=0.002).
Fig. 2にtypical HLHS 119症例における治療経緯を示す.全対象119例のうち手術未施行の3例を除き,初回手術はNorwood手術が64例(64/116=55%),bilateral pulmonary artery banding(BPAB)手術が52例(52/116=45%)であった.Norwood手術はBTS法が33例,RV-PA法が50例であった.Norwood手術後BDG手術前に24例が死亡していた.BPAB手術を行った52例のうち26例で2回目の手術としてNorwood+BDG術を.19例でNorwood手術を行っており,7例が2回目姑息術前に死亡していた.死亡は全体で49例(49/119=41%)であった.Fontan未到達の15例を除いた104例中,Fontan到達例は56例(54%)で,全例EC-TCPC手術であった.Fontan到達後ではMA/AAの1例がTCPC術後11日に肺出血で死亡した.typical HLHS全体の1年生存率は64%,5年生存率は58%であった.
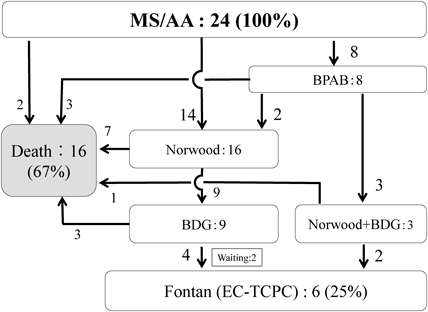
Fig. 3はMS/AA群に限定した治療経緯である.MS/AA群24例のうち手術未施行2例を除くと初回手術はNorwood手術が14例(64%),BPAB手術8例(36%)であった.Norwood術後に7例,BPAB術後に3例,BDG術後に3例,Norwood+BDG術後に1例死亡していた.現時点でのFontan到達は6例で,Fontan到達後の死亡はみられなかった.
死亡原因
Table 2に全対象および各群における死因をまとめた.全群での死亡49例の死亡原因として心室(右室)機能不全19例(39%)が最多であり,突然死11例(22%),敗血症を含めた重症感染症8例(16%),房室ブロック5例(10%)と続いた.いずれのサブタイプにおいても心室機能不全が最多であり,MS/AAおよびMS/ASでは突然死が,MA/AAでは重症感染症あるいは房室ブロックが続いた.
Table 2 Causes for mortality of patients with each anatomic subtypes | MS/AA (n=16) | MA/AA (n=24) | MS/AS (n=9) | Overall (n=49) |
|---|
| Right ventricular dysfunction | 6 | 9 | 4 | 19 |
| Sudden death | 5 | 3 | 3 | 11 |
| Infection /sepsis | 2 | 4 | 2 | 8 |
| AV block | 1 | 4 | 0 | 5 |
| ARDS | 1 | 2 | 0 | 3 |
| Ductal shock | 1 | 2 | 0 | 3 |
| ARDS: acute respiratory distress syndrome |
危険因子
MS/AA,胎内診断陽性,出生時体重<2,500 g,中等度以上房室弁逆流,心外合併奇形,狭小心房間交通および初回手術後ICU滞在日数,Norwood-BTS, Norwood-RVPA, BPABを変量とした単変量解析の結果をTable 3に示す.単変量解析でMS/AA,胎内診断陽性が有意なリスク因子であった.MS/AAと胎内診断陽性を変数とした多変量解析ではMS/AA(hazard ratio 2.80, 95%CI 1.47–5.32, p=0.002),胎内診断陽性(hazard ratio 2.25, 95%CI 1.11–4.58, p=0.03)であり,両者が独立したリスク因子であった.
Table 3 Cox proportional hazards tests of the risk factors for mortality of typical HLHS| Variables | Univariate analysis | Multivariate analysis |
|---|
| Hazard ratio | 95%CI | p value | Hazard ratio | 95%CI | p value |
|---|
| MS/AA | 2.73 | 1.50–4.97 | 0.001 | 2.80 | 1.47–5.32 | 0.002 |
| Prenatal diagnosis | 2.30 | 1.13–4.68 | 0.021 | 2.25 | 1.11–4.58 | 0.03 |
| Low birth weight (BW<2,500 g) | 1.35 | 0.69–2.64 | 0.38 | | | |
| AVV regurgitation (≧moderate) | 1.27 | 0.39–4.08 | 0.69 | | | |
| Extracradiac anomaly | 1.84 | 0.86–3.92 | 0.12 | | | |
| Restrictive PFO | 1.26 | 0.39–4.07 | 0.70 | | | |
| ICU stay after 1st operation | 1.01 | 0.99–1.02 | 0.33 | | | |
| Norwood-BT shunt | 1.27 | 0.57–2.87 | 0.56 | | | |
| Norwood-RV-PA conduit | 0.80 | 0.38–1.68 | 0.55 | | | |
| BPAB | 0.71 | 0.34–1.49 | 0.37 | | | |
| CI: confidence interval, BT: Blalock–Taussig, BPAB: bilateral PAB |
MS/AA全24例において施術した初回手術の種類とそれに対応した死亡数をTable 4に示す.初回手術は,Norwood(BTS)8例,Norwood(RV-PA conduit)6例,BPAB 8例で,2例は初回手術前に死亡していた.初回手術Norwood(RV-PA conduit)群では6例中3例(50%)が,初回手術Norwood(BTS)群では8例中7例が,初回手術BPAB群では8例中4例(50%)が死亡していた.初回手術術式と死亡率の関係は統計学的に有意差を認めなかった.
Table 4 Initial surgical procedure and its mortality of patients with MS/AA subtype| Initial operation of MS/AA | n=24 | Mortality (%) |
|---|
| Norwood BT shunt | 8 | 7 (88) |
| Norwood RV-PA conduit | 6 | 3 (50) |
| BPAB | 8 | 4 (50) |
| none | 2 | 2 (100) |
| BT: Blalock–Taussig, BPAB: bilateral PAB |
typical HLHSを僧帽弁,大動脈弁で分類した119例ではMA/AAが51.2%と最も多く,次いでMS/AS 25.2%,MS/AA 20.2%,MA/AS 3.4%と続いた.Alsoufiら4)は2002年から2012年にChildren’s Healthcare of AtlantaでNorwood手術が行われた219症例の検討でMA/AA 44.8%,MS/AS 26.0%,MS/AA 24.7%,MA/AS 4.6%と報告しており,われわれの検討と類似していた.
生存率の検討において,typical HLHSのなかでMS/AAが最も生存率が低かった(5年生存率:33%).そのなかでもMS/AAに対し初回手術としてNorwood(BTS法)術を行った症例の死亡率が最も高く(7/8 : 88%),次いでNorwood(RV-PA shunt法)(3/6)とBPAB(4/8)では50%の死亡率であった.
Sauerら7)はMS/AAでは冠動脈に中膜の肥厚がみられ,内腔の径に比べ壁厚が著明に増加しているが,MA/AAではこうした変化はみられず,MS/AAでleft ventricle-Coronary artery(LV-CA)fistulaがみられることを指摘している.冠動脈中膜肥厚による冠動脈狭窄が心筋虚血を引き起こし心機能を悪化させている可能性は考えられる.また,Nathanら8)はHLHS 216例の剖検でLV-CA fistulaは39例にみられ,全例がMS/AAであったと報告している.Vidaら9)はLV-CA fistulaを有するMS/AAのNorwood術後死亡率がLV-CA fistulaを認めない症例と比較して有意に高いことを示し,LV-CA fistulaにより心肺バイパス中の心筋保護が阻害されるため,あるいは心肺バイパス時に心内を減圧した際に冠動脈血流が乏しくなるためではないかと考察している.
LV-CA fistulaを検出するには心臓カテーテル検査で大動脈造影を行うことが最も確実な方法であると考えられるが,HLHSにおいては初回術前に全身状態が悪いことも多々あるため全例で術前に心臓カテーテル検査を行うことは困難である.そのため,できるだけ侵襲の少ない方法でLV-CA fistulaの精査を行うことが重要である.造影心臓CT検査は近年精度が向上しておりLV-CA fistulaを検出する方法として期待が持てるが,造影剤使用による腎障害やCT室への移動のリスクはあるため,全身状態を考慮して慎重に施行すべきであろう.心エコーは術前にLV-CA fistulaの有無を確認するには侵襲も小さく有用と考えられる.経胸壁心エコーにおいてLV-CA fistulaはカラードップラーにて左室心筋を横切り左室に連続する乱流となり,大きなLV-CA fistulaではパルスドップラーにて収縮期に逆行性,拡張期に順行性の血流として検出されることが知られている.発達した肉柱内の血流と区別が難しいことがあり,注意深い観察が必要である10).
今回の検討でMS/AAに対し初回手術でNorwood(BTS法)術を行った症例で死亡が多かったことは,BTSにより拡張期血圧がより下がったため冠血流量の減少を引き起こし,心筋虚血を悪化させた可能性が考えられる.MS/AA群がMA/AA群より突然死が多かったことは,MS/AA群においてLV-CA fistulaによる心筋虚血が強かった可能性が考えられる.
今回の対象で術前にLV-CA fistulaが超音波検査で疑われた症例は3例のみであった.死亡例の剖検がないため,実際のLV-CA fistulaの有無は不明であり,LV-CA fistulaと死亡の正確な因果関係を明らかにすることはできなかった.一方,Sathanandamら10)は経胸壁心エコーでLV-CA fistulaを検出する方法を示し,大きなLV-CA fistulaだけでなく,小さなLV-CA fistulaも検出し予後に与える影響を検討している.LV-CA fistulaはMS/AAにおいて過去の報告より高い56%の合併率であり,死亡率に影響しなかったと報告したうえで,その原因として大きなLV-CA fistulaでは予後が悪いが,小さなLV-CA fistulaが死亡率に与える影響は少ないとためであると考察している.MS/AAの高い死亡率と冠動脈異常の因果関係は現時点では不明である.
MS/AAではLVが高圧のまま残存し著明な心筋肥厚を来すことでNorwood術後の右室機能に悪影響を及ぼしている可能性も考えられる.今回の検討でHLHSの死因でRV dysfunctionが最も多かったことの原因には,残存左室の主心室である右室への相互作用による悪影響や,肥厚した左室心筋の酸素需要の増加も考えられる.
単心室の小児患者に対する心保護的薬物療法が有効であるというエビデンスは不足しているが,Yimら11)はHLHSの含まれる単心室の小児期の患者にACE阻害薬を投与することで心室拡張末期圧,平均肺動脈圧,平均心房圧が下がることを示し,ACE阻害薬が単心室に対し心保護的に作用する可能性を報告している.右室機能の低下が疑われる症例に対しては,心保護的薬物療法(ACE阻害薬,β遮断薬,在宅酸素療法など)を考慮する必要がある.また,肺動脈,大動脈などに残存狭窄病変がみられる場合には積極的な介入も心機能を保護するために必要と考える.
次に,Norwood手術時の肺動脈への血流路についてはいまだ議論がある.BTS法とRV-PA conduit法で生存率に差がないとの報告もあるが,BTS法では大動脈の拡張期血圧が下がるため,もともと冠血流の乏しいMS/AA群においてはさらに冠動脈血流減少の原因となり心筋虚血を引き起こす可能性はある12, 13).一方,Hillら14)は右心系単心室においてスペックルトラッキング心エコーを用いBTS法よりRV-PA conduit法のほうがcircumferential strainで右室の変形が大きい傾向があると報告し,RV-PA conduit法では右室切開による右室機能低下の可能性も考えられると考察している.今回のMS/AAサブタイプ群で,初回手術Norwood(BTS法)が最も生存率が低く,Norwood(RV-PA法)とBPAB群のそれは同等であった.先天性心疾患に対する心移植が一般的でない本邦において,現実的な治療方針として,MS/AA群のなかで術前に大きなLV-CA fistulaが疑われる症例には冠動脈血流を少しでもよい状態に維持するためNorwood(RV-PA法),大きなLV-CA fistulaがない症例には右室切開を避けるためにBPABを先行させ,成長を待ってNorwood+BDG手術を行うことで右室機能を保つ方針が適しているのかもしれない.ただし,BPAB術後,banding migrationによる肺動脈発育に悪影響がでたり,動脈管の維持に難渋したりする症例もありBDG術以前の治療法選択に関してはまだ確定的な言及はできないのが現状である.
Fontan到達後の死亡例は,術後早期に死亡したMA/AAの1例のみで,MS/AA群でも他の群と変わらず良好な成績であった.これはFontan術により低酸素血症が改善され,心筋への酸素供給が増加し心筋虚血イベントが減少したため,他群と変わらない結果であった可能性がある.
今回の検討でHLHSの胎内診断が死亡に対する有意なリスクファクターとなった.重症先天性心疾患において胎内診断症例と出生後診断症例を比較すると,胎内診断群のほうが出生後診断群より1年生存率が低いとの報告がなされている15, 16).今回HLHSの胎内診断陽性群で死亡率が有意に高かった理由として,胎児エコー検査でより重症度の高い症例が診断されやすいため,出生後診断例より重症度が高い可能性は否定できない.本検討においては心外合併奇形と狭小心房間交通はリスクファクターとして有意差をみとめず,死亡に対する大きな影響はみられなかった.
本研究の限界として,比較的長期の後方視的検討であることが挙げられる.typical HLHS全体での1年生存率は本研究期間前半の1998年から2006年までは59%,後半の2007年から2015年では70%と改善傾向であった.これは年代により手術手技の向上,術式の変化および内科管理の変化が含まれるためと考えられる.また,LV-CA fistulaの診断が不十分であり(初回手術前の心臓カテーテル検査,エコー,剖検例),術前にLV-CA fistulaの有無を明らかにし,術式を選択し生存改善を試みる必要がある.
typical HLHSにおいて大動脈弁,僧帽弁分類によるMS/AAサブタイプと胎内診断陽性は高リスクであった.Fontan術後予後は他群と変わらず良好であることから,LV-CA fistulaの診断精度向上と,心筋虚血の防止,右室機能保護を念頭においた右心バイパス術前の治療戦略の見直しが必要である.
利益相反
日本小児循環器学会の定める利益相反に関する開示事項はない.
引用文献References
1) Nakano T, Kado H, Shiokawa Y, et al: The low resistance strategy for the perioperative management of the Norwood procedure. Ann Thorac Surg 2004; 77: 908–912
2) Sakurai T, Kado H, Nakano T, et al: Early results of bilateral pulmonary artery banding for hypoplastic left heart syndrome. Eur J Cardiothorac Surg 2009; 36: 973–979
3) Stasik CN, Goldberg CS, Bove EL, et al: Current outcomes and risk factors for the Norwood procedure. J Thorac Cardiovasc Surg 2006; 131: 412–417
4) Alsoufi B, Mori M, Gillespie S, et al: Impact of patient characteristics and anatomy on results of Norwood operation for hypoplastic left heart syndrome. Ann Thorac Surg 2015; 100: 591–598
5) Glatz JA, Fedderly RT, Ghanayem NS, et al: Impact of mitral stenosis and aortic atresia on survival in hypoplastic left heart syndrome. Ann Thorac Surg 2008; 85: 2057–2062
6) Shuhaiber J, Morgan B, Gottliebson W: Survival outcomes following Norwood procedure for hypoplastic left heart. Pediatr Cardiol 2015; 36: 57–63
7) Sauer U, Gittenberger-de Groot AC, Geishauser M, et al: Coronary arteries in the hypoplastic left heart syndrome: Histopathologic and histometrical studies and implications for surgery. Circulation 1989; 80: I168–I176
8) Nathan M, Williamson AK, Mayer JE, et al: Mortality in hypoplastic left heart syndrome: Review of 216 autopsy cases of aortic atresia with attention to coronary artery disease. J Thorac Cardiovasc Surg 2012; 144: 1301–1306
9) Vida VL, Bacha EA, Larrazabal A, et al: Surgical outcome for patients with the mitral stenosis-aortic atresia variant of hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2008; 135: 339–346
10) Sathanandam S, Cui W, Nguyen NV, et al: Ventriculocoronary artery connections with the hypoplastic left heart: A 4-year prospective study: Incidence, echocardiographic and clinical features. Pediatr Cardiol 2010; 31: 1176–1185
11) Yim DLS, Jones BO, Alexander PMA, et al: Effect of anti-heart failure therapy on diastolic function in children with single-ventricle circulations. Cardiol Young 2015; 25: 1293–1299
12) Polimenakos AC, Bokowski JW, Ghawi HS, et al: Fate of ventricular and valve performance following early bidirectional glenn procedure after norwood operation controlled for hypoplastic left heart syndome anatomic subtype. Pediatr Cardiol 2014; 35: 332–343
13) Sharma V, Deo SV, Huebner M, et al: In search of the ideal pulmonary blood source for the norwood procedure: A meta-analysis and systematic review. Ann Thorac Surg 2014; 98: 142–150
14) Hill GD, Frommelt PC, Stelter J, et al: Impact of initial norwood shunt type on right ventricular deformation: The single ventricle reconstruction trial. J Am Soc Echocardiogr 2015; 28: 517–521
15) Oster ME, Kim CH, Kusano AS, et al: A population-based study of the association of prenatal diagnosis with survival rate for infants with congenital heart defects. Am J Cardiol 2014; 113: 1036–1040
16) Wright LK, Ehrlich A, Stauffer N, et al: Relation of prenatal diagnosis with one-year survival rate for infants with congenital heart disease. Am J Cardiol 2014; 113: 1041–1044