心房中隔欠損(ASD)は先天性心疾患の中で7~10%を占める疾患である1).従来外科手術が治療の第一選択とされてきたが,2005年8月に本邦において,2次孔欠損型ASDに対する治療法としてAmplatzer Septal Occluder(St. Jude Medical Corporation, At. Paul)による経皮的心房中隔欠損閉鎖術(ASO)の臨床使用が認可されて以来,このカテーテル治療が多くの施設で行われるようになった2).
ASO治療は外科手術に比較して,体外補助循環装置の使用が必要でないこと,術後の合併症を回避できること,入院期間を短縮できること3)などに加え,手術痕がないというコスメティックな利点がある一方,心房中隔に伸縮性に乏しい,ニチノール合金でつくられたデバイスを挿入することによる中長期的な心機能,特に心房機能への影響については,報告も少なく不明な点が多い.
この研究の目的は,当院で小児期にASOを施行した症例において,留置したデバイスの心房容積や心房の拡張性に及ぼす影響について,心エコー検査を用いて評価することである.なお,本研究はretrospective studyである.
2007年3月から2012年7月の間に当院において,12歳以下でASOを施行した54例中,ASO治療前後で,解析に適した画像が得られた30例(ASO群:Follow up時年齢8.5±2.7歳,男:女=17 : 13)を対象とした.
また,比較対象として小児期に外科的閉鎖を施行した15例(SC群:Follow-up時年齢11.5±2.9歳,男:女=9 : 6)と,同年齢のボランティアおよび心雑音などの精査で受診した正常心症例15例(NC群:9.4±2.1歳,男:女=9 : 6)と比較検討した.
ASO症例と外科治療症例は全て2次孔欠損型心房中隔欠損症例で,他の治療を必要とする合併異常や肺高血圧または房室弁逆流など血行動態に影響する異常を認めるものは,今回の検討対象から除外した.
本研究は,院内の臨床研究倫理委員会のプロトコールに基づいて本人および保護者の同意を得て研究を実施した(倫理委員会承認番号:28–23).
使用した画像診断装置はPHILIPS社iE33, GE Health Care社Vivid E9, Toshibaメディカル社ARTIDAを各付属のプローブを体格に応じて使用した.
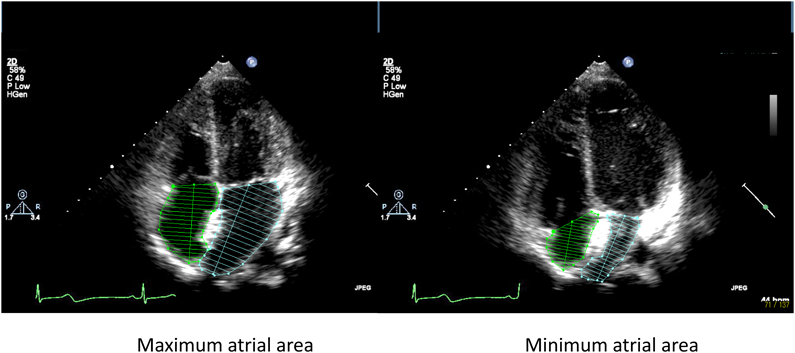
解析画像は,小児心臓超音波検査トレーニングを受けた循環器小児科医および超音波検査士により記録した画像中,両心房が十分に描出された心尖部四腔断面の動画像を用いた(Fig. 1).
画像は全てデジタル保存し,各機器付属のOff-lineの外部解析装置(PHILIPS社Xcelera R3.2, GE Health Care社EchoPAC ver. 112, Toshibaメディカル社Ultraxtned ver. 2.7)を用いて各項目について計測した.
心房面積および心室容積測定
心尖部四腔断面から計測した房室弁開放直前の最大心房面積(Max),房室弁閉鎖直後の最小心房面積(Min)を求め,心房reservoir機能の指標として,心房伸展性Distensibility(Dis)[=(Max−Min)/Min]を計算した4–6).
心房面積の計測は,同一検者により連続3心拍で計測し,各計測値の平均値を求め,体表面積(BSA)で補正して標準化した.
計測の再現性は,3心拍の計測値の標準偏差(SD)を平均値(Mean)で除した変動係数(CV)で評価した.
ASO群では,ASO治療前(pre)(最大3日前),治療直後(post)(1~3日後)Follow期(1~2年)で計測した.ASO群はさらに,左房側ディスク長(LA-D)と最大心房中隔長(Max IAS)を四腔断面から計測し,LA-D/Max IASの比をD/Lとして求め,その中央値でS-ASO群(0.7±0.1)とL-ASO群(1.0±0.1)に分けて比較検討した.
その他の心機能指標として全群のFollow期におけるModified Simpson法による左室拡張末期容積(LV EDV),左室収縮期最小容積(LV ESV)を計測し,左室駆出分画(LV EF)を算出した.
血流ドプラおよび組織ドプラ法による評価
全群のFollow期における心エコー検査において同時に計測した,僧帽弁流入血流速波形(TMF)から,急速流入期最大波形(TMF-E),心房収縮期波形(TMF-A)の各最大流速およびTMF-E/A,三尖弁流入血流速波形(TTF)から,急速流入期最大波形(TTF-E),心房収縮期波形(TTF-A)の各最大流速およびTTF-E/Aを求めた.
また,組織ドップラ法から得られた左室中隔側および側壁側での僧帽弁輪部移動速度波形の収縮期波(IVS S′, lat S′),拡張早期波(IVS E′, lat E′),心房収縮期波(IVS A′, lat A′),三尖弁輪部移動速度波形収縮期波(RV S′),拡張早期波(RV E′),心房収縮期波(RV A′),およびそれぞれのE/E′を計算した.
心機能指標の計測方法は日本超音波医学会およびアメリカ心エコー図学会等が提唱している方法7)に従った.
統計解析にはEasy R ver3.028)を用いた.ASO群,SC群,NC群それぞれ3群間以上の比較にはKruskal–Wallis検定,L-ASO群,S-ASO群,2群間の比較にはUnpaired student-t検定を用い,p<0.05を統計学的有意差ありとした.
臨床的背景
1)ASO治療群(Follow期)とNormal control群の比較(Table 1)
Table 1 Clinical characteristics of three groups | ASO | SC | P (ASO-SC) | NC | P(ASO-NC) |
|---|
| Age of repair (y) | 7.4±2.8 | 4.1±2.3 | 0.00063 | | |
| Follow up duration(y) | 1.2±0.3 | 7.3±3.4 | <0.0001 | | |
| Follow up Age (y) | 8.6±2.7 | 11.5±2.9 | 0.23 | 9.4±2.1 | 0.24 |
| Sex (male : female) | 17 : 13 | 9 : 6 | NS | 9 : 6 | NS |
| Height (cm) | 131±18 | 145±18 | 0.031 | 135±17 | 0.47 |
| Weight (kg) | 29±11 | 38±12 | 0.078 | 31±12 | 0.48 |
| BSA | 1.03±0.25 | 1.24±0.27 | 0.071 | 1.07±0.28 | 0.68 |
| HR (/min) | 72±11 | 71±8 | 1 | 70±12 | 0.55 |
| Qp/Qs | 2.3±0.8 | 3.5±1.1 | 0.00046 | — | |
| ASO: Device closure group using Amplatzer Septal Occluder, SC: Surgical closure group, NC: Normal control group, BSA: Body surface area, HR: Heart rate, Qp/Qs: Ratio of pulmonary (Qp) to systemic (Qs) blood flow |
検査時年齢,検査時心拍数(HR)は,ASO群とNC群に有意差はなかった.
2)ASO治療群(Follow期)と外科治療群の比較(Table 1)
治療時年齢は,ASO群(7.4±2.8歳)に比較して,SC群(4.1±2.3歳)は有意に低年齢で,治療後心エコー検査までの期間は,ASO群(1.2±0.3年)に比較してSC群(7.3±3.4年)が有意に長くなっていた.
検査時HRは,ASO群,SC群に有意差はなかった.
心カテーテル検査により求めた肺体血流比(Qp/Qs)は,ASO群(2.3±0.8)に比較して,SC群(3.5±1.1)が有意に高値であった.
SC群の術式は,自己心膜によるパッチ閉鎖術を9名,直接閉鎖術を6名が受けていた.
3)ASO治療におけるS-ASO群,L-ASO群の比較(Table 2, 3)
Table 2 Clinical characteristics of S-ASO and L-ASO | S-ASO | L-ASO | p |
|---|
| Age of repair (y) | 8.5±2.5 | 6.2±2.6 | 0.025 |
| Follow up duration (y) | 1.1±0.3 | 1.3±0.4 | 0.028 |
| Follow up Age (y) | 9.6±2.4 | 7.5±2.6 | 0.038 |
| Sex (male : female) | 8 : 7 | 9 : 6 | NS |
| Height (cm) | 135±14 | 127±19 | 0.071 |
| Weight (kg) | 32±11 | 26±10 | 0.047 |
| BSA | 1.10±0.22 | 0.97±0.26 | 0.068 |
| HR (/min) | 71±10 | 72±12 | 0.66 |
| S-ASO: Smaller device implantation group, L-ASO: Larger device implantation group, BSA: Body surface area, HR: Heart rate |
Table 3 Clinical data of S-ASO and L-ASO | S-ASO | L-ASO | p |
|---|
| Qp/Qs | 1.8±0.2 | 2.8±0.9 | <0.0001 |
| Device size (mm) | 12±2 | 20±4 | <0.0001 |
| LA-D(mm) | 26±3 | 34±4 | <0.0001 |
| Max IAS length (L) (mm) | 37±5 | 35±4 | 0.42 |
| Max IAS length/LA-D | 0.7±0.1 | 1.0±0.1 | <0.0001 |
| Max ASD size by TEE (mm) | 10.3±2.0 | 16.4±3.1 | <0.0001 |
| Device size/Max ASD size | 1.2±0.1 | 1.2±0.1 | 1 |
| S-ASO: Smaller device implantation group, L-ASO: Larger device implantation group, Qp/Qs: Ratio of pulmonary (Qp) to systemic (Qs) blood flow, LA-D: LA side device length, Max: Maximum, IAS: inter atrial septum, ASD: Atrial septal defect, TEE: Trans esophageal echocardiography |
ASO治療年齢はS-ASO群(8.5±2.5歳)に比較し,L-ASO群(6.2±2.6歳)が有意に低年齢であり,治療からFollow時までの期間はS-ASO群(1.1±0.3年)に比較し,L-ASO群(1.3±0.4年)が有意に長く,Follow-up時年齢は有意に低年齢であった.(S-ASO群(9.6±2.4歳): L-ASO群(7.5±2.6歳))
Qp/QsはS-ASO群(1.8±0.2)に比較し,L-ASO群(2.8±0.9)が有意に高値であった.
経食道エコーにより計測した最大心房中隔欠損孔サイズは,S-ASO群(10.3±2.0 mm)に比較し,L-ASO群(16.4±3.1 mm)が大きく,その結果として,使用した閉鎖デバイスサイズはS-ASO群(12±2 mm)に比較し,L-ASO群(20±4 mm)が有意に大きかったが,Max IASは両群に差は認めず,最大心房中隔欠損孔サイズとデバイスサイズの比は,S-ASO群,L-ASO群で有意差はなかった.
左房容積および機能の変化について
1)Follow期における左心房面積および伸展性の比較(Table 4)
Table 4 Atrial area and distesibility at follow up period of ASO group, surgical group and normal control group | ASO | SC | NC | P(ASO vs SC) | P(ASO vs NC) | P(SC vs NC) |
|---|
| Max LA/BSA (cm2/m2) | 10.0±2.0 | 10.1±2.2 | 9.7±1.7 | 1 | 1 | 1 |
| Min LA/BSA (cm2/m2) | 5.0±1.2 | 5.3±1.5 | 3.9±0.9 | 1 | 0.029 | 0.12 |
| LA-Dis | 1.10±0.22 | 1.00±0.44 | 1.51±0.25 | 0.0708 | <0.0001 | 0.0045 |
| Max RA/BSA (cm2/m2) | 9.9±1.5 | 8.4±2.0 | 9.2±1.4 | 0.027 | 0.44 | 0.49 |
| Min RA/BSA (cm2/m2) | 5.3±0.9 | 5.5±1.8 | 3.8±0.7 | 1 | <0.0001 | 0.013 |
| RA-Dis | 0.87±0.27 | 0.59±0.24 | 1.38±0.37 | 0.0019 | <0.0001 | <0.0001 |
| ASO: Device closure group using Amplatzer Septal Occluder, SC: Surgical closure group, NC: Normal control group, Max: Maximum, Min: Minimum, LA: Left atrium, RA: Right atrium, BSA: Body surface area, Dis: Distensibility |
ASO群,外科治療SC群,NC群の3群では,Max LA/BSAでは有意差が認められなかったが,Min LA/BSAではASO群(5.0±1.2 cm2/m2)はNC群(3.9±0.9 cm2/m2)に比べ有意に拡大していた.
左房伸展性LA-Disについては,ASO群(1.10±0.22),SC群(1.00±0.44)ともにNC群(1.51±0.25)より有意に低下していた.
2)デバイスサイズの差による検討(Table 5)
Table 5 Atrial area and distesibility change after ASD closure of S-ASO and L-ASO | Before | Post (after 1-3 days) |
|---|
| S-ASO | L-ASO | p | S-ASO | L-ASO | p |
|---|
| Max LA/BSA (cm2/m2) | 11.0±2.3 | 10.4±1.8 | 0.65 | 11.1±2.4 | 9.4±2.2 | 0.074 |
| Min LA/BSA (cm2/m2) | 5.3±1.6 | 4.7±1.1 | 0.41 | 5.2±1.6 | 4.8±1.2 | 0.31 |
| LA-Dis | 1.33±0.47 | 1.24±0.34 | 0.92 | 1.38±0.34 | 1.04±0.26 | 0.0051 |
| Max RA/BSA (cm2/m2) | 13.5±2.3 | 16.4±2.6 | 0.0048 | 11.3±1.8 | 12.9±2.6 | 0.056 |
| Min RA/BSA (cm2/m2) | 6.7±1.2 | 8.1±1.4 | 0.054 | 6.0±0.8 | 7.1±1.7 | 0.018 |
| RA-Dis | 1.03±0.29 | 1.06±0.24 | 0.097 | 0.91±0.27 | 0.83±0.26 | 0.53 |
| Follow up | | | |
|---|
| S-ASO | L-ASO | p | | | |
|---|
| Max LA/BSA (cm2/m2) | 9.9±2.1 | 10.3±2.0 | 0.21 | | | |
| Min LA/BSA (cm2/m2) | 4.9±1.4 | 5.8±1.1 | 0.3 | | | |
| LA-Dis | 1.21±0.26 | 0.99±0.12 | 0.011 | | | |
| Max RA/BSA (cm2/m2) | 9.9±1.7 | 9.8±1.4 | 0.90 | | | |
| Min RA/BSA (cm2/m2) | 5.1±1.0 | 5.5±0.8 | 0.18 | | | |
| RA-Dis | 0.97±0.34 | 0.78±0.17 | 0.065 | | | |
| ASO: Device closure group using Amplatzer Septal Occluder, SC: Surgical closure group, NC: Normal control group, S-ASO: Smaller device implantation group, L-ASO: Larger device implantation group, Max: Maximum, Min: Minimum, LA: Left atrium, RA: Right atrium, BSA: Body surface area, Dis: Distensibility; (Maximum atrial area−Minimum atrial are)/Minimum atrial area |
ASO前後ではMax LA/BSA, Min LA/BSAともに,S-ASO群とL-ASO群に有意な変化はなかったが,LA-DisはL-ASO群(1.04±0.26)がS-ASO群(1.38±0.34)に比べ有意に低下していた.この結果はFollow期においても同様であった.
右房容積および機能の変化について
1)Follow期における右心房面積および伸展性の比較(Table 4)
Max RA/BSAは,SC群(8.4±2.0 cm2/m2)で小さく,ASO群(9.9±1.5 cm2/m2)とNC群(9.2±1.4 cm2/m2)では有意な差はなかったが,Min RA/ BSAは,ASO群(5.3±0.9 cm2/m2),SC群(5.5±1.8 cm2/m2)ともにNC群(3.8±0.7 cm2/m2)より有意に高値であった.
右房伸展性RA-DisはASO群(0.87±0.27),SC群(0.59±0.24)ともに,NC群(1.38±0.37)より有意に低下しており,SC群はASO群よりさらに低値であった.
2)デバイスサイズの差による検討(Table 5)
ASO前後でのMax RA/BSAは,デバイスサイズに関係なくS-ASO群(pre 13.5±2.3 cm2/m2: post 11.3±1.8 cm2/m2),L-ASO群(pre 16.4±2.6 cm2/m2: post 12.9±2.6 cm2/m2)でASO後低下していた.ASO後Min RA/BSAは,L-ASO群でやや大きい(L-ASO: 7.1±1.7 cm2/m2 vs S-ASO: 6.0±0.8 cm2/m2)が,右房伸展性RA-Disには有意差は見られなかった.
Follow期においては右房面積,右房伸展性にデバイスサイズによる有意差は見られなかった.
左室容積および心機能(Table 6, 7)
Table 6 Cardiac function parameters of three groups | ASO | SC | NC | P (ASO vs SC) | P (ASO vs NC) | P (SC vs NC) |
|---|
| LV EDV/BSA (ml/m2) | 58.4±11.2 | 57.6±10.6 | 62.0±11.3 | 0.84 | 0.49 | 0.47 |
| LV ESV/BSA (ml/m2) | 21.0±3.8 | 22.7±4.3 | 23.9±6.5 | 0.46 | 0.26 | 0.72 |
| LV EF (%) | 64±5 | 61±4 | 62±5 | 0.26 | 0.69 | 0.69 |
| TMF-E (cm/s) | 106±20 | 93±19 | 97±14 | 0.33 | 0.36 | 0.76 |
| TMF-A (cm/s) | 50±15 | 41±11 | 37±13 | 0.071 | 0.042 | 0.33 |
| TMF-E/A | 2.3±0.7 | 2.4±0.4 | 3.0±1.3 | 0.41 | 0.22 | 0.35 |
| IVS-S′ (cm/s) | 7.5±1.4 | 7.5±1.3 | 8.1±1.2 | 1 | 0.29 | 0.19 |
| Lat-S′(cm/s) | 8.8±2.6 | 7.9±1.4 | 9.3±2.3 | 0.66 | 0.66 | 0.47 |
| IVS-E′ (cm/s) | 11.9±2.8 | 13.4±2.4 | 14.0±2.6 | 0.078 | 0.032 | 0.57 |
| IVS E/E′ | 9.2±2.5 | 7.1±1.7 | 7.1±1.6 | 0.03 | 0.022 | 1 |
| Lat-E′ (cm/s) | 17.0±3.4 | 16.3±3.7 | 17.2±3.9 | 1 | 1 | 1 |
| Lat E/E′ | 6.4±1.8 | 5.9±1.1 | 5.9±1.3 | 1 | 1 | 1 |
| TTF-E (cm/s) | 59±12 | 61±11 | 51±8 | 1 | 0.1 | 0.055 |
| TTF-A (cm/s) | 35±15 | 34±10 | 26±4 | 1 | 0.015 | 0.078 |
| TTF-E/A | 1.8±0.5 | 1.9±0.6 | 2.0±0.5 | 1 | 0.36 | 1 |
| RV-S′ (cm/s) | 12.5±2.0 | 9.1±2.8 | 11.6±1.7 | 0.00026 | 0.47 | 0.0029 |
| RV-E′(cm/s) | 14.8±3.2 | 11.2±2.0 | 14.1±2.5 | 0.0017 | 0.51 | 0.0063 |
| RV-E/E′ | 3.9±1.3 | 5.5±3.2 | 3.7±0.7 | 0.0092 | 1 | 0.0012 |
| ASO: Device closure group using Amplatzer Septal Occluder, SC: Surgical closure group, NC: Normal control group, LV: Left ventricle, RV: Right ventricle, EDV: End diastolic volume, ESV: End systolic volume, EF: Ejection fraction, TMF: Trans mitral flow, TTF: Trans tricuspid flow, E: E wave, A: A wave, IVS: Inter ventricular septum, Lat: Lateral site wall in LV, S′: Maximum height of Tissue Doppler flow in systolic phase, E′: Minimum height of Tissue Doppler flow in early diastolic phase |
Table 7 Cardiac function parameters of S-ASO and L-ASO | S-ASO | L-ASO | p |
|---|
| LV EDV/BSA (ml/m2) | 56.4±9.5 | 60.2±12.3 | 0.45 |
| LV ESV/BSA (ml/m2) | 21.1±3.6 | 20.8±4.0 | 0.91 |
| LV EF (%) | 62±4 | 65±6 | 0.21 |
| TMF-E (cm/s) | 100±17 | 111± 20 | 0.18 |
| TMF-A (cm/s) | 47±13 | 53±17 | 0.32 |
| TMF-E/A | 2.3±0.7 | 2.3±0.7 | 0.98 |
| IVS-S′ (cm/s) | 8.1±1.6 | 7.0±1.0 | 0.055 |
| Lat-S′(cm/s) | 9.6±3.4 | 8.1±1.3 | 0.17 |
| IVS-E′ (cm/s) | 13.0±3.2 | 11.0±2.0 | 0.040 |
| IVS-E/E′ | 7.9±1.9 | 10.4±2.3 | 0.0078 |
| Lat-E′ (cm/s) | 16.6±3.8 | 17.4±2.9 | 0.32 |
| Lat-E/E′ | 6.3±1.9 | 6.6±1.7 | 0.6 |
| TTF-E (cm/s) | 53±12 | 64±7 | 0.014 |
| TTF-A (cm/s) | 35±20 | 35±9 | 0.28 |
| TTF-E/A | 1.7±0.5 | 1.9±0.6 | 0.59 |
| RV-S′ (cm/s) | 12.5±2.8 | 12.5±1.0 | 0.48 |
| RV-E′(cm/s) | 14.6±3.3 | 15.0±3.2 | 0.25 |
| RV-E/E′ | 3.3±1.3 | 4.5±1.0 | 0.026 |
| S-ASO: Smaller device implantation group, L-ASO: Larger device implantation group, LV: Left ventricle, RV: Right ventricle, EDV: End diastolic volume, ESV: End systolic volume, EF: Ejection fraction, TMF: Trans mitral flow, TTF: Trans tricuspid flow, E: E wave, A: A wave, IVS: Inter ventricular septum, Lat: Lateral site wall in LV, S′: Maximum height of Tissue Doppler flow in systolic phase, E′: Minimum height of Tissue Doppler flow in early diastolic phase |
LV EDV/BSA, LV ESV/BSA, LV EF, TMF-E, TMF-E/Aについては,ASO群,SC群,NC群間に有意差はなく,さらに,S-ASO群,L-ASO群間にも有意差はなかった.
IVS-E′は,ASO群(11.9±2.8 cm/s)は,NC群(14.0±2.6 cm/s)に比べ有意に低値であり,SC群(13.4±2.4 cm/s)と比較しても低値傾向にあった.また,デバイスサイズが大きいほど低値であった.
IVS E/E′は,逆にASO群(9.2±2.5)で,SC群(7.1±1.7)とNC群(7.1±1.6)に比べ有意に高値であり,デバイスサイズが大きいほど高値であった.
一方,デバイス留置されていないlat E′とlat E/E′は各群間に有意差は見られなかった.
TTF-E, TTF-E/Aは各群に有意差はなかったが,RV-S′とRV-E′は,SC群がASO群やNC群に比較して有意に低値であった.RV-E/E′はSC群で有意に高値であった.
心房面積計測の再現性(CV)についての検討(Table 8, 9)
Table 8 Measurement reproducibility of 3 groups by CV | ASO | SC | NC | P (ASO vs SC) | P (ASO vs N) | P (SC vs N) |
|---|
| Max LA area | 0.10 | 0.06 | 0.06 | 0.071 | 0.071 | 0.87 |
| Min LA area | 0.17 | 0.08 | 0.12 | 0.0017 | 0.012 | 0.95 |
| LA-Dis | 0.20 | 0.21 | 0.17 | 1 | 1 | 0.51 |
| Max RA area | 0.19 | 0.06 | 0.07 | <0.0001 | <0.0001 | 0.93 |
| Min RA area | 0.16 | 0.09 | 0.09 | 0.0055 | 0.0021 | 0.84 |
| RA-Dis | 0.25 | 0.29 | 0.13 | 1 | 0.016 | 0.0025 |
| CV (Co variation)=Standard deviation/mean. ASO: Device closure group using Amplatzer Septal Occluder, SC: Surgical closure group, NC: Normal control group, Max: Maximum, Min: Minimum, LA: Left atrium, RA: Right atrium, BSA: Body surface area, Dis: Distensibility; (Maximum atrial area−Minimum atrial are)/Minimum atrial area |
Table 9 Measurement reproducibility of S-ASO and L-ASO by CV | S-ASO | L-ASO | p |
|---|
| Max LA area | 0.08 | 0.13 | 0.017 |
| Min LA area | 0.14 | 0.20 | 0.078 |
| LA-Dis | 0.18 | 0.21 | 0.59 |
| Max RA area | 0.16 | 0.21 | 0.056 |
| Min RA area | 0.15 | 0.17 | 0.55 |
| RA-Dis | 0.23 | 0.27 | 0.45 |
| CV (Co variation)=Standard deviation/mean. S-ASO: Smaller device implantation group, L-ASO: Larger device implantation group, Max: Maximum, Min: Minimum, LA: Left atrium. RA: Right atrium, Dis: Distensibility; (Maximum atrial area−Minimum atrial are)/Minimum atrial area |
左房の面積計測の再現性については,最大面積計測では3群間に有意差はなかったが,最小面積計測の再現性はASO群のばらつき(CV: 0.17)が大きかった.右房については,最大面積測定と最小面積測定の再現性において,ASO群のばらつき(CV: 0.19, 0.16)と大きかった.心房の伸展性については,左房伸展性で各群間の差はなかったが,右房ではASO群(CV: 0.25)とSC群(CV: 0.29)で大きい結果であった.
デバイスサイズによる面積計測の再現性についての検討では,左房最大面積測定において,S-ASO群(CV: 0.08),L-ASO群(CV: 0.13)となり,デバイスサイズが大きいとばらつきが大きくなった.
- 心房の面積指標では,ASO前後での左房面積の変化はなく,デバイスサイズによる有意差は認めなかった.左房伸展性指標は正常群に比較して留置直後から低下し,さらにデバイスサイズが大きいL-ASO群のほうがS-ASO群に比べ低下し,1年以上経過しても代償されなかった.
- 一方,ASO後の右房面積は,速やかに減少した.右房の伸展性指標は,留置直後から低下し1年以上経過しても正常小児群に比べ低下していたが,外科的閉鎖群のほうがより低下していた.右房最小面積はデバイスサイズが大きいL-ASO群のほうがS-ASO群に比べ拡大していたが,右房最大面積,右房伸展性の指標ではデバイスサイズによる有意差は認めなかった.
ASO前後の急性期の心房面積の変化
ASO前後での左房面積の急性変化はなく,デバイスサイズによる有意差は認めなかったことから,小児においてはデバイス閉鎖による左房への前負荷の増加に対する左房容積変化はすぐには生じないと考える.
一方,ASO前の右房面積は正常群より大きいが,デバイス留置後は正常群の右房面積との差は認めなくなることから,いったん閉鎖してしまうと右房の容量負荷は速やかに減少し正常化すると考える.
ASO前後での心房伸展性の変化
今回,われわれは心房の伸展性としてDistensibility=(最大心房面積—最小心房面積)/最小心房面積を用いた.この指標は,心房のreservoir機能を反映する指標で心房の受動的伸展性を示す指標として用いた4–6).左房伸展性はASO留置直後から低下していた.この左房伸展性の低下は,デバイスサイズが大きいL-ASO群のほうがS-ASO群に比べ大きく,1年以上経過しても代償されずに低下したままであった.
一方,右房伸展性は,デバイスサイズに関係なくASO直後から低下しており,1年以上経過しても代償されず低下したままであった.
ASO留置後の左右心房の伸展性の低下は,非伸展性デバイス留置によるものと考えられた.
遠隔期の心房伸展性
今回の検討では,ASO群において左房および右房全体の伸展性は,正常小児群に比べ低下していた.この両心房全体の伸展性の低下は,心房中隔に留置された非伸縮性のASOデバイスのために制限された心房中隔の伸展性を両心房の自由壁の伸展性では代償できていないことを示唆している.
このことは,留置したデバイスサイズが大きいほど左房全体の伸展性が低下していたことから,心房中隔の非伸縮部分の左房全体への伸展性への影響が大きいことがわかる.
実際,ASO留置後の心房中隔僧帽弁弁輪部のE′は留置したデバイスのサイズに比例して低下しているが,非留置側の弁輪部のE′はその代償的に大きくなることはなく正常群と比べてもほとんど変化していない.留置側の弁輪部速度と非留置側では弁輪速度に差が生じている.
このことは,Castaldiら9)のデバイス留置直後の左室機能の検討の報告からも,閉鎖栓径が17 mm以上の大きなデバイスを入れた群で,前壁中隔セグメントのcircumferentialとradial strain rateが有意に低下しているとしていることから,大きなデバイス留置ではデバイスが僧帽弁弁輪部に近接することになり,その結果として同部の弁輪部運動がより影響を受けさらに心房伸展性が影響されていると推察される.
この左房伸展性の低下を左室拡張能から見たMasutaniら10)の検討でも,ASO後中隔側でのE/E′が9.4±0.45に対して側壁側が5.9±0.31とわれわれの報告と同様に差があると報告している.
ただ,非留置側での代償機転が十分に働かない理由については,今回の検討結果からは不明であり,今後の検討を要する.
外科治療群との心房伸展性の比較
外科治療群では,ASO群に比べ非伸縮性のデバイスを留置しないことから当初は心房伸展性が保たれていると予想していた.ところが,今回の検討で予想外に,外科治療群で心房伸展性が正常群よりも低下していたことは興味深い結果であった.その原因としては,外科治療群ではASO群より右房のS′やE′が有意に低下していたことから,手術による心房切開や心膜切開の影響,人工心肺使用の影響が,非伸縮性のデバイス留置による伸展性の低下以上に,遠隔期の心房機能に影響していることが示唆された.
Salvoら11)はデバイス治療群,外科治療群,正常群の3群で心房中隔以外の心房自由壁の長軸方向のストレインを組織ドプラで測定して比較した報告をしているが,彼らの結果では,ASO群と正常群では差が見られず,われわれと同様に外科治療群で低下していると報告している.
この心房伸展性の保全という観点からすれば,心房中隔への非伸縮性の異物であるデバイス留置のデメリットを差し引いても,ASO治療のほうが外科治療より心房伸展性の保全には優位な治療といえるかもしれない.
ただ,左房と右房の伸展性は,デバイス閉鎖群と外科的閉鎖群ともに正常群より低下しているため,両治療による心房中隔欠損閉鎖治療症例においては,心房伸展性低下に伴う長期的心房機能異常による心房性不整脈の発生や,心室拡張能への影響など長期的な観察評価が必要と考えられた.
心房面積測定の精度
今回の検討方法として,心尖部四腔断面の2D画像による計測を用いた.この2D画像の計測により心房機能を心房面積と面積変化から計算されるDistensibilityで評価することは,ASO群で測定誤差が生じやすいことが問題である.測定誤差の要因は,被験者の呼吸,循環生理に基づく変化に加え,ASOデバイスによるサイドローブなどにより,心房内腔との境界が不明瞭であることが,測定の再現性に影響を与えていると考えられる.実際われわれの測定法に関する検証でも,左房より右房,最大容積より最小容積での測定誤差が大きかった.そのため,計算上最小容積が分母になるDistensibilityでは,測定誤差が大きくなる傾向が見られた.
現在,左房機能の評価には,2Dエコーでは心尖部四腔断面および二腔断面からの容量の推定や3Dエコーによる容量計測が推奨されている12, 13).しかしながら,小児エコーでは心尖部二腔断面での心房長軸方向の描出が困難である例が多く,後方視的にデータを収集した今回の検討では,心尖部四腔断面での面積計測で検討せざるをえなかった.
測定の精度と再現性を向上させるためには,ハーモニクスや画質の調整に加え,四腔断面と二腔断面の2方向での計測や,3Dエコーを用いた3D Volume計測などでの検討を考える必要があると思われる.
Limitations
本研究は,心エコー計測による後方視的研究であるためにさまざまなLimitationが存在する.
第一は,本論文の中で心房伸展性distensibilityという指標を用いているが,本来の生理学的概念であるdistensibilityは単位圧変化に対する心房面積の変化として求められるべきものであるが,ここでは心房のreservoir機能を表す指標として既存の報告にならって使用している4–6).したがって本論文中のdistensibilityは心房のreservoir機能を表す指標として考慮されるべき心エコー指標でありこの点は注意が必要である.
次に解析対象症例については,解析に必要とする断面がきちんと描出された症例を対象とせざるをえなかったために解析可能であった症例が全体の約1/2で,採用された症例に偏りがある可能性は否定できない.
また,本論文中では心房の伸展性を心尖部四腔断面による心房面積変化の指標として評価しているが,考察で記載した通り描出された断面に直角方向の情報が加味されていないため,デバイス留置部の影響がより強く結果に影響している可能性は否定できない.
複雑な3次元的構造を持つ左右心房の容積変化と伸展性を求めるためには,2Dエコー評価よりは3Dエコーによる心房機能評価による解析が必要と考えられる14, 15).
小児期に行ったASOデバイス留置が心房容積や心房伸展性に及ぼす影響について心エコーで検討した報告は少ない.今回われわれの行った検討では,ASO後は,左右両心房ともに伸展性(reservoir機能)の低下が認められ,特に左房はデバイスサイズが大きいほど伸展性が低下していた.
このことは,心房中隔に留置された非伸縮性のデバイスにより心房中隔の伸展性が低下する上に,非留置側の心房筋の伸展性の代償機転が働いていないため心房全体の伸展性の低下をきたしているということを示している.
この左房と右房の伸展性については,デバイス閉鎖群ばかりではなく外科的閉鎖群においても正常群より低下していたことは,両治療による心房中隔欠損閉鎖治療症例においては,心房伸展性の低下を含む心房機能異常に伴う心房性不整脈の発生や,心室拡張能への影響など長期的な観察評価が必要であると考えられた.
利益相反
日本小児循環器学会の定める利益相反に関する開示はない.
引用文献References
1) Dickinson DF, Arnold R, Wilkinson JL: Congenital heart disease among 160,480 live born children in Liverpool 1960 to 1969. Implications for surgical treatment. Br Heart J 1981; 46: 55–62
2) Butera G, Carminati M, Chessa M, et al: Percutaneous versus surgical closure of secundum atrial septal defect: Comparison of early results and complications. Am Heart J 2006; 151: 228–234
3) 上田秀明,柳 貞光,宮田大揮,鉾碕竜範:Amplatzer Septal Occluder(ASO)を用いた経皮的心房中隔欠損閉鎖術の安全性および外科手術の比較.日小児循環器会誌2012; 28: 250–257
4) Hsiao SH, Chiou KR, Lin KL, et al: Left atrial distensibility and E/e′ for estimating left ventricular filling pressure in patients with stable angina: A comparative echocardiography and catheterization study. Circ J 2011; 75: 1942–1950
5) Tanaka N, Takigiku K, Takahashi K, et al: Assessment of the developmental change in the left atrial volume using real time three-dimensional echocardiography. Echocardiography 2015; 32: 1131–1139
6) Yeh J, Aiyagari R, Gajarski RJ, et al: Left atrial deformation predicts pulmonary capillary wedge pressure in pediatric heart transplant recipients. Echocardiography 2015; 32: 535–540
7) Lang RM, Bierig M, Devereux RB, et al: Members of the Chamber Quantification Writing Group; American Society of Echocardiography’s Guidelines and Standards Committee; European Association of Echocardiography: Recommendations for Chamber Quantification: A report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, Developed in Conjunction with the European Association of Echocardiography, a Branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005; 18: 1440–1463
8) Kanda Y: Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant 2013; 48: 452–458
9) Castaldi B, Santoro G, Salvo G, et al: Impact of the Amplatzer atrial septal occluder device on left ventricular function in pediatric patients. Pediatr Cardiol 2013; 34: 1645–1651
10) Masutani S, Taketazu M, Ishido H, et al: Effects of age on hemodynamic changes after transcatheter closure of atrial septal defect: Importance of ventricular diastolic function. Heart Vessels 2012; 27: 71–78
11) Salvo G, Drago M, Pacileo G, et al: Atrial function after surgical and percutaneous closure of atrial septal defect. J Am Soc Echocardiogr 2005; 18: 930–933
12) 石井徹子:左心房機能の超音波評価.日小児循環器会誌2014; 30: 481–483
13) 森 一博:心エコー図による小児の左房機能評価.日小児循環器会誌2014; 30: 484–487
14) Lang RM, Badano LP, Mor-Avi V, et al: Quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28: 1–39
15) Russo C, Hahn RT, Jin Z, et al: Comparison of echocardiographic single- vs. biplane method in the assessment of left atrial volume and validation by real time three-dimensional. J Am Soc Echocardiogr 2010; 23: 954–960