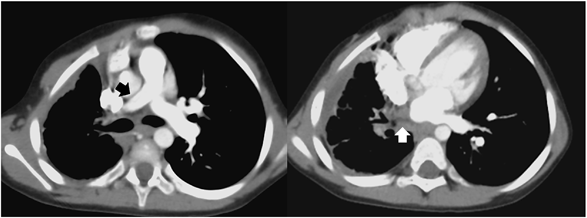
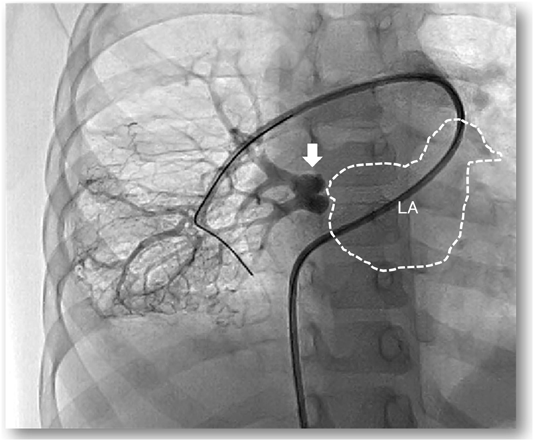
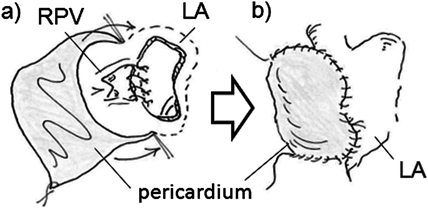
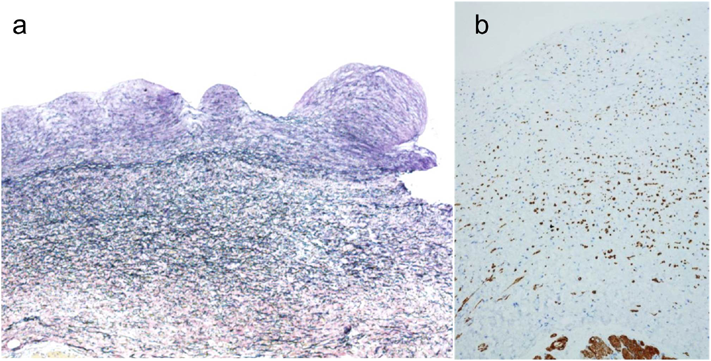
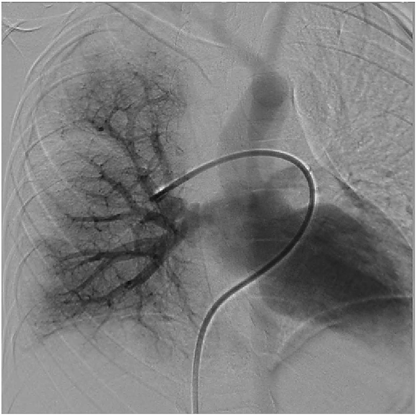
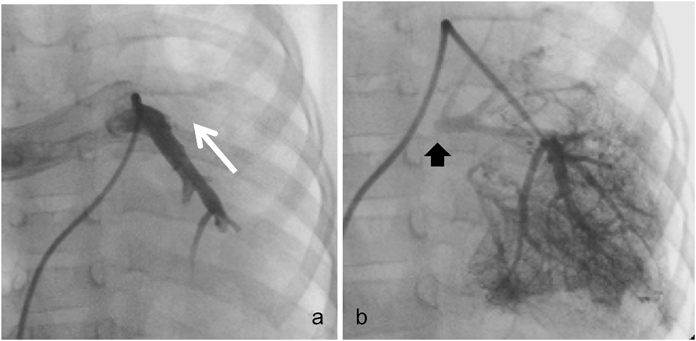
孤立性片側肺静脈閉鎖症の3例Three Cases of Isolated Unilateral Pulmonary Venous Atresia
長友 雄作1,宗内 淳1,渡邉 まみ江1,松岡 良平1,白水 優光1,岡田 清吾1,飯田 千晶1,城尾 邦彦2,落合 由恵2,城尾 邦隆1Yusaku Nagatomo1, Jun Muneuchi1, Mamie Watanabe1, Ryohei Matsuoka1, Hiromitsu Shirozu1, Seigo Okada1, Chiaki Iida1, Kunihiko Joo2, Yoshie Ochiai2, Kunitaka Joo1
1 独立行政法人地域医療連携推進機構 九州病院小児科Department of Pediatrics, Japan Community Health Care Organization Kyushu Hospital ◇ Fukuoka, Japan
2 独立行政法人地域医療連携推進機構 九州病院心臓血管外科Department of Cardiovascular Surgery, Japan Community Health Care Organization Kyushu Hospital ◇ Fukuoka, Japan
受付日:2016年12月14日Received: December 14, 2016
受理日:2017年6月19日Accepted: June 19, 2017
発行日:2017年7月1日Published: July 1, 2017