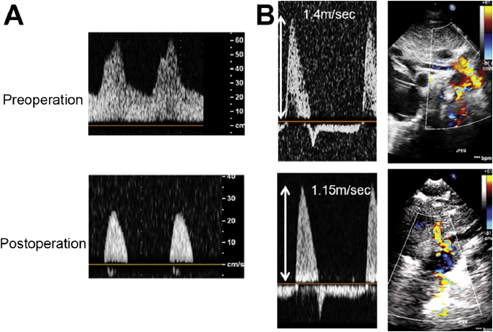
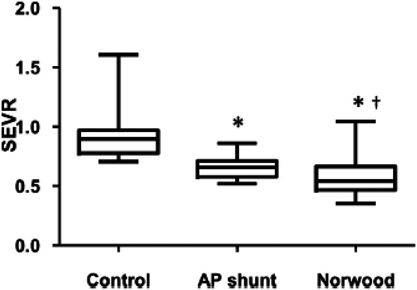
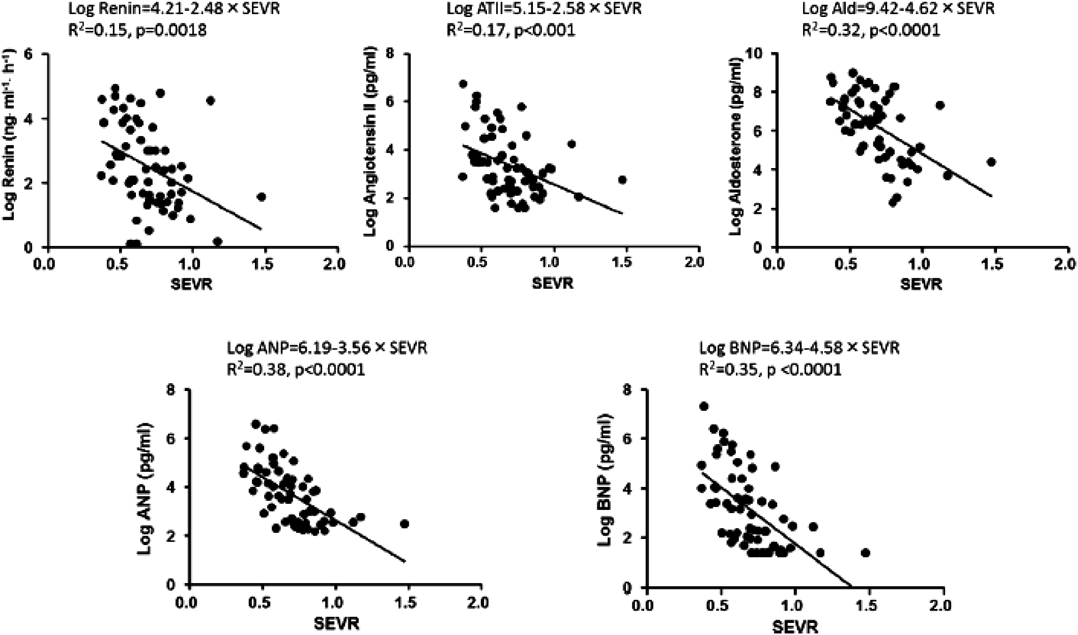
成人先天性心疾患の心血管機能 第2報:至適血行動態を目指した左心低形成症候群の治療戦略Report from the Japanese Society of Pediatric Cardiology and Cardiac Surgery Research Committee on Cardio-Vascular Function in Adult Patients with Congenital Heart Disease: Treatment Strategy for Hypoplastic Left Heart Syndrome Based on the Cardiovascular Pathophysiology
1 埼玉医科大学総合医療センター小児循環器Division of Pediatric Cardiology, Saitama Medical Center, Saitama Medical University ◇ Saitama, Japan
2 メイヨークリニック循環不全研究室Circulatory failure laboratory, Division of Cardiovascular diseases, Mayo Clinic ◇ MN, USA
3 榊原記念病院循環器小児科Division of Pediatric Cardiology, Sakakibara Heart Institute ◇ Tokyo, Japan
4 いわき市立総合磐城共立病院Division of Pediatrics, Iwaki Kyouritsu Hospital ◇ Fukushima, Japan