症例
16歳女児
主訴
労作時胸痛
既往歴
33週早産児 川崎病既往なし
家族歴
母は甲状腺乳頭癌および副腎ホルモン産生腫瘍の治療中
生活歴
喫煙なし 月経周期:整
現病歴
中学生のときから部活動で陸上を始めた.2014年,中学3年生の夏ごろから練習中に胸痛を感じるようになり,近医を受診したところ自律神経失調症と診断され無治療無制限で経過観察された.部活動引退後は症状出現することなく経過した.2015年4月,高校1年生の学校検診の心電図でST低下を指摘された.陸上部を再開し,胸痛症状が再燃した.同年7月,心電図異常の精査目的で近医を受診し,運動負荷心電図でも軽度のST低下を指摘された.その後も短距離走を反復するインターバル走などの激しい練習の時に胸痛が出現していた.また,胸痛は一度出現すると数時間改善しなかった.同年8月に胸痛および心電図異常の精査目的で当院に紹介され受診した.
身体所見
身長152.3 cm,体重44.6 kg, BMI 19.2,血圧107/58 mmHg,脈拍数70/分,呼吸数16/分,SpO2 97%,体温36.8°C,心音I(→),II 0.03 not fixed(→),III(-),IV(-).心雑音なし.呼吸音は清明.腹部は平坦,軟.肝・脾は触知せず.四肢チアノーゼなし.浮腫なし.網状皮斑なし.
血液検査
RBC 386×104/µL, Hb 13.5 g/dL, Hct 41.2%, WBC 9400/µL(neut 67.0%, lymph 23.2%),Plt 28.7×104/µL, AST 19IU/L, ALT 13 IU/L, LDH 177 IU/L, ALP 223 IU/L, T-bil 0.8 mg/dL, TP 7.7 g/dL, Alb 5.0 g/dL, CK 77 IU/L, CK-MB<1 IU/L, Troponin-I<0.015 ng/mL, Glu 98 mg/dL, HbA1c 5.4%, T-Chol 141 mg/dL, TG 70 mg/dL, HDL-C 56 mg/dL, LDL-C 88 mg/dL, BUN 10.8 mg/dL, UA 4.7 mg/dL, Cre 0.75 mg/dL, Na 138 mEq/L, K 3.7 mEq/L, Cl 108 mEq/L, Ca 9.8 mg/dL, CRP<0.02 mg/dL, PT-INR 1.18INR, APTT 24.7 sec, Fibrinogen 263 mg/dL, D-dimer<0.5 µg/dL, FDP<2.5 µg/dL, BNP 10.0 pg/mL, hANP 24.2 pg/mL,レニン活性3.4 ng/mL/hr,アルドステロン123 pg/mL,アドレナリン76 pg/mL,ノルアドレナリン166 pg/mL,ドーパミン10 pg/mL, TSH 0.816 μIU/mL, free T4 1.1 ng/dL, free T3 2.88 pg/mL
胸部X線
心胸郭比43%.肺うっ血なし.
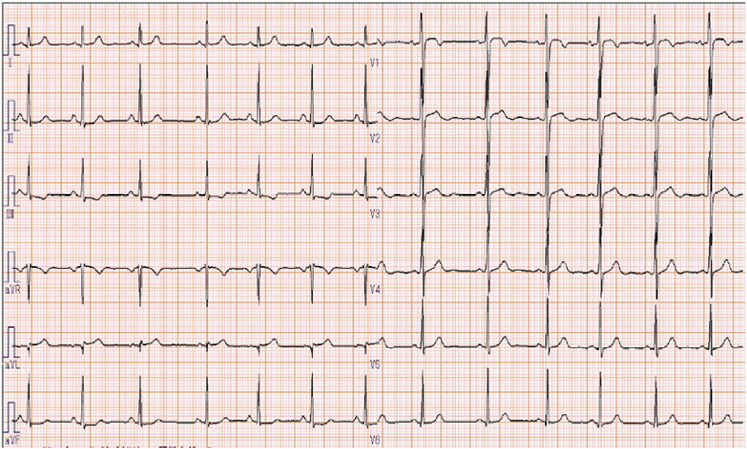
安静時心電図(Fig. 1)
III, aVF誘導でのST低下(<0.1 mV),T波はIII誘導で陰性化,aVF誘導で平定化.V1–2誘導でST上昇(最大0.2 mV)を認める.
心エコー
左室壁運動異常なし.左室拡張なし.左室肥大なし.その他異常を認めない.
トレッドミル運動負荷心電図(Bruce)(Fig. 2)
stageVの時点で胸部圧迫感が出現して終了.II, III, aVF誘導で最大0.15 mV程度のupslopeなST低下あり.また,V1–3でST上昇(V2誘導で安静時0.12 mVが最大0.42 mVとなり0.3 mV上昇)を認める.運動負荷終了後1~2分でST変化は速やかに消失したものの,胸痛は持続した.ニトログリセリンスプレー1push使用したものの効果乏しく,検査後15分で自然回復した.
運動負荷心筋シンチグラフィ(201TI)
運動負荷により胸痛が出現し,シンチグラフィで左室前中隔に灌流欠損(perfusion defect;PD)を認めた(Fig. 3A, B).また,安静後は周辺部のPDは改善しているものの中心部にPDの残存を認めた.心筋カウント最低値は55%であった.
安静時2核種心筋シンチグラフィ(201TI+123I-BMIPP)
後日,運動負荷なしで2核種心筋シンチグラフィを施行した.結果は201TI, 123I-BMIPPともに左室前中隔での取り込み低下(201TI<123I-BMIPP)を認めた(Fig. 3C, D).
エピネフリン負荷心エコー
ボスミン0.1 µg/kgをbolus投与後,0.1 µg/kg/minで持続投与しながら左室短軸像で心収縮を観察した.bolus投与後すぐに胸痛が出現し,左室前中隔で収縮期壁厚増加不良を認めた.
心臓CT
左右冠動脈起始異常および器質的狭窄は認めない.また4DCTで壁運動を評価したところ,安静時から前中隔に壁運動低下と壁菲薄化を認めた(Video 1).
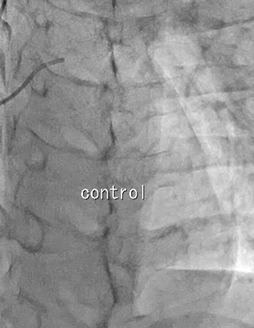
冠動脈造影
カテーテルが上大静脈,右房内に入った時点から胸部不快感の訴えを認めた.冠動脈造影では左右表在冠動脈に器質的狭窄は認めなかった.エルゴノビン負荷により明らかな胸痛が出現し,特に左冠動脈への投与後に心電図のII, III, aVF誘導でST低下,V2–4誘導でST上昇を認めた.負荷後の造影では左右表在冠動脈共に攣縮は認めなかったが,LADで血流速度の低下を認めた.その後自然に冠血流速度と心電図変化は改善したが,胸痛は検査後数時間持続した(Video 2).
経過
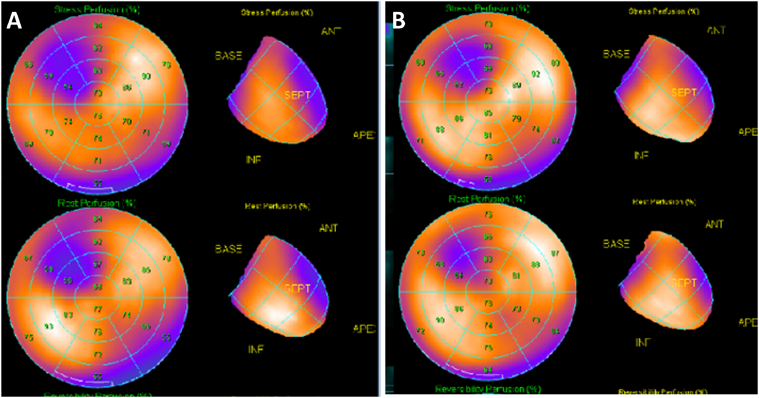
冠動脈造影で表在冠動脈に狭窄および攣縮の所見がなく,心筋シンチグラフィで心筋虚血(梗塞と混在)を認めたことから微小血管狭心症と判断した.2015年8月からatenolol 50 mg分1内服を開始した.その後も症状は改善せず,冬になって胸痛頻度が増加した.同年12月の201TI運動負荷心筋シンチで左室前中隔の虚血の増悪を認めた(Fig. 4A)ため,carvedilol 20 mg分2に内服薬を変更し,部活動を禁止した.その後も胸痛が持続するため2016年2月からdiltiazem 100 mg分1を追加した.その後,胸痛はほとんどなくなり,同年5月の201TI運動負荷心筋シンチで虚血範囲の改善を認めた(Fig. 4B).
微小血管狭心症の発生機序は冠血流予備能(coronary flow reserve: CFR)の低下と冠微小血管の攣縮があるとされる.CFRとは生理的血管拡張刺激に対する微小血管の拡張反応のことであり,CFRが低下すると,需要に見合うだけの血管拡張が得られず,いわゆるデマンド型の心筋虚血をきたすと考えられている.また攣縮は安静時胸痛をきたす.このため微小血管狭心症は労作時および安静時胸痛のいずれもきたす可能性があり,また症状の持続時間が長い傾向(10分以上であることが稀ではなく,半日や1日持続するという報告もある)がある.本症例の場合も,運動誘発性の胸痛であり,発作の持続時間が数時間に及ぶことからCFR低下と攣縮の両方の機序による狭心症と考えられる.
本疾患は(1)狭心症に矛盾しない胸痛症状を有し,(2)表在冠動脈に器質的狭窄や誘発可能な攣縮がなく,(3)胸痛時に虚血を示唆する所見があり,(4)心筋症などの胸痛の原因となる他の疾患が除外されることで診断される2).しかし,多くの場合で既存の検査で心筋虚血を示唆する典型的な所見が得られず,確定診断は容易ではない.このことは,本疾患が心内膜側から順に虚血に陥る表在冠動脈病変による虚血とは異なり,必ずしも主たる冠動脈支配に属性なく発生し,心筋層内でもpatchyな病変分布となることに起因すると考えられる3).本症例は学校検診の心電図自動解析でII, III, aVF誘導のST低下を指摘されて受診に至ったが,当初は安静時心電図も運動負荷心電図も有意な虚血の所見はないと考えていた.しかし,狭心痛と考えられる症状の訴えが強かったため,心筋シンチを施行したところ,左室前中隔に虚血と梗塞の混在を示唆する所見が得られた.その結果を踏まえて後方視的に考えると,V1–2で軽度のST上昇を認め,II, III, aVFの所見は鏡面変化の可能性が考えられた.冠動脈造影で,エルゴノビン負荷により,表在冠動脈に狭窄や攣縮が認められないにもかかわらず狭心痛が誘発され,またそのときにV2–4誘導でST上昇,LADで冠血流速度の低下を認め,心筋シンチ所見とも矛盾しないことからLAD領域の冠微小循環障害の存在が示唆された.また,本症例は上記診断基準の(4)にあたる糖尿病や高脂血症などの全身疾患は認めず,既知の心筋症の診断基準も満たさないことから微小血管狭心症と判断した.
本症例は,心筋シンチのPDの範囲が古典的心筋梗塞と異なり丸くpatchyな分布であることや,心筋シンチで広範な心筋障害が示唆されるにもかかわらず心電図やエコーや4DCTの所見は軽微であることが特徴的である.これは微小血管病変が表在冠動脈支配に属性なく,心筋層内でpatchyに発生したことにより,壊死した心筋と正常な心筋がモザイク状に混在している可能性が考えられ,このことは微小血管狭心症の病態と合致している3).しかし,微小血管狭心症は心電図変化ではST低下,心筋シンチでは正常所見となることが多く,本症例のようなST上昇や心筋障害(梗塞)を示唆するようなPDを示すことは稀である.冠微小循環障害は,心筋症など微小血管狭心症以外の病態でも発生することが知られており4),心筋症は本症例でも重要な鑑別疾患に挙がると思われる.現時点では既知の心筋症を強く疑う所見は認めず,微小血管狭心症と診断しているが,今後何らかの心筋症が顕在化してこないか慎重にフォローする必要がある.
またCSXの患者で,心カテ中のカテーテルの動きや心房内への生食注入など,通常では胸痛を生じえない軽微な刺激により狭心痛を訴えることが報告されており,心内刺激に対する閾値の低下がCSXの病態ではないかというpain sensitivity theoryがある5).本症例もカテーテル検査中にSVCや心房内にカテ先が到達した時点で心臓に圧迫感を訴えており,本疾患の病態を考えるうえで非常に興味深い.
これまでCSXの生命予後は良好と考えられていたが,近年CSX患者は心血管イベント発生率が高い可能性が示唆されており1),またCFR低下を認める狭義の微小血管狭心症では特に予後が悪いとする報告もある6).本疾患はCFRを検査できていないものの,上記の特徴的な所見から,重症化する可能性が考えられたため積極的な治療を行う方針とした.微小血管狭心症の治療は喫煙,飲酒,過労などの危険因子となる生活習慣の是正と薬物治療がある2).薬物治療としては狭心症と同様,硝酸薬,β遮断薬,カルシウム拮抗薬,ACE阻害薬などが選択される.しかし,冠動脈病を有する狭心症と比較して薬物治療の有効性は低く,それぞれの薬剤の効果に関しては文献により様々であり,第一選択薬も海外と国内の文献で異なるなどコンセンサスのとれた治療法がないのが現状である.国内ではverapamilやnifedipineなどのカルシウム拮抗薬が最も使用されている7).カルシウム拮抗薬は微小血管に対する血管拡張作用があると考えられ,国内外で有効性が確認されている.しかし海外の研究でdiltiazemがCFRを改善しなかったことや8),atenololとamlodipineと硝酸薬を比較した研究でatenololのみ狭心症症状の軽減に有効であったことが報告されており9),海外ではβ遮断薬が第一選択薬とされることが多い.本症例では労作性胸痛が主症状であったことからデマンド型心筋虚血の治療としてβ遮断薬を選択したが,治療開始後に症状の悪化を認めた.β遮断薬により血管攣縮が助長された可能性を考慮し,Ca拮抗薬を併用したところ症状の改善を認めた.