症例
40歳,女性.
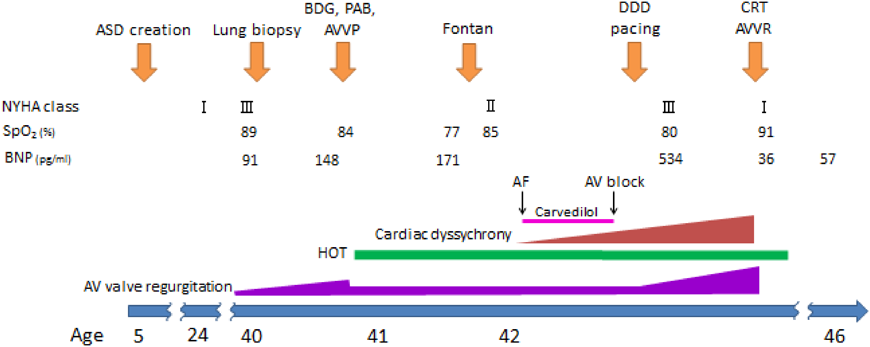
臨床経過をFig. 1に,カテーテル検査所見をTable 1に示す.
Table 1 Cardiac catheter data | | | | 6 months after Glenn procedure | 1 year after Fontan | 4 years after CRT and AVVR |
|---|
| Age (years) | 5 | 24 | 40 | 41 | 42 | 46 |
| SaO2 (%) | 62 | 83 | 90 | 77 | 90 | 89 |
| mPAP (mmHg) | 60 | 25 | 19 | 13 | 10 | 10 |
| Qp/Qs | | 1.91 | 2.32 | 0.89 | 0.76 | 0.82 |
| Rp (Woods unit·m2) | | 2.6 | 3.3 | 1.7 | 2.6 | 1.1 |
| RVEDVI (mL/m2) | | | 171 (208% of N) | 134 (157% of N) | 157 (188% of N) | 136 (160% of N) |
| RVEF (%) | | | 51 | 50 | 28 | 53 |
| CI (L/min/m2) | | 2.4 | 1.7 | 2.5 | 1.68 | 2.14 |
| AVVR: atrioventricular valve replacement, CI: cardiac index, CRT: cardiac resynchronization therapy, mPAP: mean pulmonary artery pressure, Qp/Qs: pulmonary-to-systemic blood flow ratio, Rp: pulmonary vascular resistance, RVEDVI: right ventricular end-diastolic volume index, RVEF: right ventricular ejection fraction |
Fontan手術までの経過
1,950 gで出生した.他院で心疾患を指摘されたが,治療不可能として経過観察されていた.5歳時(1973年)に当院を紹介された.心臓カテーテル検査で完全大血管転位(d-TGA),心室中隔欠損,肺高血圧(肺動脈圧:78/50(60)mmHg)と診断され,その際の動脈血酸素飽和度は62%であった.Rastelli手術目的に手術を行ったところ,循環停止下で僧帽弁閉鎖が判明し,心房中隔欠損作成術のみを行った.24歳時の検査で肺動脈圧は40/18(25)mmHg,肺/体血流比(Qp/Qs)は1.91,肺血管抵抗(Rp)は2.6 Woods unit·m2であった.平均肺動脈圧(mPAP: mean pulmonary arterial pressure)が15 mmHg以上であったため,Fontan手術の非適応とされた.
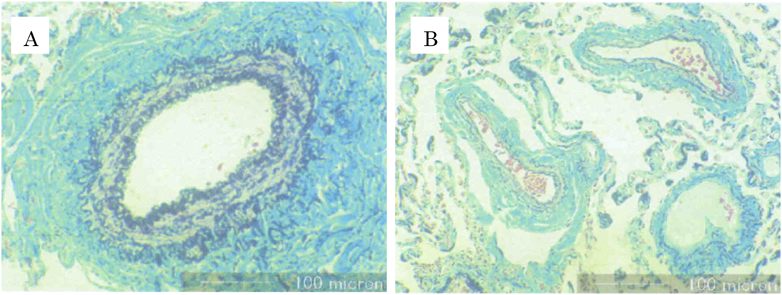
39歳ごろから房室弁逆流が増強し,40歳時に労作時の呼吸困難が出現した.SpO2は89%であった.心臓カテーテル検査で,肺動脈圧は29/11(19)mmHg,Qp/Qsは2.32,Rpは3.3 Woods unit·m2,PA indexは420 mm2/m2であった.体心室である右心室の拡張末期容積係数(RVEDVI)は171 mL/m2(208% of N),右室駆出率(RVEF)は51%と心機能は保たれていた.mPAPの上昇は高肺血流に伴うものと推測されたが,成人例であることから肺生検(左肺)を施行した.肺生検の所見は,preacinar small pulmonary arteryでは中等度の中膜肥厚を認めた(Fig. 2A)が,半径150 µm以下のintraacinar small pulmonary arteryでは中膜肥厚はほとんど認めず(Fig. 2B),いずれも内膜病変はなく,閉塞性肺血管病変の所見は認められなかった.Index of pulmonary vascular disease(IPVD)5)は1.0であった.肺血流量を減少させることでpreacinar small pulmonary arteryの中膜肥厚が退縮する可能性があると診断された.以上から,段階的にFontan手術を行う方針とした.
同年,房室弁形成術と両方向性Glenn(bidirectional Glenn: BDG)手術,肺動脈絞扼術を行った.房室弁は三尖弁形態であり,弁輪縫縮(Edwards MC3 Annuloplasty ring 32 mm(Edwards Lifesciences, Irvine, CA, USA))を行った.肺動脈絞扼術に関しては,成人のBDG手術後において,additional pulmonary flowがない症例では,術後のSpO2の低下が著しく,運動能力が極度に低下するという経験があったため,肺動脈絞扼術を行いadditional pulmonary flowを残す方針とした.肺動脈絞扼術は人工心肺離脱後,3 mm expanded polytetrafluoroethylene(ePTFE)graft(W.L.Gore & Associates Inc., Arizona, USA)を使用して,肺動脈圧をモニターしながら脈圧が少し見られる程度まで絞扼した.最終的には周径30 mmとなった.その際の平均上大静脈圧は15 mmHgで,SpO2は84%であった.
BDG術後6か月時の検査で,mPAPは13 mmHg,Qp/Qsは0.89,Rpは1.7 Woods unit·m2,PA indexは242 mm2/m2,RVEDVIは134 mL/m2(157% of N),RVEFは50%,房室弁逆流は軽度であった.以上の結果から,Fontan手術の適応と判断した.BDG手術後6か月の41歳時に24 mm径ePTFE graftを使用した心外導管型Fontan手術(fenestrated(3mmΦ)extracardiac total cavo-pulmonary connection(EC-TCPC))を行った.術直後の平均中心静脈圧は15 mmHgであった.同時に将来不整脈に対するペースメーカ治療の必要性が生じる可能性を考慮し,右房・右室前面へのペースメーカリードの縫着を行った.
Fontan手術後の経過
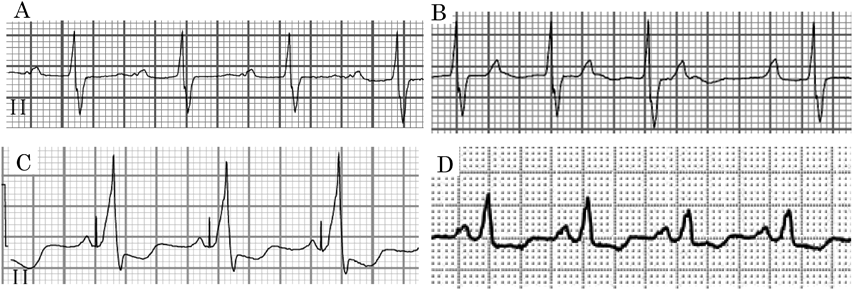
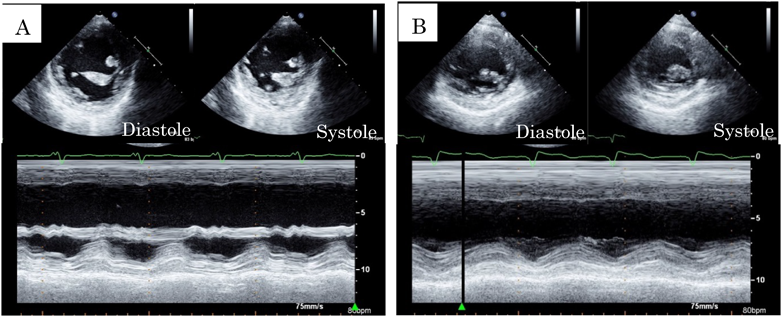
NYHA classII,SpO2 85%前後で経過し,BNPは247 pg/mLであった.術直後の心電図は1度房室ブロック(PR間隔280 ms)であった(Fig. 3A).Fontan術後3か月時に発作性心房細動が出現し,カルベジロールの内服を開始した.内服開始後2か月時に2度房室ブロックとなった(Fig. 3B)ため,Fontan手術時に縫着したペースメーカリードを使用し,DDD 80 bpmでペーシングを開始した.その後,心臓同期不全による心機能低下と房室弁逆流の進行に伴って心不全が増悪し,Fontan術後1年2か月時にはNYHA class III,SpO2 80%前後となり,BNPは534 pg/mLに上昇した.経胸壁心臓超音波検査ではRVEF 33%(Simpson法)であり,前壁と後壁の収縮タイミングのずれを認めた(Fig. 4A).右室短軸でのanterior/posterior wall motion delayは352 msであり,同期不全は高度と判断した.房室弁逆流は中等度に増悪した.心電図上,QRS幅は184 msと拡大していた(Fig. 3C).心臓カテーテル検査ではmPAPは10 mmHg,Qp/Qsは0.76,Rpは2.6 Woods unit·m2であり,RVEDVIは157 mL/m2(188% of N),RVEFは28%,心係数は1.68 L/min/m2と心室の拡大および収縮低下を認め,心臓同期不全が心不全に大きく関与していると判断し,Fontan手術後1年4か月時に外科的再介入を行う方針とした.中等度の房室弁逆流に対しては,形態的にこれ以上の形成術は困難であると判断し,人工弁置換を行うことにした.
再介入手術
房室弁の機械弁置換(27 mm径Carbomedics(Sorin Biomedica, Via Crescentino, Italy))と左室・右室へ新たにリードの追加を行った.リードの縫着位置は,左室リードは人工心肺下に経食道心臓超音波で痕跡的左室の位置を同定し,剥離可能な範囲で閾値が最も低いところを選択して縫着し,右室リードは冠動脈左前下行枝を挟んで左室のリードからできるだけ離して縫着した.人工弁置換術後であることから,A–V delay時間とV–V delay時間は大動脈弁時間速度積分値を参考にし,A–V delay 150 ms,RV first,V–V delay 20 msの設定として心臓再同期療法(Cardiac resynchronization therapy: CRT)を開始した.
術後経過
心電図はQRS幅132 msと短縮し(Fig. 3D),経胸壁心臓超音波検査は右室短軸でのanterior/posterior wall motion delay 74 msと同期不全の改善を認めた(Fig. 4B).NYHA classIとなり,SpO2 91%,BNP 36 pg/mLに改善した.再介入手術後4年時の心臓カテーテル検査では,mPAPは10 mmHg,Qp/Qsは0.82,Rpは1.1 Woods unit·m2,RVEDVIは136 mL/m2(160% of N),RVEFは53%,心係数は2.14 L/min/m2であった.再介入後5年3か月の現在,経過良好である.
成人期におけるFontan適応について
Fontan手術は1971年に三尖弁閉鎖に対する術式として考案された6).小児においては,適応はほぼ確立され,遠隔期の問題点も少しずつ明らかになってきている7–9).しかし,何らかの要因で小児期にFontan手術に到達せず,成人期に至った症例におけるFontan手術の適応とその予後に関しては,未だ明らかになっていない.成人期におけるFontan手術の危険因子として,Burkhartら1)は,術前mPAP 15 mmHg以上,手術時年齢30歳以上,男性を,Podzolkovら2)は,肺血管抵抗4 Woods unit·m2以上,複数適応外因子,中等度以上の房室弁逆流を挙げている.また,Fujiiら3)は,小児期と同様にmPAP 20 mmHg以上を禁忌条件としており,Burkhartらと同様に30歳以上を危険因子としている.Veldtmanら4)は術前の肺動脈圧高値,術後出血に対する頻回の再手術が成人Fontan手術の予後不良因子としている.いずれの報告でも小児期手術と同等の適応基準が用いられており,複数の適応外条件を満たすもの,特に肺動脈圧あるいは肺血管抵抗の高値が危険因子として挙げられているが,成人例に固有の条件ではない.当院では小児同様mPAP 15 mmHg以下,肺血管抵抗4.0 Woods unit·m2未満をFontan手術適応としている.本症例では,40歳時の再評価でmPAP 19 mmHg,Qp/Qs=2.32,Rp 3.3 Woods unit·m2とmPAPが高値であった.我々は,本例のようにFontan手術の適応に迷う症例には肺生検を参考に加えている.
Maedaら10)は,肺病理組織標本のintraacinar small pulmonary arteryからpreacinar small pulmonary arteryまでの30以上の組織切片における中膜の厚さを計測し,そこから推測される半径100 µmでの肺小動脈の中膜の厚さの程度によってBDG手術およびFontan手術の適応を判断している.また,本症例のような症例では,BDG手術を先行して肺血流を制限することで肺小動脈中膜肥厚が退縮すると述べている.本症例は,BDG手術後6か月時の心臓カテーテル検査でmPAP 13 mmHg,Rp 1.7 Woods unit·m2と低下し,Fontan手術に到達しえた.肺生検はFontan手術の適応に迷う症例では有用な検査であろう.
成人期Fontan循環不全
欧米では,Fontan手術後の患者の心不全末期に対しては心臓移植が行われている11).しかし,日本では心臓移植実施数は非常に少なく難しいのが現状である.ErmisらはFontan手術後の心室の収縮および拡張機能障害の原因として,房室弁逆流,不整脈などが関与していると報告している12).また,Fontan手術後の心機能低下の要因として同期不全も挙げられる13).我々はこれらの問題に対して積極的に外科的介入を行うことでFontan手術後の心不全の改善が見込める症例があるのではないかと考えている.本症例では,Fontan後に2度房室ブロックに対しペーシング治療をしており,それに伴いdyssynchronyが出現した可能性も考慮しなければならない.Pediatric and Congenital Electrophysiology Society(PACES)およびHeart Rhythm Society(HRS)から2014年に成人先天性心疾患(Adult congenital heart disease: ACHD)患者に対する不整脈治療のガイドラインが出され,ACHD心不全患者に対するCRTの適応が示されている14).その中で,単心室の患者に対するCRTは,心室の拡張,NYHA classII~IV,QRS幅150 ms以上の症例でClassIIaの推奨とされている.CRTではペーシング位置の決定は効果を左右する最も重要な要素の一つである15).ペーシングリードは二心室形態の症例では経静脈的に埋め込むことが可能であるが,単心室形態,特にFontan術後では不可能であり,心外膜へのペーシングリードの縫着が必要となる16, 17).このような症例に対して,我々は人工心肺下に経食道心臓超音波で観察しながら,ペーシング閾値が低く,最も収縮遅延の大きい部位に新たなペーシングリードを縫着している.また,設定は房室弁流入血流と大動脈弁時間速度積分値を参考にするが,本例のような房室弁置換後では大動脈弁時間速度積分値から最も有効と思われるdelay時間を設定し,CRTを開始している.ACHDの再手術例では,手術時に剥離可能な範囲内でペーシングリードを縫着せざるを得ず,心臓の形態は症例によって様々であるため,個々に合わせた設定が必要となる.また,同期不全の様式も一様ではないため,成人のCRT適応のようにQRS幅を最も重要な指標にすることには問題があるかもしれない.本症例のFontan手術後の外科的再介入によって心不全が改善したのは,房室弁置換による弁逆流の改善に加え,CRTによる同期不全の改善が大きく関与していたと考える.CRTは機能的単心室の心不全に対する治療手段の一つとして期待できるであろう.