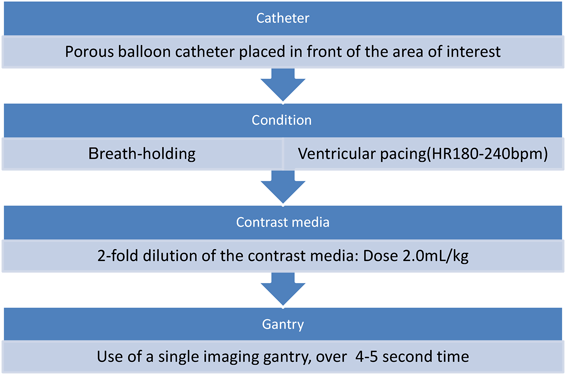
はじめに2013年6月から2016年6月に当院で3DRAを施行した24症例を対象として,3DRAの特徴,使用方法,描出可能な病変等,小児循環器領域での使用経験および有用性を後方視的に検討した.画像評価としては,Table 1に示すEllisら11)の報告した5段階のLikert scaleを用いて小児循環器専門医2名で従来の二方向性血管造影と比較し後方視的に検討した.被曝線量に関しては,対象血管に二方向性血管造影と3DRAが同時に施行された症例から比較検討した.
Table 1 Modified Likert scale concerning the diagnostic utility of flat-detector| Misleading | Misleading information for pre-operative planning or intervention. |
| Not useful | No useable information for pre-operative planning or intervention. |
| Useful | Useful information for pre-operative planning or intervention, but only minimally superior to the already available information of angiographies. |
| Very useful | The scan added important information to what was already available. |
| Essential | The surgery or the intervention could not have been performed appropriately without the additional information provided. |
次に,2010年1月から2016年6月に当院でRastelli術後の肺動脈に対して経皮的バルーン血管形成術(balloon angioplasty: BAP)を施行した46例から,3DRAもしくはCTを併用しかつ治療対象が一病変であった15例を抽出した.この15例(3DRA群5例,CT群10例)で,手技時間,透視時間,造影剤使用量,被曝線量を比較検討した.被曝線量は,実効線量への換算式がモダリティごとに異なり仮定等も含まれ正確な合算値を得ることは難しいため,両者の血管造影での数値を比較した.なお画像撮影として,2013年以降は3DRAを基本とし,直近のconduit交換など外科介入が予想される症例ではCTが選択された.
2群間の比較には,Mann–WhitneyのU検定を用い,有意水準p<0.05を有意差ありとした.3DRAを含む血管造影,CT検査ともインフォームドコンセントを得て行い,臨床研究に関しては後方視的研究のため倫理委員会等の審査は不要と判断された.
3DRAの小児循環器領域での使用および画像評価,被曝線量
3DRA施行24症例の基礎疾患の内訳は,肺動脈閉鎖/心室中隔欠損(PAVSD: pulmonary atresia with ventricular septal defect)/主要体肺動脈側副血行路(MAPCA: major aorto-pulmonary collateral arteries)12例,肺動脈閉鎖/心室中隔欠損3例,ファロー四徴症2例(MAPCA1例を含む),大動脈縮窄2例,左心低形成症候群2例,両大血管右室起始/肺動脈閉鎖,修正大血管転位,大動脈離断が各1例であった.その内13例がRastelli術後症例であった(Table 2).3DRAによる評価対象病変は,MAPCAを含む肺動脈が22例,大動脈が2例で,3D再構築により任意の角度からの病変観察が可能であった.全例で3DRAに加え従来の一方向ないし二方向の血管撮影を併用し診断および治療を行った.24症例中13例で経皮的血管拡張術が施行(Rastelli術後症例8例)され,治療対象病変は肺動脈11例,大動脈2例であった.まず対象病変に対する3DRAを撮影し,その他の造影を施行中に3D再構築を施行,再構築の所要時間は概ね5分以内であった.再構築画像をもとに病変観察の最適角度を決定の上,同角度で治療を実施した.治療手技はBAPが11例,ステント留置が2例であった.このうち5例では,3DRA画像をもとに治療は一方向の血管撮影で完結された.全例で合併症なく治療が完遂された.
Table 2 Study population| case | Age | Diagnosis | Body weight (kg) | Site | Contrast media (2-fold dilution) | Pacing HR | Likert scale | additional information | Intervention |
|---|
| 1 | 9y | PAVSD/MAPCA s/p.UF/Rastelli RVOTO | 46 | RVOT | 45 | 180 | 4 | D | BVP |
| 2 | 9y | PAVSD/MAPCA s/p.UF/Rastelli RVOTO | 26 | RVOT | 30 | 180 | 4 | B, D | — |
| 3 | 3y | PAVSD/MAPCA s/p.UF/BTS | 11 | BTS | 12 | 200 | 4 | B, D | — |
| 4 | 2y | ccTGA,DORV,IAA,Ebstein s/p.DSO(Senning/Jatene) PABS | 11 | RVOT | 24 | 220 | 4 | A (ribbon stenosis), B, D | — |
| 5 | 3y | PAVSD/MAPCA s/p.UF/BTS | 12 | BTS | 20 | 200 | 3 | B, D, F | — |
| 6 | 6y | PAVSD/MAPCA s/p.BTS | 15 | BTS | 15 | 180 | 3 | B, D, F | — |
| 7 | 8y | PAVSD/MAPCA,APW s/p.UF/Rasteli PABS | 25 | RVOT | 50 | 180 | 3 | B, D | — |
| 8 | 6y | PAVSD/MAPCA,PAPVC s/p.UF/Rastelli RVOTO, PABS | 19 | RVOT | 35 | 180 | 4 | A (PA torsion), B, D | — |
| 9 | 5y | TOF/MAPCA s/p.UF/palliativeRastelli PABS | 15 | RVOT | 30 | 200 | 4 | B, D, F | — |
| 10 | 1y | CoA | 11 | Ao | 20 | 240 | 4 | D, E | BAP |
| 11 | 2y | TOF s/p.ICR PABS | 13 | RVOT/SVC | 25 | 210 | 4 | C, D | Stent-imp |
| 12 | 6y | DORV,PA s/p.Rastelli PABS | 12 | RVOT | 25 | 180 | 3 | A (PA torsion), B, D | BAP |
| 13 | 1y | CoA | 11 | Ao | 25 | 240 | 4 | D, E | BAP |
| 14 | 1y | PAVSD s/p.Rastelli PABS | 8 | RVOT | 20 | 240 | 4 | A (ribbon stenosis), B, D, E | BAP |
| 15 | 12y | HLHS s/p.TCPC PABS | 37 | SVC | 45 | — | 4 | A (ribbon stenosis), D | Stent-imp |
| 16 | 1y | PAVSD/MAPCA s/p.UF/Rastelli PABS | 9 | RVOT | 20 | 240 | 5 | A (PA torsion), D, E | BAP |
| 17 | 12y | IAA,AS s/p.Norwood/Rastelli PABS | 60 | RVOT | 60 | 180 | 4 | A (ribbon stenosis), B, D | BAP |
| 18 | 4y | PAVSD s/p.Rastelli PABS | 13 | RVOT | 25 | 180 | 4 | A (ribbon stenosis), B, D, E | BAP |
| 19 | 7y | PAVSD/MAPCA s/p.UF/palliativeRastelli PABS | 19 | RVOT | 40 | 200 | 4 | B, D, E, F | BAP |
| 20 | 7y | PAVSD/MAPCA s/p.UF/palliativeRastelli PABS | 15 | RVOT | 30 | 200 | 4 | A (PA torsion), B, D, F | TAE-MAPCA |
| 21 | 2y | HLHS s/p.TCPC PABS | 13 | Ao/SVC | 30 | 210 | 3 | A (ribbon stenosis), B, C, D | TAE-APCA |
| 22 | 15y | PAVSD s/p.Rastelli PABS | 42 | RVOT | 60 | 180 | 3 | A (PA torsion), D, E | BAP |
| 23 | 2y | PAVSD/MAPCA s/p.UF/BTS PABS | 10 | BTS | 12 | 210 | 4 | B, D, F | BAP |
| 24 | 4y | PAVSD/MAPCA s/p.UF/Rastelli PABS | 12 | RVOT | 25 | 180 | 4 | A (PA torsion), B, D, F | — |
| PAVSD: pulmonary atresia with ventricular septal defect, MAPCA: major aorto-pulmonary collateral arteries, ccTGA: congenitally corrected transposition of the great arteries, DORV: double outlet right ventricle, IAA: interruption of aortic arch, PABS: pulmonary artery branch stenosis, APW: aortopulmonary window, PAPVC: partial anomalous pulmonary venous conection, TOF: tetralogy of Fallot, CoA: coarctation of aorte, PA: pulmonary atresia, HLHS: hypoplastic left heart syndrome, AS: aortic stenosis, UF: unifocalization, RVOTO: right ventricular outflow tract obstruction, BTS: Blalock–Taussig shunt, DSO: double switch operation, ICR: intracardiac repair, TCPC: total cavopulmonary connection, BVP: balloon valvuloplasty, BAP: balloon angioplasty, Stent-imp: stent implantation. TAE: transcatheter arterial embolization, APCA: aortopulmonary collateralartery. A: Mechanism of stenosis. B: Simultaneous visualization of multifocal legions. C: Three-dimensional positional relationship. D: Three-dimensinal visualization of stenotic legions. E: Determination of working angle. F: Accurate evaluation of the remaining lung segment. |
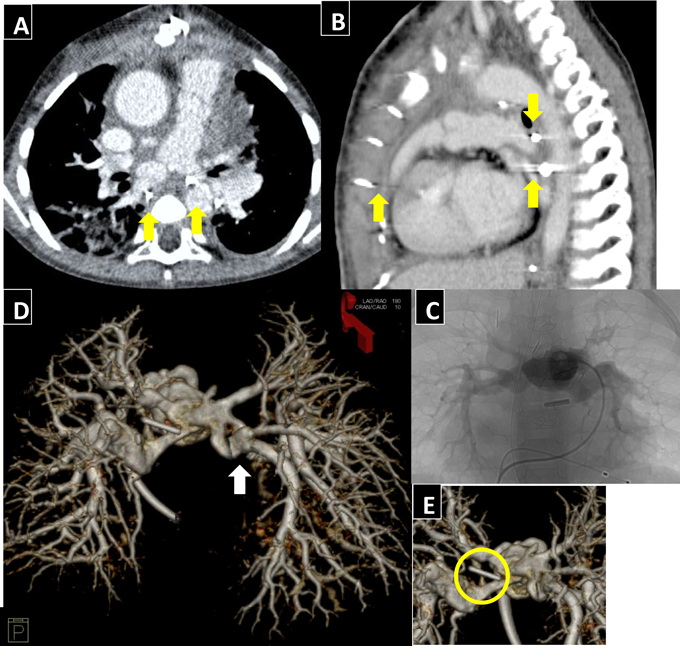
Likert scaleを用いた画像評価では,“essential”; 1例(4.2%),“Very useful”; 17例(70.8%),“Useful”; 6例(25.0%)で“Not useful”や“Misleading”例はみられなかった.全体の75%を占めた“essential”,“Very useful”症例では,‘ribbon stenosis’とよばれる体軸の前後方向の狭窄10)(Fig. 2, Fig. 3B)や屈曲,ねじれ(Fig. 4D)など狭窄の形態的な機序,複数病変の同時描出(Fig. 5)など従来法を上回る画像情報が得られた(Table 2).Fig. 3C, DおよびFig. 6に非心電同期の64列MDCTおよび3DRA画像を提示する.画像のように3DRAではCTに比してより末梢の肺動脈の描出精度が高く,クリップや胸骨ワイヤー等人工物の影響が少ない(Fig. 4)ため,MAPCA症例の残存肺区域(Fig. 5)や人工物周囲のより精密な評価が可能あった.またMDCTでは3DRAに比して狭窄部位が大きく描出される傾向にあった.一方で,3DRAは血管造影による対象血管を限定した撮影のため,CTのように静脈,心室,心房,気管,肺など全体を含む描写は不可能であった.
次に被曝線量に関して,通常の二方向性血管造影および3DRAが同一セッションで施行された症例を提示する(Table 3).DAP(dose area product)を通常の血管造影の正面/側面の合算値および3DRAで比較すると,3DRA1回分が通常の血管造影2.8回分に相当した.さらに,肺動脈のインターベンション時に一般に行われる正面管球を頭側または尾側にふって撮影した場合には,3DRA1回分が通常の血管造影2.3回分に相当した.
Table 3 Radiation exposure| Case | Diagnosis | Age (y) | BW (kg) | Conventional angiography(CA) | 3DRA | DAPratio 3DRA/CA |
|---|
| Injection site | Angle | DAP* (Biplane) | Injection site | DAP |
|---|
| 2 | PAVSD/MAPCA | 9 | 26.3 | RVOT | LAO0・CRA0 | 231.8 | RVOT | 757.6 | 3.27 |
| /LAO90・CRA0 |
| 5 | PAVSD/MAPCA | 3 | 12.1 | BTS | LAO0・CRA0 | 82.6 | BTS | 340 | 4.12 |
| /LAO90・CRA0 |
| 6 | PAVSD/MAPCA | 6 | 15.5 | BTS | LAO0・CRA0 | 125.8 | BTS | 515.2 | 4.1 |
| /LAO90・CRA0 |
| MAPCA*2 | LAO0・CRA0 | 254.7 | dAo | 522.6 | 2.05 |
| /LAO90・CRA0 |
| 8 | PAVSD/MAPCA | 6 | 18.9 | PA | LAO0・CAU45 | 179.9 | RVOT | 518.7 | 2.88 |
| /LAO90・CAU13 |
| 9 | PAVSD/MAPCA | 5 | 14.6 | PA | RAO7・CAU45 | 187.4 | RVOT | 409.6 | 2.19 |
| /LAO90・CAU14 |
| 11 | TOF | 2 | 13.3 | PA | LAO13・CAU45 | 164.9 | PA/LSVC | 360.8 | 2.19 |
| /LAO90・CAU11 |
| 14 | PAVSD | 1 | 7.5 | PA | LAO8・CAU41 | 170.9 | RVOT | 313.3 | 1.83 |
| /LAO90・CAU15 |
| *DAP=frontal view and lateral view (μGy・m2) DAP: dose area product (mGy・m2), PAVSD: pulmonary atresia with ventricular septal defect, MAPCA: major aorto-pulmonary collateral arteries, TOF: tetralogy of Fallot, RVOT: right ventricular outflow tract, PA: pulmonary artery, BTS: Blalock–Taussig shunt, dAo: descending aorta, LSVC: left superior vena cava, CRA: cranial, CAU: caudal |
インターベンションでの3DRA群とCT群の比較(Table 4)
Table 4 Intervention of Rastelli procedure (3DRA vs CT)| N | 3DRA | CT | p-valve |
|---|
| 5 | 10 |
|---|
| Diagnosis | PAVSD/MAPCA:2, IAA:1, PAVSD:1, DORV/PA:1 | TGA3:2, TOF/MAPCA:2, DORV/PA:2, PAVSD/MAPCA:1, IAA:1, TAC:1, APVS:1 | |
| Age (year) | 9.8 (1.1–12.1) | 8.1 (2.7–15.8) | 0.71 |
| Body weight (kg) | 41.7 (8.6–60.1) | 21.2 (14.2–49.8) | 0.71 |
| Procedure time (min) | 121 (114–212) | 121 (76–196) | 0.46 |
| Fluoroscopy time (min) | 31.4 (22.8–98.8) | 43.3 (17.0–61.0) | 0.9 |
| DAP (Gy・cm2)/BW (kg) | 1.2 (1.1–3.1) | 0.8 (0.4–2.4) | 0.1 |
| Contrast media (mL/kg): Angiography | 3.9 (2.2–4.7) | 3.9 (2.6–5.4) | 0.54 |
| Contrast media (mL/kg): Total | 3.9 (2.2–4.7) | 5.9 (4.6–7.4) | 0.003 |
| TGA: transposition of the great arteries, PAVSD: pulmonary atresia with ventricular septal defect, MAPCA: major aorto-pulmonary collateral arteries, DORV: double outlet right ventricle, PA: pulmonary atresia, IAA: interruption of aortic arch, TOF: tetralogy of Fallot, TAC: truncus arteriosus, APVS: absent pulmonary valve syndrome, PPS: peripheral pulmonary stenosis |
全例,一病変の肺動脈狭窄に対してBAPが施行されたRastelli術後症例で,基礎疾患の内訳は,3DRA群5例:PAVSD/MAPCA2例,PAVSD,両大血管右室起始/肺動脈閉鎖,大動脈離断が各1例,CT群10例:完全大血管転位3型,ファロー四徴症/MAPCA,両大血管右室起始/肺動脈閉鎖が各2例,PAVSD/MAPCA,大動脈離断,総動脈管症,肺動脈弁欠損が各1例であった.
2群間の年齢や体重に有意差はみられず,血管造影検査1セッションあたりの手技時間,透視時間,被曝線量,造影剤使用量について検討した.3DRA群,CT群の順で実際の数値を示す.手技時間:121分(114~212)vs 121分(76~196); p=0.46.透視時間:31.4分(22.8~98.8)vs 43.3分(17.0~61.0); p=0.90.造影剤使用量{①血管造影:3.9 mL/kg(2.2~4.7)vs 3.9 mL/kg(2.6~5.4); p=0.54,②血管造影+CT: 3.9 mL/kg(2.2~4.7)vs 5.9 mL/kg(4.6~7.4); p=0.003}.被曝線量(DAP/kg): 1.2(1.1~3.1)Gy・cm2/kg vs 0.8(0.4~2.4)Gy・cm2/kg; p=0.10.なお,手技時間はシースの挿入から抜去までとし,造影剤使用量は血管造影のみおよびCTとの合算値を,被曝線量は血管造影のみで比較した.
実際の症例や画像を提示する.
①症例1(Case No.1)(Fig. 3)
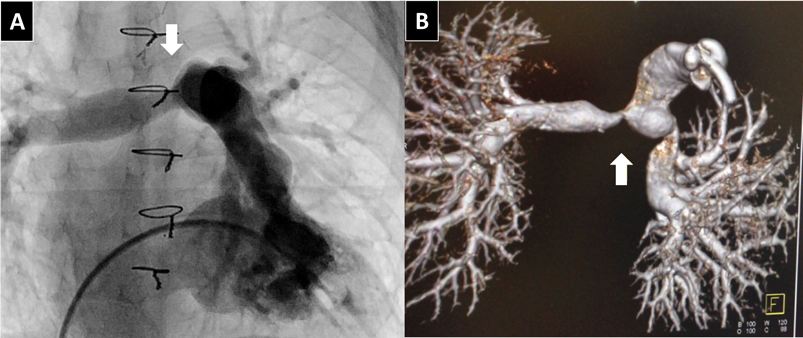
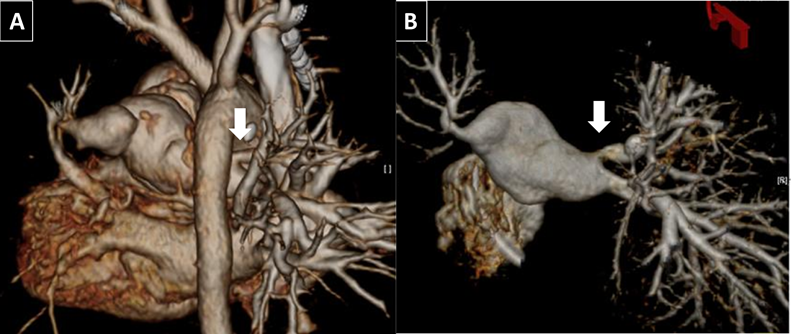
35週1777 gで出生した気管狭窄を合併したPAVSDの症例で,生後4日に気管形成術,2か月時に体肺動脈短絡術,10か月時にRastelli術施行.術後より指摘された分岐部肺動脈狭窄に対して,1歳3か月時にバルーン血管拡張術(BAP)を施行した.3DRAにより,左右肺動脈の‘ribbon stenosis’を一度に描出し,狭窄部位の詳細を評価したうえで,各々に対して至適角度でBAPを施行した.左肺動脈は,最狭部径2.6 mm,参照血管径5.7 mmに対し,血管拡張用バルーンSynergy™(Boston Scientific, Natick, MA)8.0×20 mm,右肺動脈は,最狭部径3.5 mm,参照血管径6.7 mmにSynergy™(Boston Scientific, Natick, MA)9.0×20 mmを使用し,左室圧に対する右室圧比(RVP/LVP)は0.88→0.64と低下した.CはRastelli術後退院前のCT画像で同角度の3DRA画像をDに示した.
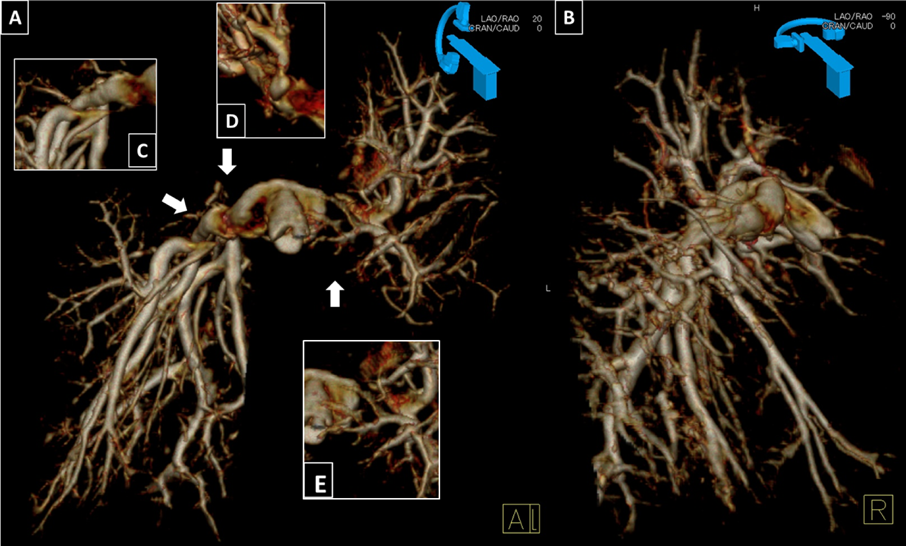
②症例2(Case No.2)(Fig. 5)
PAVSD/MAPCAの症例で,前医にて2歳時に右uniforcalization/体肺動脈短絡術,当院にて6歳時に肺動脈形成/体肺動脈短絡術,7歳時に左uniforcalization/ASD閉鎖/palliative Rastelli術施行.術後半年でカテーテル検査を施行した.3DRAによる3D再構築画像(A:正面像,B:右側面像)を用いて詳細な残存肺区域の推定を行い8区域と推定された.術後肺動脈狭窄は左右に複数箇所存在し,肺区域が少ないことからリスクの分散を考慮し半年間隔で段階的なBAPを施行した.最初に左肺動脈(E),最狭部径3.7 mm,参照血管径7.0 mmに対してConquest™(Bard Peripheral Vascular, Inc., Tempe, AZ)8.0×20 mm,半年後に右肺動脈(C),最狭部血管径1.8 mm,参照血管径5.4 mmに対して,Mustang™(Boston Scientific, Natick, MA)6.0×20 mm, peripheral cutting balloon(Boston Scientific, Natick, MA)6.0×20 mm,右肺動脈(D),最狭部血管径2.9 mm,参照血管径6.1 mmに対してMustang™(Boston Scientific, Natick, MA)7.0/8.0×20 mmを使用した.術後,SpO2: 95%程度まで上昇がみられた.
3DRAの画像特性,適応
3DRAは目的部位によって造影剤注入用カテーテルの位置や造影剤注入,撮影タイミング,心室オーバードライブを設定することにより関心領域,特に動脈性病変を強調した画像描出が可能となる.特にオーバードライブは,心拍出量を低下させ造影剤の拡散を抑えることで,回転撮影終了までの不明瞭化を防ぐとともに,心収縮によるmotion artifactを抑え,目的部位への造影剤の直接注入と合わせて,血管壁の性状をより明瞭に描出することを可能とする10).
また,一般的な三次元画像と同様に任意の角度から観察が可能であり,Zahnらの報告10)の多発性肺動脈狭窄のような複数病変の同時描出やBermanらの報告12)のような屈曲の強い血管の描出にも優れた効果を発揮する.
加えて3DRAの有用性として人工物留置例,例えば脳動脈瘤術後症例でクリップによるハレーションの影響でCTにて観察困難な病変も良好な描出が可能と報告されている13).
これらをふまえ当院では,Rastelli術後の左右分岐部狭窄や多発性の末梢肺動脈狭窄といった複数病変を有する症例,unifocalization後MAPCA症例の統合化肺動脈のように屈曲やねじれなど複雑な形態をもった血管病変,人工弁置換や対象血管近傍にコイル,クリップ,胸骨ワイヤーなどが使用された病変において3DRAは効果を発揮すると考え,適応を選択している.
3DRAの有用性
3DRAが小児循環器領域,特にインターベンションにおいて有用と考えられる点は主に,任意の角度からの立体的な病変観察,迅速な3D再構築および計測,ワーキングアングルの選別およびロードマップ,被曝線量,造影剤使用量の低減の4点があげられる.
①任意の角度からの立体的な病変観察
3DRAでは三次元化により3DCTと同様に任意の角度から立体的な病変観察が可能となるため,事前に造影角度を考慮する必要がなくなる.また従来の二方向性撮影に比べ70~90%の症例で従来法を上回る病変に関する新たな情報が得られたと報告されている12, 14–16).我々の検討でも全体の75%で従来法を上回る質の画像情報が得られており同様の結果であった.‘ribbon stenosis’などの従来法では描出の難しい病変(Figs. 2, 3)や複数回の撮像が必要であった多発性の病変(Fig. 5)も一度に可視化され,立体的な狭窄形態の評価が可能となった.Table 2にあるように,従来の二方向シネ動画を上回る評価と考えられるが,その理由としては,多角的,立体的に画像再構築されているばかりでなく,オーバードライブなどの工夫により血管形態全体の輪郭を描出していることが,病変の性状把握や肺区域数の把握に優位性が高いためと考えられた.従来法では圧較差等から存在が示唆されながら読影者の経験に基づく想像や,CTや心エコー図といった他のモダリティからの類推に頼っていた病変も明瞭に可視化することで,より視覚的に客観的な診断,評価が可能になると考えられる.
②迅速な三次元再構築および計測
3DRAの三次元再構築は概ね5分以内に可能で,迅速な再構築により術中モニタリングとして効果を発揮する10, 16).迅速性は撮影範囲を限定することでCTのように広範囲の肋骨や脊椎等の処理が不要となる点に起因する.このため事前のCTなど三次元撮影が不要となり,特に状態が不安定な小児例で,複数回の鎮静や造影剤使用によるリスクを軽減することが可能となる.
血管径の計測は,過去の3D再構築画像と従来の二方向性血管造影での血管径は同等との報告16, 17)に基づき,3D再構築画像で角度を調節した最狭部位を測定している.また,血管径の計測にあたっては動脈管などで経験するように心周期の影響を受けることが知られている.3DRAでは,心室オーバードライブにより心収縮による血管拍動の影響が低減され,CTに比して狭窄部位の過大評価を防げる可能性が示唆された.この点はより精密なインターベンションに繋がると思われた.
③ワーキングアングルの選別およびロードマップ
インターベンションは,病変観察の最適角度を決定し,至適造影角度で施行される.3DRAではどんな病変でも一度の造影で最適角度の算出が可能で,複数病変の同時評価も可能である.またインターベンションの補助的ツールとして透視画像とのオーバーレイ表示によるロードマップや同一装置の利点をいかした透視画像と3D画像の連動性がある.Cアーム角度,画像サイズ,寝台位置の変更に3D画像もリアルタイムで追従するため,多角性を維持したままでより迅速な治療が可能となる.このLive 3D roadmapは,実際にステント留置や経カテーテル的大動脈弁留置術(transcatheter aortic valve implantation; TAVI)などの弁留置での有用性が報告されている18, 19).
④被曝線量および造影剤使用量の低減
3DRAでは,多角的観察のため従来法のような複数回の撮像が不要となり血管造影検査1セッションあたり被曝線量や造影剤総使用量の低減が期待されている.この点に関しては実際に様々な報告がされているが結論には至っていない.Corredoriaら20)は3DRAの使用により総DAPが診断カテーテル検査では33%,インターベンションでは16%増加としたと報告,Glocklerら21)は3DRAの使用により従来の二方向性撮影に比べて透視時間は減少,総DAP,造影剤使用量は同等としている.一方で主に冠動脈の領域では総被曝線量,造影剤使用量とも減少したと報告22–24)されており,Zahn10)やBerman12)は3DRA使用時の総被曝線量,造影剤使用量は従来法と同等レベル以下に抑えうるとしている.また,Glatz9),Schwartzら19)は,CT併用に比して血管造影検査1セッションあたりの総被曝線量,造影剤使用量とも同等以下と報告している.
自験例では,被曝線量に関して3DRA1回が通常の二方向撮影2.8回分に相当した.また,CT群との比較においては,血管造影検査1セッションあたりの手技時間や透視時間,被曝線量は同等であったが総造影剤使用量は低減されていた.3DRA施行により手技時間や透視時間の延長がみられない理由としては,至適角度や狭窄部位の正確な計測に加えて同一機器の使用によるCアームおよび寝台のスムーズな移動等による3DRA手技以外の時間短縮が可能であった点に起因すると考えられた.さらに被曝線量に関しては,CT撮影分を加味すると総被曝線量として低減の可能性も示唆された.この点に関しては,今後,シングルプレーンの積極的な使用や3DRAのフレーム数,フレームあたりの放射線量など撮影方法の調整により更なる低減が可能になると思われ,更なる症例の蓄積が必要と考えられた.
3DRAの課題
3DRAは撮像範囲を限定した画像となるため,静脈,心室,心房などを含む全体の描写には向かない.また,Truongら25)は気道の描出を報告しているが,当院では再構築時間を要することもありリアルタイムでの気道情報の提供には至っていない.したがって周辺構造物を含めた情報の必要時,特に直近での再開胸を含む外科手術の可能性がある場合や気管との位置関係が問題になる場合などは現状ではCTを選択すべきと考えている.一方で,気管との位置関係が問題となるステント留置などでこそ,3DRAの利点であるワーキングアングルやロードマップ等が効果を発揮しうるため,気道描出のリアルタイム性を追求するとともに不足情報を従来の二方向性撮影から補填するなどして適応を拡大していくべきと考えている.
また,撮影条件としてペーシングや呼吸停止が必要で,Cアームが回転するため麻酔器等周辺環境の整備が重要となる.そのため通常の血管造影に比べて関わる人員も多くなるが,多職種で手順を確認し,安全に施行できるようチームで協力体制をとることが大切になる.その上で症例を積み重ねることでより短時間で安全な撮像が可能になると思われる.