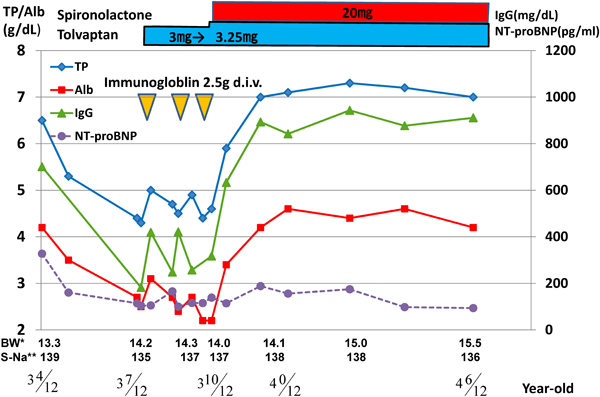
Fontan術後に発症した低蛋白血症にspironolactoneの追加投与が奏功した一例Effectiveness of the Additional Administration of Spironolactone on Hypoproteinemia after the Fontan Procedure
1 佐賀大学医学部小児科Department of Pediatrics, Faculty of Medicine, Saga University ◇ Saga, Japan
2 福岡市立こども病院循環器科Department of Cardiology, Fukuoka Children’s Hospital ◇ Fukuoka, Japan