胎児心臓病学は1980年頃にイギリスのLindsey Allanらによって開始された分野である.以降,様々な出生前診断法の開発と需要も伴って世界的に胎児心臓超音波検査(以下,胎児心エコー)による胎児心臓診断が広まった.本邦においても1994年に日本胎児心臓病研究会(現・学会)が創設され,2000年前後より胎児心エコーは全国的に急速に普及した.そして2006年には先進医療として認定され,2010年には正式な専門医療行為として厚生労働省に認定,保険償還され,更に広がりを見せている現状である.胎児心臓病学が開始された当初はエコー画像も不明瞭であり形態診断自体も困難な状態であったが,その後,画像も飛躍的に改善することにより,現在では形態診断ばかりでなく心機能評価や出生後の状態および予後の予測も可能となってきた.一方で,胎児心臓病学は対象が胎児であるため,出生後の循環とは異なることや在胎週数の進行によって状態が変化するという特殊性があることから,その臨床研究におけるエビデンスレベルの評価が難しい分野でもある.
今回,胎児心臓診断における新しい指標について,まず,心機能評価に対するもの,心形態診断に対するもの,生後の状態・予後判定に有用なもの,の3つに分類した.その上で,近年になって論文発表され,かつ引用文献とされている指標を,比較的エビデンスレベルの高いものとして今回ピックアップして解説する.
胎児心機能を評価する方法として,2014年に発行されたAmerican Heart Association(AHA)のScientific Statement1)に記載されているものであり,かつすでに循環器内科領域では汎用されているが,胎児心臓診断としては比較的新しいものを提示する.
1)組織ドップラー法(tissue Doppler imaging: TDI)
TDIとは,心室壁の動きが血流に比べて遅いことから,血流由来のドップラー信号を除去して壁運動由来のドップラー信号だけを取り出すことによって,心筋局所の運動を定量的に評価する方法である.成人領域では,心不全における拡張能の評価と局所壁運動の評価に汎用されている指標である.パルス組織ドップラー法とカラー組織ドップラー法の二種類がある.
パルス組織ドップラー法(pulse TDI)は,サンプルボリュームを一カ所設定し,房室弁(成人では主に僧帽弁)の弁輪速度の計測をして心機能評価(拡張能)に用いられることの多い,汎用性の高い方法である2).
一方,カラー組織ドップラー法(color TDI)は,断層心エコー(もしくはMモード心エコー)にカラー組織ドップラーを重ねて表示して,速度成分を色の明るさ(プローベに向かう心筋の動きを赤で,遠ざかる動きを青で)で表示する方法である.心筋上に関心領域(region of interest: ROI)を設定すると,その局所壁運動情報について縦軸を速度,横軸を時間としてプロファイル表示できる2).成人では心室中隔の基部と側壁の基部にROIを設定して駆出期ピークのずれを計測して同期不全の評価に用いられる.
胎児心臓診断において,TDIは心筋の運動や時間間隔の解析に有用とする報告が多く見られる.2005年にHaradaらは,従来困難であった胎児の右室機能を評価するための方法として,TDIを正常60胎児において在胎週数ごとに計測し評価した3).2006年にはNiiらが,胎児完全房室ブロックへの進行を予測する方法として胎児房室(AV)間隔をTDIで在胎週数ごとに計測して報告した4).胎児TDIの有用性について,2008年の国際産婦人科超音波医学会(ISUOG)consensus statementでは,‘optional recommendation’としている5)が,最近もTDIを評価した論文が散見される.2015年にAxt-Fliednerらは,pulse TDIを利用して左心低形成症候群(HLHS)14胎児の右室機能を正常28胎児と比較して評価している6).2016年にはWillruthらが,正常160胎児において,color TDIでROIを左右心室壁の弁輪部に設定してICT(isovolumic contraction time),IRT(isovolumic relaxation time),ET(ejection time)を計測した値を正常値として報告している7).
このように多くの報告があることからも,胎児心機能をTDIで評価することは今後臨床面での使用が期待される.
2)Tei index(myocardial performance index: MPI)
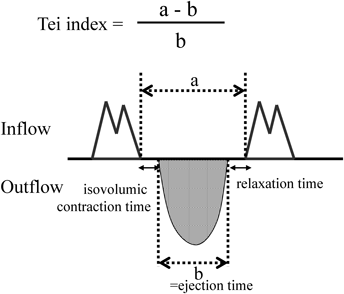
Tei indexは,パルスドップラーで得られた波形から,心室流入の終了から再開始までの時間(a)と心室駆出血流持続時間(駆出時間)(b)より,(a−b)/bとして算出される.(ICT+IRT)/ETと等しい(Fig. 1).収縮能低下でも拡張能低下でもいずれもTei indexの増大として反映され,総合的な心機能を表す指標として利用されている.また,時間分解能に優れたパルスドップラーを利用するため,心拍数の早い小児においても有用とされている8).産科領域において,胎児Tei indexは近年,双胎間輸血症候群(TTTS),子宮内発育遅延(FGR)の評価のために利用されることが多い9, 10).
胎児心臓診断においてもTei indexは,これまで多くの論文で胎児の心機能評価として引用されている.Ebstein奇形,動脈管閉鎖など,心機能が変化するような心臓病では異常値を示す11, 12).Inamuraらは2005年にEbstein奇形を含めた三尖弁異形成疾患群において,LV Tei indexと生命予後とが関係すると報告している11).2013年にGhawiらは,それまでの13年間で報告された胎児Tei indexの正常値をまとめた上で,胎児自験例の計測から正常値は,左室Tei index 0.464+/−0.08,右室Tei index 0.466+/−0.09と報告しており,成人における左室0.38+/−0.05,右室0.28+/−0.04に比し高値となっている13).
3)cardiovascular profile score(CVPS)
CVPSは,産科領域において胎児心不全の予後評価に使用されてきた指標である.具体的には,胎児水腫,静脈ドップラー派形,心拡大,心機能,動脈ドップラー派形という5つのカテゴリーを各々2点として計10点満点として点数を評価し,低値であるほど心不全を疑う指標である14)(Table 1).胎児水腫,先天性心疾患(CHD),発育不全を伴う胎児の予後に関係することが報告されている15–18).心機能低下やそのリスクのある胎児において,計測して経過を見るのに有用であろう.
Table 1 Cardiovascular profile score (CVPS)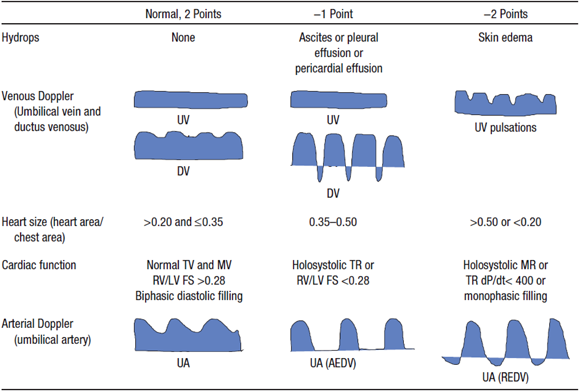 |
| Cardiovascular profile score is 10 if there are no abnormal signs and reflects 2 points for each of 5 categories: hydrops, venous Doppler, heart size, cardiac function, and arterial Doppler. AEDV indicates absent end-siastolic velocity; dP/dt, charge in pressure over time of tricuspid regurgitant jet; DV, ductus venosus; FS, ventricular fractional shortening; LV, left ventricle; MR, mitral valve regurgitation; MV, mitral valve; REDV, reversed end-diastolic velocity; RV, right ventricle; TR, trisucpid valve regurgitation; TV, tricuspid valve; UA, umbilical artery; and UV, umbilical vein. Reproduced with permission from the reference 16). |
2008年にMakikallioらは子宮内発育遅延の胎児75例においてその出産後の生命予後や脳性麻痺合併の検討から,CVPSがそれらの症例では低値であったと報告している17).Wieczorekらは,CHDを持つ胎児131例において後方視的検討を行い,CVPS8未満が周産期死亡のリスクになることを報告している15).2013年にはStatileらが,高心拍出病変(奇形腫やガレン大静脈瘤など)を合併した胎児35例について検討し,死亡した10例のうち80%がCVPS8未満であったと報告している18).
胎児心臓診断において,臨床的に最も必要とされ期待されているのは,心臓の解剖学的な形態異常をより正確に診断することである.この20年間で画像の向上と技術や経験の蓄積によって,特に四腔断面像で描出されるような心内の形態異常については容易に産科スクリーニングで指摘されるようになってきた.一方で,心内の形態異常を認めないCHDである完全大血管転位(TGA)および総肺静脈還流異常(TAPVC)は胎児期に診断できない時代が続いていたため,その胎児診断法の開発が求められていた.そして2013年にIshiiらがTGAの診断法としての‘I-shaped’ signを報告し19),2014年にKawazuらがTAPVCの診断法としての‘Post-LA space index(PLAS index)’を報告した20).また心内に異常を認めない血管の異常として,血管輪を含めた右側大動脈弓の検出に有用な指標としてのU-signも活用されているので提示した21–25).いずれもそれらの有用性を検証した論文も報告されていることから胎児心臓診断における新しい指標として提示する.
1)‘I-shaped’ sign
TGAは生後早期に手術を要し,かつ一部には出生直後に処置を要し救命できないことも起こる重症CHDである26).そのため胎児診断が生命予後の改善に有用とされている疾患であるが,血管の異常であって四腔断面の異常がないため,胎児期には診断が困難な疾患とされていた.
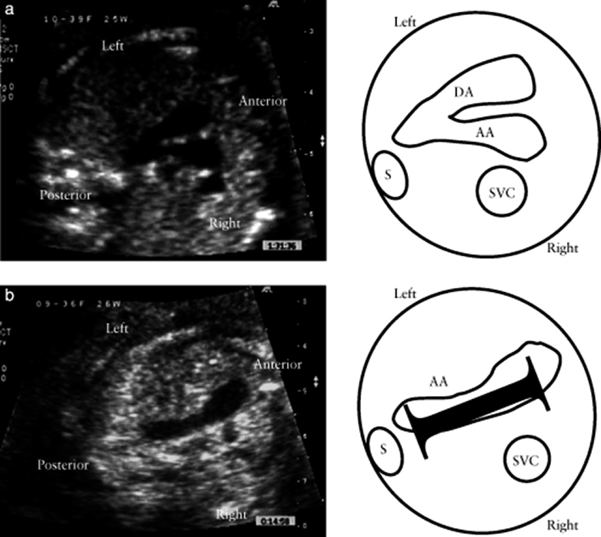
I-shaped signは,TGAにおいてthree vessels and trachea viewを描出した際に,大動脈が前方にある右室から起始して長く後方に向かい動脈管弓と合流するまでが「I」の字のように描出されることを見いだし,TGAの胎児診断に有用であると2013年にIshiiらが報告した指標である19)(Fig. 2).具体的には31例のTGA症例で後方視的に確認したところ,I-shaped signを30例に認めたとしている.その後2015年にはPalatnikらが,I-shaped signの有用性を検討し,TGAの胎児24例のうち23例(95.8%)でI-shaped sign陽性であったことからもこの指標がTGAの胎児診断において簡便かつ迅速に診断するのに有用と述べている27).今後もその有用性が期待される指標である.
2)Post LA space index(PLAS index)
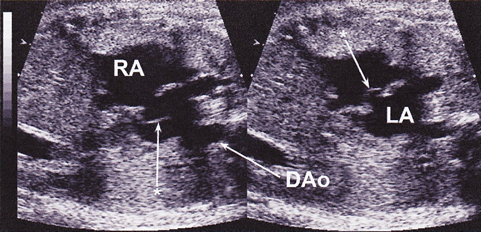
心内の形態異常を合併しない単独の総肺静脈還流異常(isolated TAPVC)は,四腔断面の異常がないため,TGAと同様,従来は胎児診断が困難な疾患とされていた.2003年にValsangiacomoらはTAPVCにおいて左房と下行大動脈に‘wide gap’があると述べ28),2006年にInamuraらはTAPVCの四腔断面ではLA後方に腔を二つ(共通肺静脈腔と下行大動脈)認める‘double balloon sign’を報告し29),2007年にBergらは‘the area behind heart’がCHD診断に重要であると報告した30).
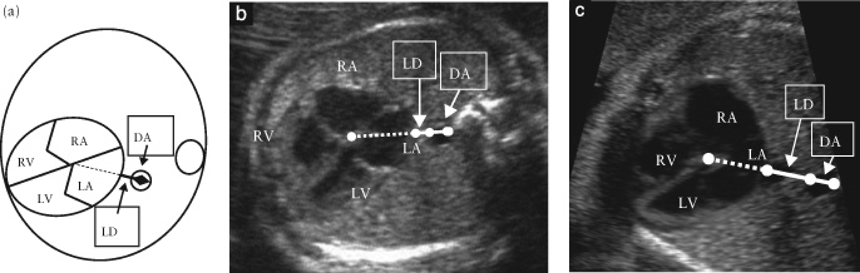
そして2014年にKawazuらは,左房–下行大動脈間距離を下行大動脈径で除した値をPLAS indexとし,isolated TAPVCの胎児診断に有用と報告した20).具体的には,胎児isolated TAPVC8例と正常胎児101例において,PLAS index(=左房–下行大動脈間距離(LD)/下行大動脈径(DA))(Fig. 3)を比較したところ,TAPVC症例は有意に高値であり(p<0.0001),PLAS indexが1.27以上であるとTAPVCが疑わしいと報告した(感度100%,特異度99%).2016年にはAkkurtらが,在胎20~24週の正常胎児165例においてPLAS indexの計測を行い,その値が0.65+/−0.13と低値であったことと在胎週数による変動がなかったことを報告しており31),Isolated TAPVCの胎児診断に期待される指標と考えられる.ただ一方でPLAS index低値であった偽陰性例の報告もある32)ことから,単独で使用するのではなく他の指標も合わせて診断することが必要かもしれない.
3)U-sign
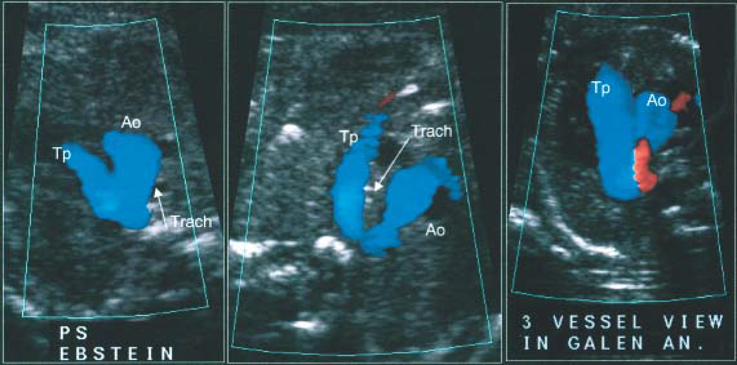
U-signは胎児大動脈弓の異常を検出する指標として2002年にAchironらが提唱したものである21).3vessels trachea viewにおいて,正常であれば大動脈と肺動脈がcolor dopplerにて「V」の字を形成しているが,18,347例中19例には「U」の字型を認めて,うち18例が右側大動脈弓(1例は重複大動脈弓)であったと報告している.2003年にChaouiらは胎児心エコーでcolor dopplerを利用する際に右側大動脈弓でU-signを認めると述べている22)(Fig. 4).その後も右側大動脈弓の検出に有用な指標として多く報告されており,合併するCHDや血管輪の診断に有用とされている23–25).
胎児心臓診断において,検査施行時の心機能を評価して形態異常を診断した上で最終的に必要となるのが,児の出生後の状態および予後の推定である.CHDの中でも最重症とされるHLHSの予後判定について,2004年にTaketazuらは肺静脈の血流パターンが有用であることを報告し33),2010年にはSzwastらが母体酸素負荷テストでのpulsatility index(PI)による肺血管の反応性の評価が有用であると報告した34).また同じく重症CHDであるTGAについて,1999年にMaenoらが胎児心エコーでの卵円孔(FO)と動脈管(DA)の形態がその出生直後の状態評価に有用であることを報告した26).
1)HLHSにおける肺静脈血流パターン
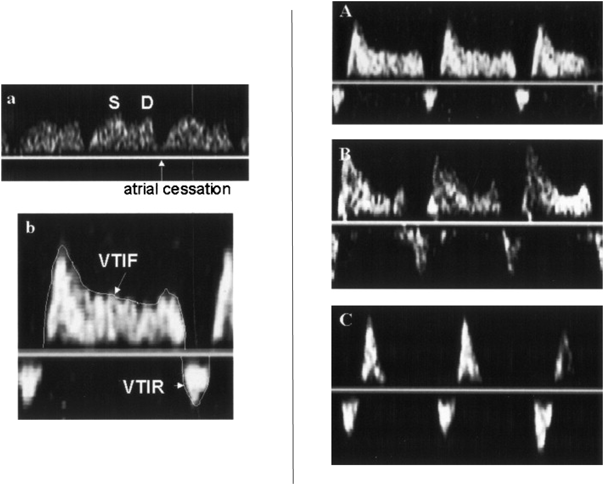
HLHSは出生後,血行動態的にFO開存が不可欠な疾患であるため,胎児心エコーにおいても従来はFOの形態を直接評価していた.一方で,Taketazuらは2004年に,FO自体でなく肺静脈血流パターンの評価の方が生後の状態をよく反映することを報告した33).具体的には胎児HLHS 40例において,肺静脈血流速度信号の面積(=Velocity Time Integral(VTI))を計測し,その逆行性血流と順行性血流の比(VTIR/VTIF)が0.18未満(A),0.18以上(B),拡張早期順行性血流のないto-and-froパターン(C)の3パターンに分類した(Fig. 5).その結果,生後BではAより卵円孔が有意に小さく,Cは全例卵円孔閉鎖しており生直後に緊急処置を要し予後不良であったと述べている.その後,2005年にMichelfelderらが胎児HLHS 41例をまとめた報告では,肺静脈血流パターンはもっと多様であるとしているが,やはり肺静脈血流により生後緊急BAS(Balloon atrio-septostomy)の必要性が予測できたとしている35).2008年にChintalaらも胎児HLHS(FO狭小化のない)27例と正常胎児66例の肺静脈血流パターンを比較して,FO狭小化がなくてもHLHSにおいては肺静脈血流パターンが異なっていることを報告している36).いずれの報告もHLHSにおいては肺静脈血流パターンの確認が重要であると結論している.
2)HLHSにおける母体酸素負荷テストでのpulsatility index(PI)
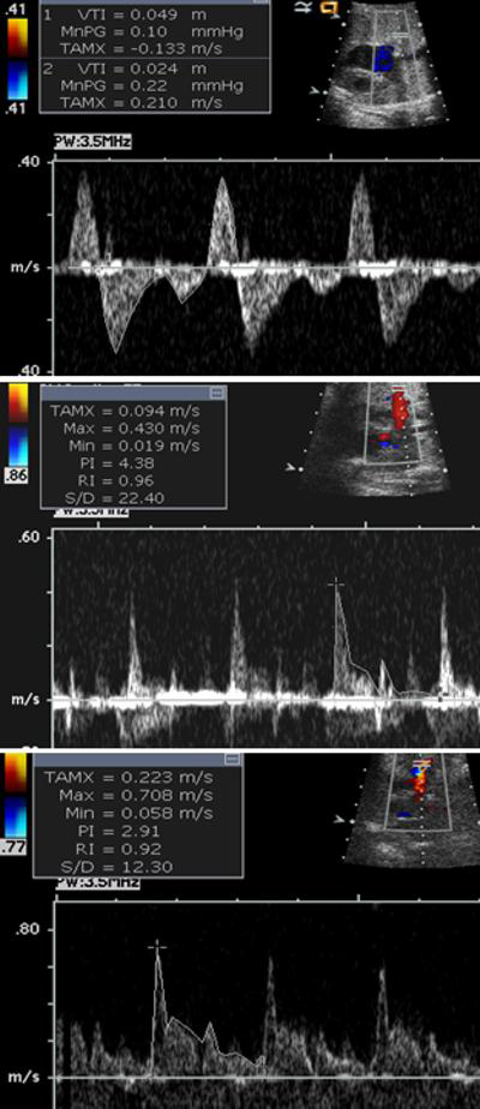
PIは,パルスドップラー法による血流波形において,収縮期と拡張期の血流速度に平均血流速度を加味して算出し血管抵抗を評価する方法である(=収縮期最高血流速度−拡張末期血流速度/平均血流速度).つまり高値で血管抵抗が高いことを示唆する.
母体への酸素投与によるPIの変化については,2002年にBrothらが肺低形成の胎児29例において,母体酸素投与に反応した(PIが20%以上低下した)群15例では生後1例のみ死亡に対し,反応しなかった群では14例中11例が死亡したことより,母体酸素投与によるPIの変化が肺低形成の予測因子となりうることを報告した37).心疾患児に対しては,2010年にSzwartらは43例のHLHS胎児の母体に対し60%酸素10分間吸入の前後で肺動脈のPIの低下10%をカットオフ値として,生後緊急BASを要したrestrictive群と心房中隔が開存していた群に分類できた(感度100%,特異度94%)と報告した34)(Fig. 6).2016年にはEnzensbergerらが22例のHLHS胎児の母体に対し100%酸素10分間吸入前後での肺静脈PIを計測することによって,酸素負荷により胎児FO閉鎖もしくは狭小化の6例中2例でPI低下,つまり血管抵抗の低下により肺還流が増加し,酸素負荷が胎児HLHSの肺血管障害の評価の一助になりうることを示唆した38).
3)TGAにおける卵円孔と動脈管
TGA,中でも生後緊急BASを要するようなTGAにおいては,その出生後の状態を評価して予測しておくことが重要である.1999年にMaenoらは,胎児TGA16例を検討し,胎児期のFO狭小とDA狭小が生後早期の予後に関連することを報告した26).具体的には16例中6例に胎児期FOの異常(fixed, flat, redundant)があって生後5例でFO狭小を認めた.また5例に胎児期DA狭小があり,生後は6例に狭小を認めた.DAが最も細かった4例中2例にFO異常もあり,その2例は出生直後に死亡,その他の1例は肺高血圧が継続した.2004年にJouannicらは,胎児TGA119例においてFOまたはDA狭小の評価を行い,24例でいずれかの異常を認めた(FO23, DA5,両方)4)が,13例で生後低酸素血症と代謝性アシドーシスをあり緊急BAS施行,FO狭小とDA狭小両方の2例は出生直後に死亡したと報告している39).しかし一方で胎児エコーによる予測は特異度84%,感度54%,FO狭小とDA狭小を合わせると特異度100%,感度31%と特異度は高いが感度は低いため他の指標も必要と結論している.2011年にPunnらは,TGAの新生児期緊急BASを胎児期に予測するものとして,新たに「hypermobile septum」(Fig. 7)と「reverse diastolic DA shunt」の二つが有用であると報告した40).具体的には,胎児TGA26例において卵円孔のhypermobility(一次孔を両心房間で揺れる),restriction, flat, redundancyを検証し,またDA径とシャントパターンも検証した.26例中14例で緊急BASを施行し,うち9例がhypermobileであり,8例で拡張期DA逆行を認めていた.Hypermobileと拡張期DA逆行は緊急BASと有意に相関があったとしている.いずれの報告も,胎児TGAにおいてはFOとDAの観察がその出生後の予後推定に重要であると結論付けている.
引用文献References
1) Donofrio MT, Moon-Grady AJ, Hornberger LK, et al: Diagnosis and treatment of fetal cardiac disease: A scientific statement from the American Heart Association. Circulation 2014; 129: 2183–2242
2) Comas M, Crispi F: Assessment of fetal cardiac function using tissue Doppler techniques. Fetal Diagn Ther 2012; 32: 30–38
3) Harada K, Ogawa M, Tanaka T: Right ventricular pre-ejection myocardial velocity and myocardial acceleration in normal fetuses assessed by Doppler tissue imaging. J Am Soc Echocardiogr 2005; 18: 370–374
4) Nii M, Hamilton RM, Fenwick L, et al: Assessment of fetal atrioventricular time intervals by tissue Doppler and pulse Doppler echocardiography: Normal values and correlation with fetal electrocardiography. Heart 2006; 92: 1831–1837
5) Lee W, Allan L, Carvalho JS, et al: ISUOG consensus statement: What constitutes a fetal echocardiogram? Ultrasound Obstet Gynecol 2008; 32: 239–242
6) Axt-Fliedner R, Graupner O, Kawecki A, et al: Evaluation of right ventricular function in fetuses with hypoplastic left heart syndrome using tissue Doppler techniques. Ultrasound Obstet Gynecol 2015; 45: 670–677
7) Willruth A, Steinhard J, Enzensberger C, et al: Fetal colour tissue Doppler imaging (cTDI): Biventricular reference ranges for the time segments of the cardiac cycle in second and third trimesters of gestation. Arch Gynecol Obstet 2016; Epub ahead of print
8) Ishii M, Tsutsumi T, Himeno W, et al: Sequential evaluation of left ventricular myocardial performance in children after anthracycline therapy. Am J Cardiol 2000; 86: 1279–1281, A9
9) Raboisson MJ, Fouron JC, Lamoureux J, et al: Early intertwin differences in myocardial performance during the twin-to-twin transfusion syndrome. Circulation 2004; 110: 3043–3048
10) Hernandez-Andrade E, Crispi F, Benavides-Serralde JA, et al: Contribution of the myocardial performance index and aortic isthmus blood flow index to predicting mortality in preterm growth-restricted fetuses. Ultrasound Obstet Gynecol 2009; 34: 430–436
11) Inamura N, Taketazu M, Smallhorn JF, et al: Left ventricular myocardial performance in the fetus with severe tricuspid valve disease and tricuspid insufficiency. Am J Perinatol 2005; 22: 91–97
12) Mori Y, Rice MJ, McDonald RW, et al: Evaluation of systolic and diastolic ventricular performance of the right ventricle in fetuses with ductal constriction using the Doppler Tei index. Am J Cardiol 2001; 88: 1173–1178
13) Ghawi H, Gendi S, Mallula K, et al: Fetal left and right ventricle myocardial performance index: Defining normal values for the second and third trimesters–single tertiary center experience. Pediatr Cardiol 2013; 34: 1808–1815
14) Huhta JC, Paul JJ: Doppler in fetal heart failure. Clin Obstet Gynecol 2010; 53: 915–929
15) Wieczorek A, Hernandez-Robles J, Ewing L, et al: Prediction of outcome of fetal congenital heart disease using a cardiovascular profile score. Ultrasound Obstet Gynecol 2008; 31: 284–288
16) Hofstaetter C, Hansmann M, Eik-Nes SH, et al: A cardiovascular profile score in the surveillance of fetal hydrops. J Matern Fetal Neonatal Med 2006; 19: 407–413
17) Makikallio K, Rasanen J, Makikallio T, et al: Human fetal cardiovascular profile score and neonatal outcome in intrauterine growth restriction. Ultrasound Obstet Gynecol 2008; 31: 48–54
18) Statile CJ, Cnota JF, Gomien S, et al: Estimated cardiac output and cardiovascular profile score in fetuses with high cardiac output lesions. Ultrasound Obstet Gynecol 2013; 41: 54–58
19) Ishii Y, Inamura N, Kawazu Y, et al: ‘I-shaped’ sign in the upper mediastinum: A novel potential marker for antenatal diagnosis of d-transposition of the great arteries. Ultrasound Obstet Gynecol 2013; 41: 667–671
20) Kawazu Y, Inamura N, Shiono N, et al: ‘Post-LA space index’ as a potential novel marker for the prenatal diagnosis of isolated total anomalous pulmonary venous connection. Ultrasound Obstet Gynecol 2014; 44: 682–687
21) Achiron R, Rotstein Z, Heggesh J, et al: Anomalies of the fetal aortic arch: A novel sonographic approach to in-utero diagnosis. Ultrasound Obstet Gynecol 2002; 20: 553–557
22) Chaoui R, McEwing R: Three cross-sectional planes for fetal color Doppler echocardiography. Ultrasound Obstet Gynecol 2003; 21: 81–93
23) Berg C, Bender F, Soukup M, et al: Right aortic arch detected in fetal life. Ultrasound Obstet Gynecol 2006; 28: 882–889
24) D’Antonio F, Khalil A, Zidere V, et al: Fetuses with right aortic arch: A multicenter cohort study and meta-analysis. Ultrasound Obstet Gynecol 2016; 47: 423–432
25) Hsu KC, Tsung-Che Hsieh C, Chen M, et al: Right aortic arch with aberrant left subclavian artery–prenatal diagnosis and evaluation of postnatal outcomes: Report of three cases. Taiwan J Obstet Gynecol 2011; 50: 353–358
26) Maeno YV, Kamenir SA, Sinclair B, et al: Prenatal features of ductus arteriosus constriction and restrictive foramen ovale in d-transposition of the great arteries. Circulation 1999; 99: 1209–1214
27) Palatnik A, Gotteiner NL, Grobman WA, et al: Is the “I-Sign” in the 3-vessel and trachea view a valid tool for prenatal diagnosis of D-transposition of the great arteries? J Ultrasound Med 2015; 34: 1329–1335
28) Valsangiacomo ER, Hornberger LK, Barrea C, et al: Partial and total anomalous pulmonary venous connection in the fetus: Two-dimensional and Doppler echocardiographic findings. Ultrasound Obstet Gynecol 2003; 22: 257–263
29) Inamura N, Kado Y, Kita T, et al: Fetal echocardiographic imaging of total anomalous pulmonary venous connection. Pediatr Cardiol 2006; 27: 391–392
30) Berg C, Georgiadis M, Geipel A, et al: The area behind the heart in the four-chamber view and the quest for congenital heart defects. Ultrasound Obstet Gynecol 2007; 30: 721–727
31) Akkurt MO, Yavuz A, Akkurt I, et al: Reliability of posterior-left atrium space index measurements during 20–24 weeks of gestation in structurally normal fetuses. J Perinat Med 2015. 2016; 44: 613–617
32) Ishido H, Masutani S, Hishitani T, et al: Re: ‘Post-LA space index’ as a potential novel marker for the prenatal diagnosis of isolated total anomalous pulmonary venous connection. Ultrasound Obstet Gynecol 2015; 46: 747–748
33) Taketazu M, Barrea C, Smallhorn JF, et al: Intrauterine pulmonary venous flow and restrictive foramen ovale in fetal hypoplastic left heart syndrome. J Am Coll Cardiol 2004; 43: 1902–1907
34) Szwast A, Tian Z, McCann M, et al: Vasoreactive response to maternal hyperoxygenation in the fetus with hypoplastic left heart syndrome. Circ Cardiovasc Imaging 2010; 3: 172–178
35) Michelfelder E, Gomez C, Border W, et al: Predictive value of fetal pulmonary venous flow patterns in identifying the need for atrial septoplasty in the newborn with hypoplastic left ventricle. Circulation 2005; 112: 2974–2979
36) Chintala K, Tian Z, Du W, et al: Fetal pulmonary venous Doppler patterns in hypoplastic left heart syndrome: Relationship to atrial septal restriction. Heart 2008; 94: 1446–1449
37) Broth RE, Wood DC, Rasanen J, et al: Prenatal prediction of lethal pulmonary hypoplasia: The hyperoxygenation test for pulmonary artery reactivity. Am J Obstet Gynecol 2002; 187: 940–945
38) Enzensberger C, Axt-Fliedner R, Degenhardt J, et al: Pulmonary Vasoreactivity to Materno-Fetal Hyperoxygenation Testing in Fetuses with Hypoplastic Left Heart. Ultraschall Med 2016; 37: 195–200
39) Jouannic JM, Gavard L, Fermont L, et al: Sensitivity and specificity of prenatal features of physiological shunts to predict neonatal clinical status in transposition of the great arteries. Circulation 2004; 110: 1743–1746
40) Punn R, Silverman NH: Fetal predictors of urgent balloon atrial septostomy in neonates with complete transposition. J Am Soc Echocardiogr 2011; 24: 425–430