症例1
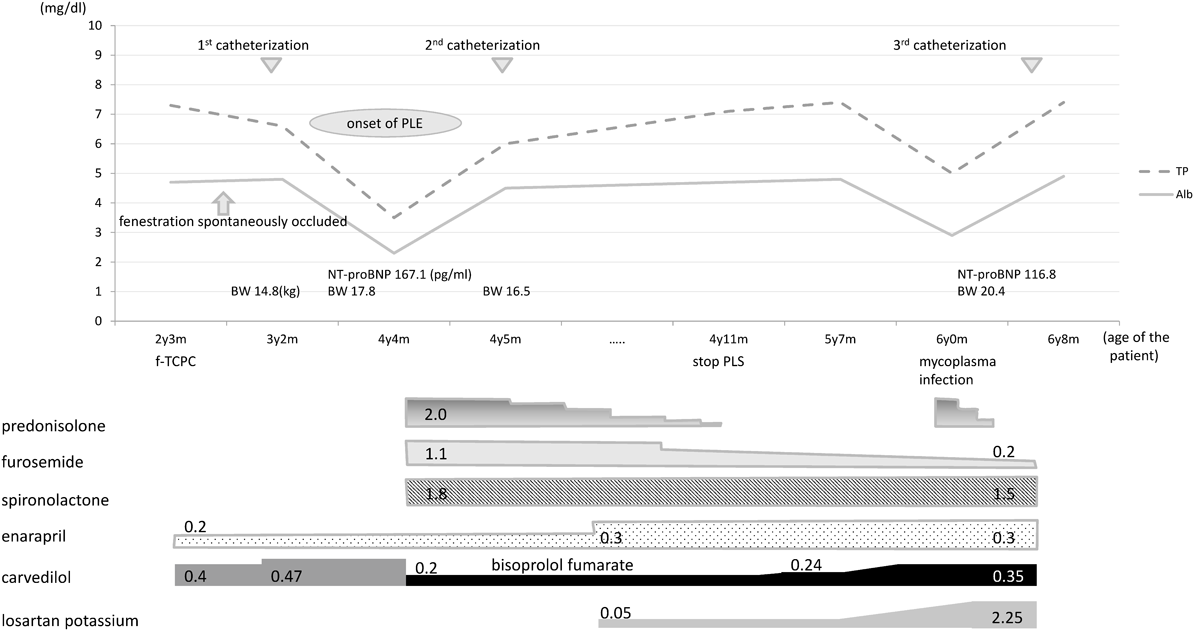
症例は4歳4ヶ月,男児.診断は右側相同,完全型房室中隔欠損,左室低形成,両大血管右室起始,単心房,肺動脈狭窄,下心臓型総肺静脈還流異常,右胸心.日齢21に総肺静脈還流異常修復術,1ヶ月時に左Blalock–Taussig手術を施行した.8ヶ月時に両方向性Glenn手術を施行したが,この時左横隔神経麻痺を合併した.2歳時に施行した心臓カテーテル検査(心カテ)で平均肺動脈圧(mPAP)は18 mmHg,平均単心房圧7 mmHg,肺血管抵抗(PVR)は4.1 Wood Units(WU)·m2と高値であったが,横隔神経麻痺が改善傾向であったため横隔膜縫縮術を行わずに2歳2ヶ月時にfenestrated total cavopulmonary connection手術(f-TCPC)を施行.退院後の経過観察中に経皮的酸素飽和度が上昇し,術後11ヶ月で施行した心カテで開窓部の自然閉鎖を確認した.この時のCVPは13~15 mmHgと比較的高かったが,房室弁逆流(CAVVR)は軽度で心拍出量は保たれており開窓部の自然閉鎖に対する処置は行わずに経過観察とした(Table 1).f-TCPCから2年1ヶ月,術後心カテから1年2ヶ月後に全身浮腫と腹部膨満を主訴に来院した(Fig. 1).入院時の血清総タンパク質3.5 g/dL,血清アルブミン値は2.3 g/dLと低値で,99 mTc標識ヒト血清アルブミンを用いたシンチグラムで核種の腸管内漏出が認められPLEと診断.同日からPSL(2 mg/kg/day)とアルブミン製剤の投与を開始した.入院時の心臓超音波検査ではCAVVRが1年前の軽度から中等度へと増加していたためenalapril,carvedilolを増量し,入院中に喘息様気管支炎に罹患したため,carvedilolをbisoprololに変更した.
Table 1 Hemodynamic data at cardiac catheterization for cases 1 and 2 | Case 1 | Case 2 |
|---|
| 11 months after f-TCPC | PLE resolved by PSL | 1 year and 9 months after stopping PSL | Before fenest. closure | PLE resolved by PSL | Before stopping PSL |
|---|
| CVP (mmHg) | 15 | 13 | 13 | 11 | 14 | 7 |
| mPAP (mmHg) | 13 | 13 | 12 | 10 | 13 | 7 |
| PAWP (mmHg) | 9 | 8 | 10 | 7 | 8 | 3 |
| RVP (mmHg) | 67/edp5 | 77/edp8 | 71/edp9 | 70/edp6 | 87/edp9 | 64/edp3 |
| EF (%) | 58 | 56 | 68 | 51 | 42 | 53 |
| CI (L/min/m2) | 3.6 | 2.7 | 4.0 | 4.2 | 2.8 | 3.3 |
| SVR (unit·m2) | 10.8 | 18.5 | 9.0 | 11.6 | 20.7 | 10.6 |
| PVR (unit·m2) | 1.6 | 1.6 | 0.5 | 0.8 | 1.8 | 1.5 |
| CAVVR | Mild | Moderate | Moderate | Mild | Moderate | Mild |
| RVEDP/CI (mmHg/(L/min/m2)) | 1.4 | 3.0 | 2.3 | 1.4 | 3.2 | 0.9 |
| CVP: central venous pressure, mPAP: mean pulmonary artery pressure, PAWP: pulmonary artery wedge pressure, RVP: right ventricular pressure, EF: right ventricular ejection fraction, CI: cardiac index, SVR: systemic vascular resistance, PVR: pulmonary vascular resistance, CAVVR: the severity of common atrioventricular valve regurgitation, RVEDP: right ventricular end-diastolic pressure, edp: end-diastolic pressure. |
PSLに対する反応は良好で,補充なしで血清アルブミン値を維持できるようになった後に心カテを施行した(Table 1).術後11ヶ月時と比べてmPAP, PVRに変化はなかった.CAVVRは軽度から中等度へ増加しRVEDPは5から8 mmHg,SVRは10.8から18.5 WU·m2と上昇し,CIは3.6から2.7 L/min/m2へと減少していた.パルスドプラ法で測定した右室流入路の拡張早期波/心房収縮期波(E/A)は0.45/0.60 m/sで軽度拡張障害パターンを示していた.このため右室機能,特に拡張能低下のPLE発症への関与を考え,新たにlosartan potassiumとSPLを開始しACEi, ARB, SPLおよびBBの増量とPSL減量を並行して行った.
診断から7ヶ月後にPSLを中止し得たが,その12ヶ月後にマイコプラズマ肺炎罹患を契機にPLEが再燃した.PSLを1 mg/kg/dayで再開したところ直ちに低タンパク血症は消失しPSLは3ヶ月かけて漸減中止した.この際のパルスドプラ法で右室流入路のE/Aは0.55/0.4 m/sで,PLE発症時と波高は逆転していた.再燃時のPSL中止から1年9ヶ月経過した時点で心カテを施行した.PLE発症直後と比較してCVPに変化はないが,肺動脈楔入圧(PAWP)は8から10 mmHg,RVEDPも8から9 mmHgに上昇,RVEFは56が68%,CIは2.7から4.0 L/min/m2へと著明に増加していた.SVRは18.5から9.0 WU·m2に低下していた(Table 1).RVEDP/CIはPLE発症に伴い1.4から3.0へと上昇し,PSL中止後には2.3 mmHg/L/min/m2に低下していた.
症例2
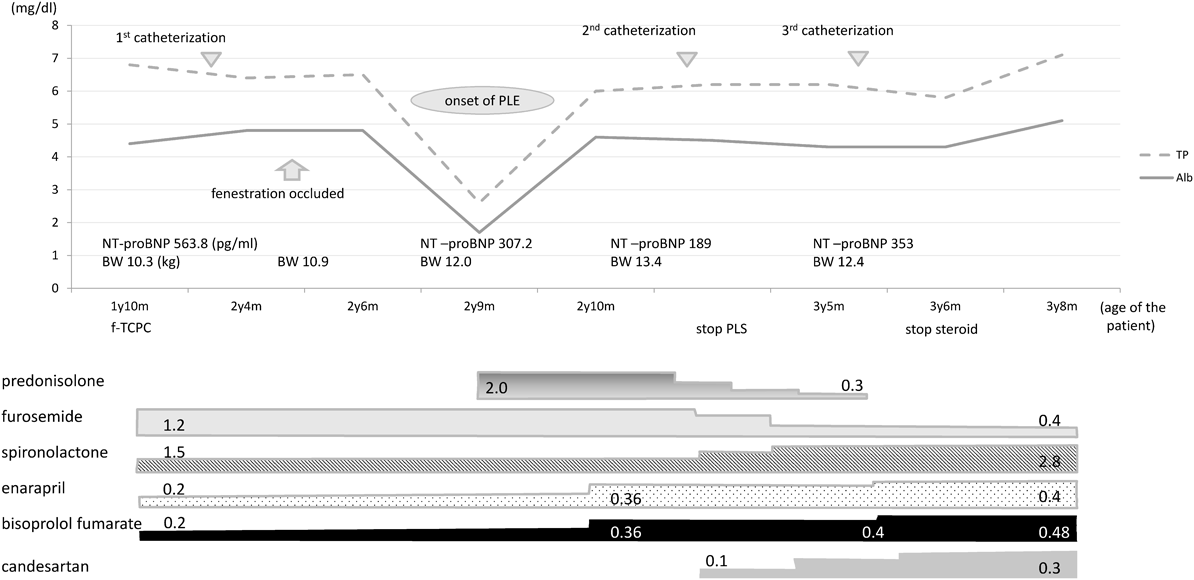
2歳9ヶ月,男児.診断は右側相同,右室性単心室,両大血管右室起始,単心房,共通房室弁,肺動脈狭窄,下心臓型総肺静脈還流異常.日齢14に総肺静脈還流異常修復術ならびに肺動脈絞扼術,7ヶ月時には両方向性Glenn手術兼共通房室弁形成術を施行した.術後心房頻拍が出現しflecainide,bisoprololを開始した.1歳5ヶ月時の心カテでmPAPが16ないし17 mmHg,平均単心房圧9 mmHg,RVEDP 12 mmHgと低リスクとは言えないがf-TCPCを予定した.なお,主肺動脈経由の付加肺血流があるため左右肺動脈の酸素飽和度が異なり,PVR測定はできなかった.f-TCPCに先立ち房室弁輪縫縮部起源の心房頻拍に対し高周波電気焼灼術を,体肺側副動脈にコイル塞栓術を施行した.1歳9ヶ月時にf-TCPCを施行,術後6ヶ月で行った心カテでCVP 11 mmHg, CI 4.2 L/min/m2, PVR 0.8 WU·m2,RVEFは51%であった(Table 1).開窓部の試験的な閉鎖によって,CVPは15 mmHgに留まり98%まで動脈血酸素飽和度が上昇した.このため術後8ヶ月時に左肺動脈中下葉枝の狭窄に対する経皮的バルーン拡大術とFlipper coilにて開窓部閉鎖術を行う方針とした.経皮的バルーン肺動脈拡大術により狭窄部は直径3.6 mmから4.9 mmに拡大し,開窓部閉鎖術では施術後も少量の短絡が残存,SaO2は84%から91%への上昇に留まった.開窓部閉鎖2ヶ月後,浮腫と著明な低タンパク,低アルブミン血症を認めたため入院とした(Fig. 2).
99mTc標識ヒト血清アルブミンを用いたシンチグラムで腸管への蛋白漏出を確認しPLEと診断,PSL 2 mg/kg/dayとアルブミン投与を開始した.
補充なしで正常の血清アルブミン値が維持できる状態になったため,心カテを施行した(Table 1).開窓部閉鎖前のデータと比べCVPは11から14 mmHg,SVRは11.6から20.7 WU·m2,RVEDPは6から9 mmHgへと上昇していた.RVEFは51から42%へ,CIは4.2から2.8 L/min/m2へと低下しCAVVRは軽症から中等症へと悪化していた.バルーン拡大術を施行した左肺動脈に再狭窄はなく,残存する体肺側副動脈に対しては可能な限りコイル塞栓術を施行した.パルスドプラ法による右室流入路のE/Aは0.57/0.58 m/sとE波高とA波高はほぼ同等であった.以上からSVR, CAVVRの増加,右室収縮能低下に加えて拡張能の低下も疑い,f-TCPC術後から内服していたenalapril, bisoprolol, SPLを増量,新たにcandesartanを開始しPSL漸減の方針とした.PLEの診断から8ヶ月後の心カテでCVP 7 mmHg, PAWP 3 mmHg, RVEDP 3 mmHg, SVRは10.6 WU·m2といずれも低下し,RVEFは53%と改善,CIは治療開始前の2.8から3.3 L/min/m2に増加していたためPSLは中止とした(Table 1).この時点で施行した心臓超音波検査ではCAVVRは軽症化しており,右室流入路のE/Aは1.04/0.8 m/sと変化していた.RVEDP/CIはPLE発症前の1.4が発症後に3.2へと上昇し,PSL中止時には0.9 mmHg/L/min/m2へ低下していた.
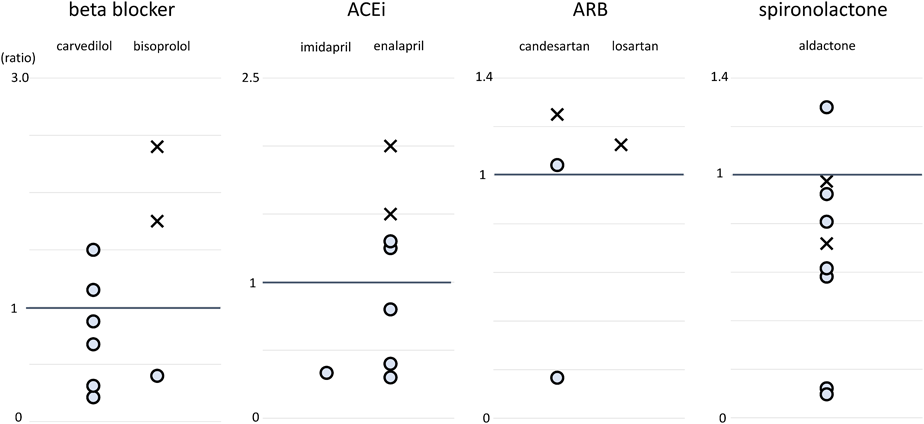
症例1, 2と当院におけるPLE非寛解例の投薬量
当院でFontan型手術後のPLEとして治療されている症例は合計10例あったが今回の2例以外に寛解症例はなかった.日本薬局方で定められている各薬剤の一日当たりの成人最大投薬量を体重50 kgで除した値を1とすると,寛解例1と2におけるsteroid療法中止時の体重1 kgあたりの投薬量はBB, ACEi, ARBの3剤において非寛解例より多かった(Fig. 3).また,非寛解例でBB, ACEi, ARB, SPLの4剤もしくはBB, ACEi, ARBの3剤を併用した症例はなかった.
Fontan手術後にタンパクが腸管内に漏出する原因や機序は未だ詳らかではないが,高い静脈圧,低い心拍出量,腸管膜血管抵抗の上昇,全身性の炎症反応や腸管におけるheparan sulfateの欠乏などの関与が言われている3–5).
PLEにおける血漿タンパク濃度の低下は血管内の膠質浸透圧低下をもたらし,高いCVPと相まって血管から間質への水分漏出を生じる6).血管内の水分喪失は循環血液量の減少から,心拍出量の減少のみならずCVPの低下をもたらす可能性がある.このためPLEの発症要因を検討するためには,腸管へのタンパク漏出および血管外への水分漏出がない状態で血行動態評価を行う必要があると考え,迅速なPLE寛解を得るために我々はsteroid療法を選択した.
副腎皮質ホルモンの全身投与は1991年のRothmanの報告から始まり現在でも広くFontan手術後のPLE治療に用いられている7).Steroid療法の問題点の第一は,長期使用による易感染性,骨粗鬆症,高血圧,中心性肥満などの副作用である.欧米では副作用低減を目的として消化管から吸収されても,初回通過効果により約90%が肝臓で不活化されるbudesonideを用いたsteroid療法が主体になってきている8, 9).しかし,Fontan手術後のPLEではbudesonideを選択しても副作用の頻度が低いとは言い難い9).また,長期投与によりPLEに対するsteroidの治療効果が減ずることも多く,steroidからの離脱は困難であると言われている8, 9).以上の事実から我々の血管拡張薬併用療法の治療目標は,主として血行動態の改善により,副作用の強いsteroidなしにタンパク漏出がないか,正常な血清タンパク質濃度を保てる状態を維持することとした.
心カテにおける変化が2症例で同様であったパラメーターはCI, SVR, RVEF, RVEDP/CIであった.尚,RVEDP/CIは一定時間に右室に流入する血流量によってRVEDPがどの程度変化したかを示し右室拡張能を反映するものと考えられ,低値であれば拡張能良好である.CIとRVEFはPLE発症直後に低下しPSLからの離脱前後に再び上昇,SVRとRVEDP/CIはPLE発症後に上昇しPSL中止前後には低下していた.開窓部の閉塞自体がPLE原因そのものだと考えても,低心拍出量やCVP上昇がPLE発症要因の一つであるという報告とは矛盾しない4, 10).しかし同時にSVR上昇とRVEF低下,RVEDP/CI上昇など体循環心室の収縮,拡張機能低下が認められており,開窓部閉鎖による心拍出量低下に反応した後負荷増大が右室機能低下とさらなる心拍出量低下を招くという悪循環もPLE発症に関与するのかもしれない.逆にいえば血管拡張療法の強化に伴いSVRが低下し右室機能が改善,心拍出量が増加したことがPLE改善の一因であった可能性が考えられた.
Senzakiら,SzaboらによればFontan循環は体血管床と肺血管床の間に介在すべき肺循環心室を欠いているため,体循環心室はSVRとPVRに抗して血液を駆出することになり,これが体循環心室の後負荷不整合を生じ,循環効率の悪化や心室機能低下をもたらす.Fontan循環においては体循環心室のstiffnessが高く,これが心予備能低下の要因であるとも述べている11–13).さらにOzawaらはPLEの発症と共に体血管抵抗は上昇し,循環動態を改善させる治療によりPLEが改善すると体血管抵抗も低下するため,後負荷不整合がPLEの発症に重要な役割を果たすと報告しており,今回の経験と矛盾しない14).またFontan手術後症例においては血中catecholamineやRAA系のホルモンレベルが高いとの報告があり15),今回使用した血管拡張薬がこれら神経内分泌因子と拮抗することのみならず,交感神経興奮で放出が促進されるvasopressinやrenin,angiotensin IIによる腸間膜血管抵抗上昇を抑制したこともsteroidを中止できた理由かもしれない.
RingelらはPLE 3例に対し高用量SPLの使用経験を報告しているが,最終的には3例ともACEiとSPLの併用療法に移行しており16),彼らの治療法もRAA系抑制という面では我々の治療法と共通する.その他RAA系抑制薬による心室リモデリング抑制作用やBBのCaハンドリング改善作用,心拍数低下作用17)なども右室機能の改善からPLE寛解に寄与した可能性もあるが,今後の検討が必要である.
PLE発症時にはACEi,BB,SPL等が既に投与されていたにも関わらずSVRは上昇し右室機能は低下していた.PSL中止時に今回の2症例に投与されていたSPL以外の血管拡張薬の投与量は当院のすべてのPLE非寛解例より大量で,4系統の薬剤の同時投与はこの2例のみであった.Fontan循環における高いSVRを心室機能が改善する程度にまで低下させ,腸管へのタンパク漏出を停止させるのに必要な薬剤の組み合わせや量は不明であるが,比較的大量の血管拡張薬の多剤併用が必要なのかもしれない.