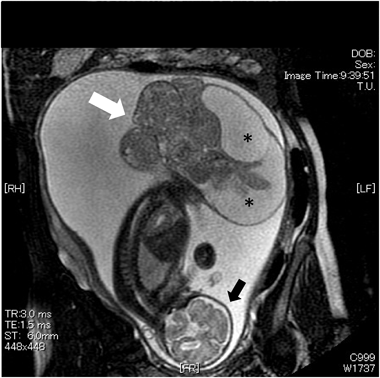
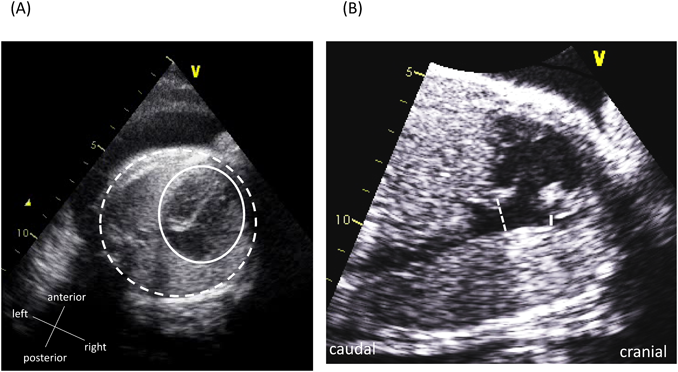
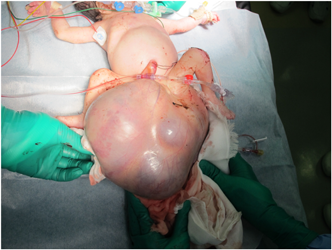
胎児心エコー所見をもとに早期娩出し救命できたハイリスク仙尾部奇形腫の胎児例Successful Preterm Delivery of a Fetus with High-risk Sacrococcygeal Teratoma Based on Fetal Echocardiographic Findings
1 筑波大学医学医療系小児科Department of Child Health, Faculty of Medicine, University of Tsukuba ◇ Ibaraki, Japan
2 筑波大学医学医療系産婦人科Department of Obstetrics and Gynecology, Faculty of Medicine, University of Tsukuba ◇ Ibaraki, Japan
3 筑波大学医学医療系小児外科Department of Pediatric Surgery, Faculty of Medicine, University of Tsukuba ◇ Ibaraki, Japan