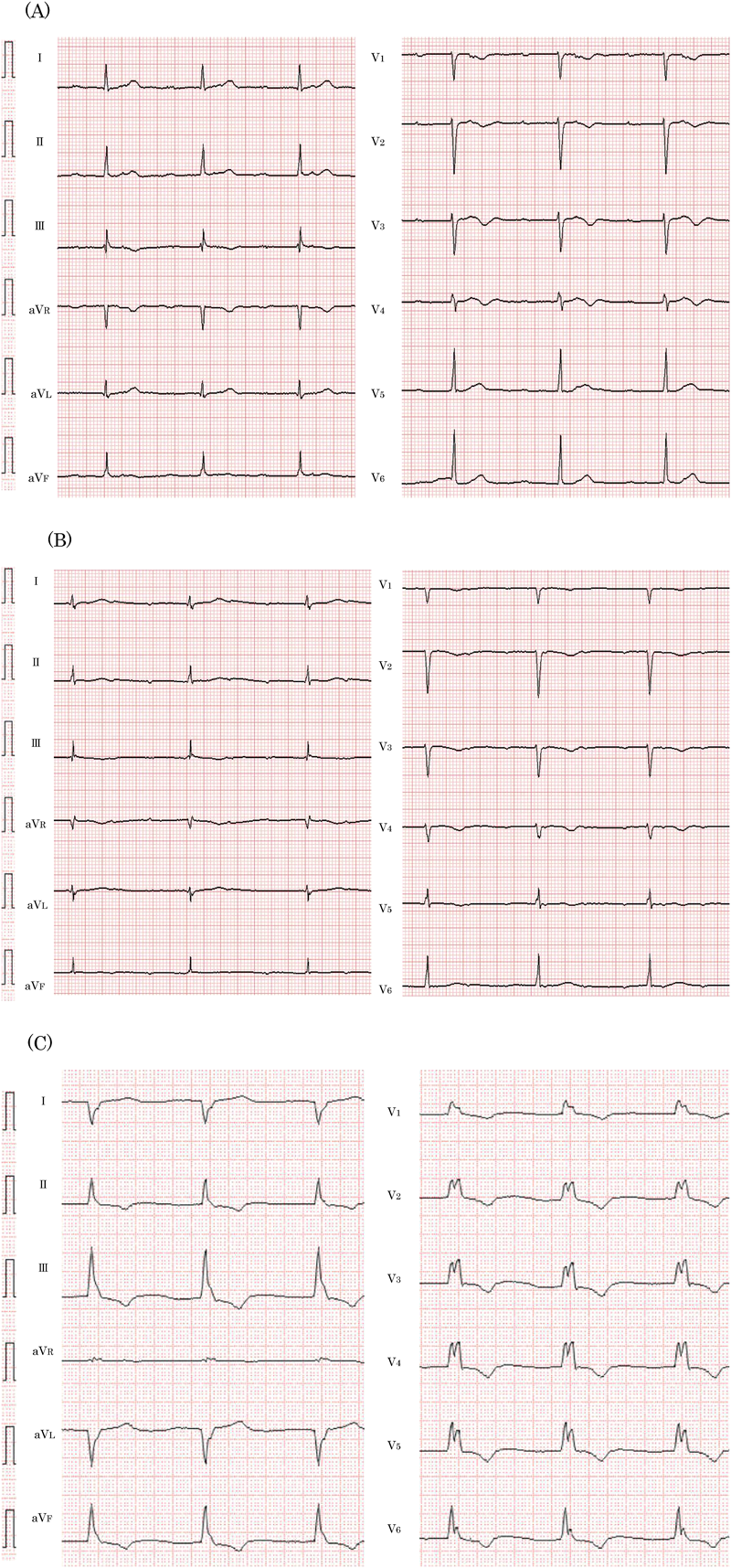
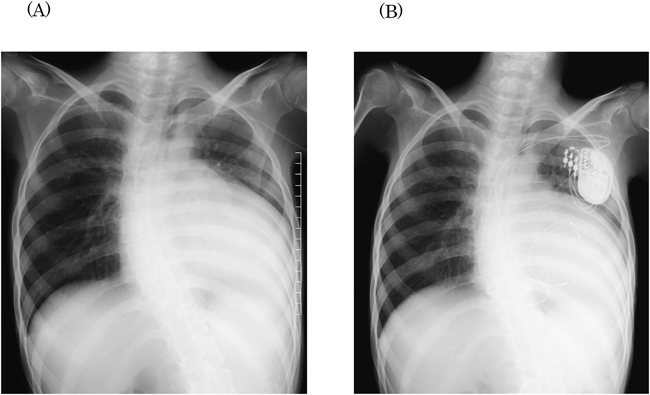
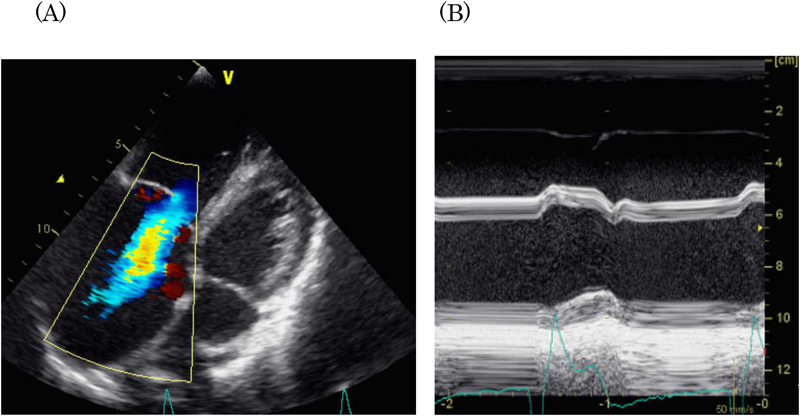
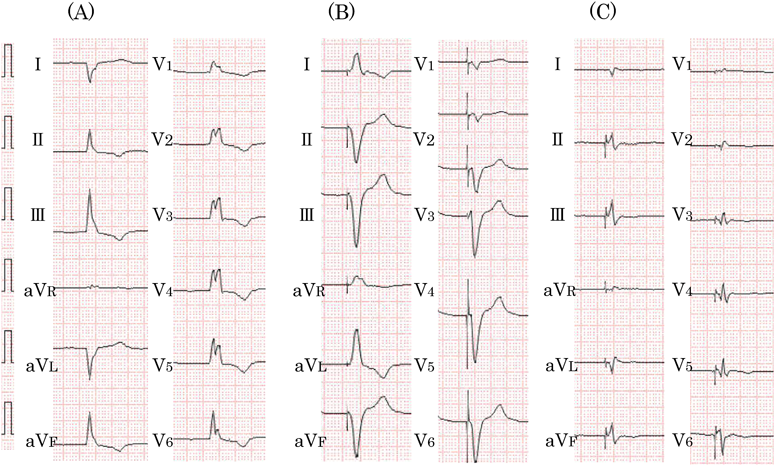
心臓再同期療法を施行したLMNA変異を伴う先天性筋ジストロフィーの1例Successful Cardiac Resynchronization Therapy in a Case of LMNA-associated Congenital Muscular Dystrophy
1 富山県立中央病院小児科Department of Pediatrics, Toyama Prefectural Central Hospital ◇ Toyama, Japan
2 富山県立中央病院内科(循環器)Department of Internal medicine, Toyama Prefectural Central Hospital ◇ Toyama, Japan
3 富山大学医学部小児科Department of Pediatrics, Toyama University ◇ Toyama, Japan