再生医療技術は,既存の薬物療法や外科的な治療法では根治が困難な難治性疾患に対して,新たな治療法を提供するための技術として期待されている.外科領域においては,機能不全に陥ったり,欠損したりした組織や臓器を,ドナー臓器や人工臓器を用いて代替えする移植手術が一般に行われている.これらに代わって,組織工学技術によって移植用組織体の開発が進められている.既に皮膚や軟骨,血管,心臓弁などとして臨床応用されているが,それらの作製には,生体外での一連の細胞操作(細胞の採取,分離,必要に応じて分化,増殖,足場への播種,力学的負荷など適切な条件下での生着化など)が必須であり,細胞プロセッシングセンター(CPC)などの高度清浄施設が不可欠である.
先天性心疾患は約1%の高率で新生児に認められ,病態によっては早期の移植手術などの外科的処置が必要となる.弁膜症に対しては,成人では機械弁もしくは動物由来の生体弁を用いて弁置換が行われるが,小児の場合には適切な小さなサイズの製品がそもそも存在せず,人工物であるため患者の身体の成長に合わせて対応できないなど特有の問題を有する.したがって,治療には小児外科医の創意工夫への依存度が極めて高くなる.可及的に心膜などの自己組織を利用して修復が行われることもあるが,使用可能な量には限界がある.一方,再生医療では,移植体が生着すればその後の成長性が見込まれるため,小児外科での再手術という問題を解決できる可能性が期待される.
生体の皮下に医療材料として多用されているシリコーンやアクリル,ステンレスなどの非吸収性,非分解性の材料を埋め込むと,皮下に多量に存在する線維芽細胞が周囲に集積して材料を包み込むようにコラーゲンが産生される.この生体反応は一般にカプセル化と呼ばれており,特に外科医にはよく知られている現象である.生体内組織形成術(In Body Tissue Architecture: IBTA)とは,このカプセル化を利用して,自分の移植用の組織体を自分自身の体内成分のみで作ろうとする新発想の革新的な再生医療技術である1, 2).単に鋳型を皮下に一時的に埋入するだけで目的形状の自己組織体を得ることができる.患者の体内を培養器(バイオリアクター)として用いて,患者自身の体の中だけで全ての工程が完結する.細胞培養の煩わしい手間暇コストが一切かからない.体内は無菌状態が維持され,栄養や酸素の供給が確保されているため,理想的な培養環境と言える.その環境が当然ながら患者全てに備わっている.
3次元プリンターを用いると,患者個々に合わせて鋳型の形状を自在に設計することができる.例えば,複雑な形状の心臓弁用の鋳型も,一晩で造形できるパーツから組み立てることができる(Fig. 1).複数個の鋳型を皮下埋植すれば,一度に多量に多種の組織体を同時に作製することができる.鋳型を取り除いて得られる移植用の組織体は,異物を全く含まないため,免疫拒絶や毒性がなく生体適合性に優れており,がん化の心配はない.また感染症において有利であり,さらに体内での成長が期待される.
本稿では,このIBTA技術を基盤として取り組んでいる完全に自己組織のみからなる心血管系組織体として,血管様管状組織体(バイオチューブ),シート状修復材(バイオシート),心臓弁様組織体(バイオバルブ)の開発状況を,成長性に関して得られた最新の知見と共に紹介する.
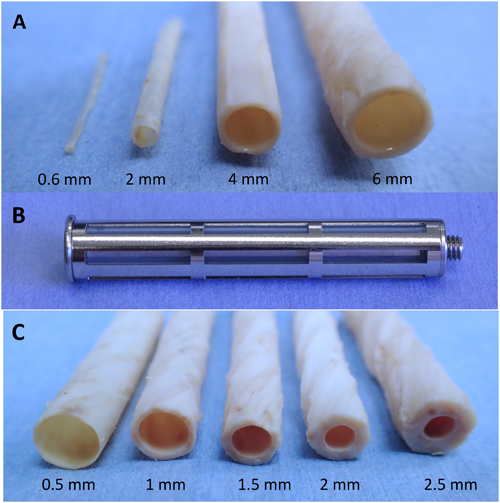
シリコーン製の円柱状の鋳型を皮下埋入すると,バイオチューブと名づけた管状の自己組織体が得られる.バイオチューブの壁はコラーゲンの積層構造からなるが,内腔面は極めてスムーズで平滑である.直径の異なる円柱を用いるだけでバイオチューブの口径が容易に調整できる(Fig. 2A).これまでに,ビーグル犬の総頸動脈(内径4 mm),腹部大動脈(内径4~6 mm),大腿動脈(内径2 mm),ウサギ総頸動脈(内径2~3 mm),ラット腹部大動脈(内径1.5~2 mm)に移植を行ってきた.現在も経過観察中であるが,動脈血管として最長でビーグルでは8年,ウサギでは2年,ラットでは1年半の長期開存を得ており,瘤化や狭窄は認めていない.最近では世界最小径0.6 mmのマイクロバイオチューブの開発にも成功している3).
シリコーン円柱から得られるバイオチューブは壁厚が通常0.3 mm以下と薄いため,一般に移植操作性が悪い.カプセル組織の厚さを如何に増加させるかは長年の懸案であった.従来は鋳型の外周でのみしか組織形成できないとの固定観念があったが,鋳型の隙間の内部にも組織侵入が起こることが分かった.そこで,これまでのシリコーン円柱を心棒として,その外周にわずかに隙間を開けてスリット付きのステンレス製円筒で覆った(Fig. 2B)4).このカバー付きの新しい鋳型を皮下に埋め込むと,外周がコラーゲンのカプセルで覆われるとともに,スリットを通して心棒と円筒の隙間にも組織が侵入し,隙間が組織で完全に満たされた.隙間の幅を変化させれば,バイオチューブの壁の厚さを数mm程度まで調節することが可能であった(Fig. 2C).
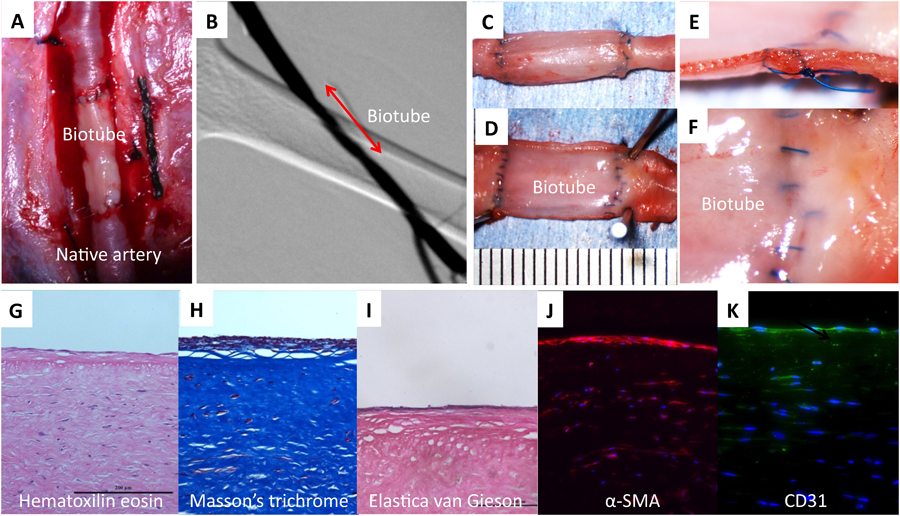
丈夫な壁を有するバイオチューブが作製できるようになったことで,低圧系や血流量の少ない末梢動脈系での開存性が飛躍的に向上した.ビーグル犬の大腿動脈に移植を行うと,33%であった壁の薄い従来バイオチューブでの開存率を壁を厚くすることで100%に飛躍的に高めることができた(Fig. 3)4).大腿動脈のような筋間に位置する末梢血管においては,生体の運動時に起こる伸展や屈曲などによって周囲筋肉の動きから大きな外力が加わる.壁が厚いため,その外力に対する抵抗力を増すことができたと考えられる.移植1か月後において,周囲組織との癒着はなく(Fig. 3C),内腔面は非常に平滑で血栓等の付着は一切なかった(Fig. 3D).内膜の肥厚や吻合部狭窄等も認められなかった(Fig. 3E, F).内腔面はα-SMA陽性細胞からなる新生組織が形成され,その表層は内皮細胞で覆われ,さらにエラスチンも形成されていた(Fig. 3G–K).これまでの高圧高流量系での移植と同様に,末梢系においても血管壁の再構築が起こることを示した.新しい鋳型から得られたバイオチューブは動脈系,静脈系のいずれにおいても数cm程度であればほぼ完全な開存性が得られた.これまでバイオチューブの臨床応用として,透析シャント血管の狭窄部位へのバイパスや先天性心疾患に対する肺動脈形成が行われてきたが,より長いバイオチューブの非臨床での好成績を得ることでより広範な臨床応用が可能になると期待される.
「新しい鋳型」での副次効果として,低侵襲化が可能となっている5).円柱状の「鋳型」を皮下に埋め込む時には,円柱の直径程度の小さな切開創があれば挿入することができる.しかし,カプセル化された「鋳型」を取り出す時には,周囲組織を損傷しないように,「鋳型」の長さ以上の大きな切開創が必要であった.一方,「新しい鋳型」では外周面に形成される組織は使用しない.したがって,長さにかかわらず「鋳型」の挿入口程度の小さな切開創から筒刃を用いて皮下から抜き取ることが可能となった.小児患者の場合には,傷を無駄に大きくしないQOLの配慮が特に必要と考える.
他の心血管系組織体(バイオシートやバイオバルブ)の開発状況
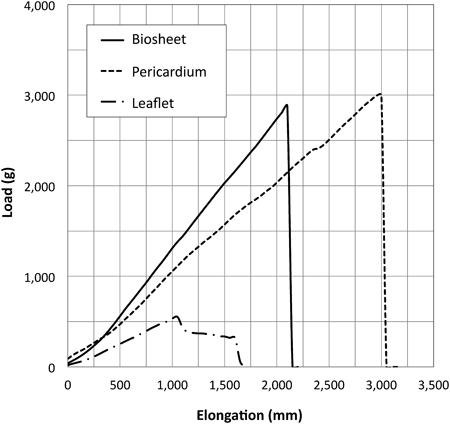
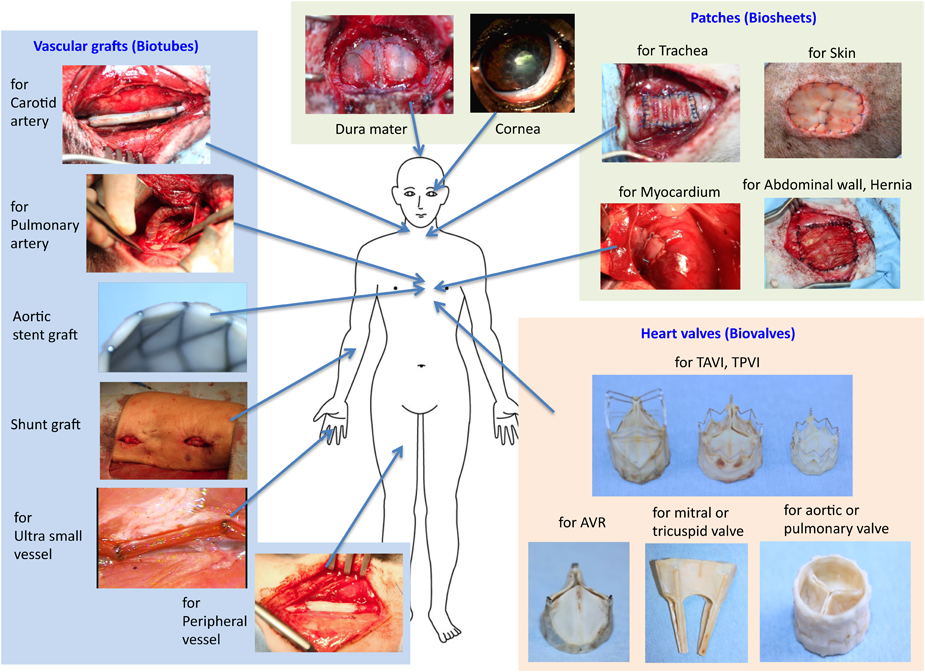
先天性心疾患に対する治療では,管状だけでなく,シート状の材料も多用されている.現在はePTFEや牛心膜などが用いられているが,非分解性であるため成長は望めない.バイオチューブは切り開けばバイオシートとしてシート状になるため,修復,形成用材料としても利用が期待される(Fig. 4A).ヤギで作製した厚さ約0.5 mmのバイオシートは,ヤギ心膜に比べて優れた力学的特性(弾性率と破断荷重)を有していた(Fig. 5).ヤギの大動脈弁葉(厚さ約0.4 mm)に比べてはるかに丈夫である.心筋欠損部にパッチすることで,心筋の再生の足場として機能することをラットの実験で明らかにしている.
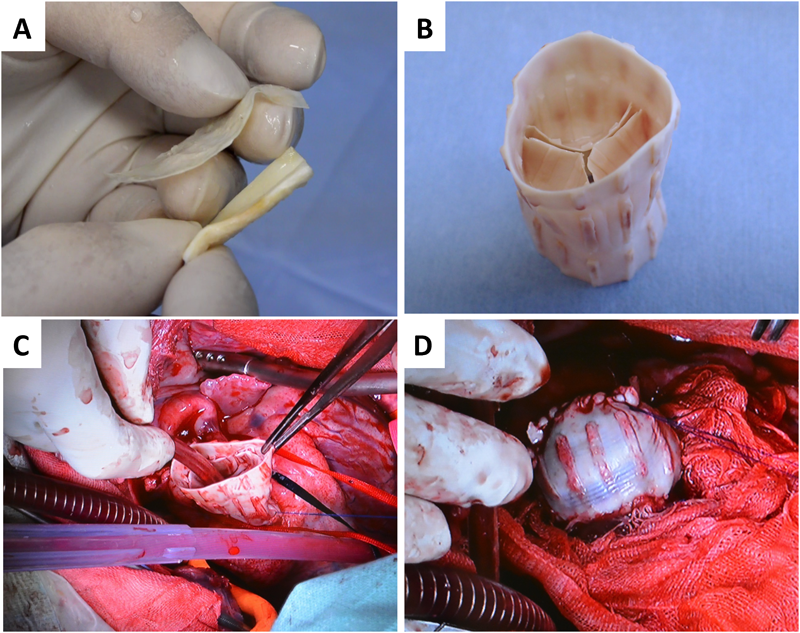
Fig. 1の鋳型を用いると,導管壁を厚くしたバイオバルブを作製することができる(Fig. 4B).3Dプリンターを用いていることから,基本形状を設計すれば,縮小拡大が自由自在である.小型のバイオバルブは,小さく作製した鋳型を皮下に埋め込むだけでできる.成人用から小児用まで患者個々に適切なサイズの鋳型を準備するだけで対応が容易である.
導管一体型で作製したバイオバルブは,生体循環環境を模擬した拍動流回路において逆流率は数%程度と低く6),ヤギにapico-aorticバイパスで移植すると大動脈弁として機能することをエコー検査で確かめた7).2か月後には弁葉部にもα-SMA陽性細胞が多数侵入するなど,バイオチューブで観察された再生過程を同様に認めることができた.また,導管付バイオバルブを右室流出路として完全に置換することも可能であった(Fig. 4C, D).導管壁は丈夫であるため安心して縫合することができた.現在経過観察中であるが,半年以上にわたって機能を維持している.さらに最近では,体内でステントと一体化させたステント付バイオバルブも開発でき,経カテーテル的に大動脈弁や肺動脈弁位に留置することに成功している8, 9).
体内で組織形成させる欠点として,でき上がり時期が判断できないことがある.そこで,鋳型の内部にカプセル内視鏡を内在させて,体内での組織形成の過程を観察した10).1週間後には組織化が始まり,1か月ほどで導管部の組織が完成し,弁葉部まで全てでき上がるのに2か月ほどを要した.導管部は直接生体組織と接しているが,弁膜部は導管部を介して間接的となるため1か月の遅れを生じたと考えられる.動物実験において,新しい鋳型を用いれば,バイオチューブはほぼ1か月で,バイオバルブはほぼ2か月ででき上がる.しかし,個体差は必ず生じるため,埋め込み期間に余裕をみたほうが安全である.
鋳型の埋め込み場所としては,組織完成までの時間,質ともに動物実験においては大きな差はなく,臨床において特に制限はないと考えられる.実施中の臨床研究では,腹部に鋳型を埋め込んで日常生活に障害なく過ごされている.したがって,小柄の小児患者においても鋳型が周囲から目立ちにくく,邪魔になりにくい,腹部の皮下が適していると考える.
外科医が安心して安全に移植するためには,体内ででき上がった組織体の品質を目視や手触りではなく客観的に確かめることができれば望ましい.引っ張り試験などで組織にダメージを与えては移植に使えない.そこで,OCT(Optical Coherence Tomography)を用いた非接触,非破壊での光断層形状観察装置を開発している.でき上がった組織の表面を高速で光走査することで,組織の厚み,均一性,亀裂や欠損の有無を速やかに検査可能となっている.
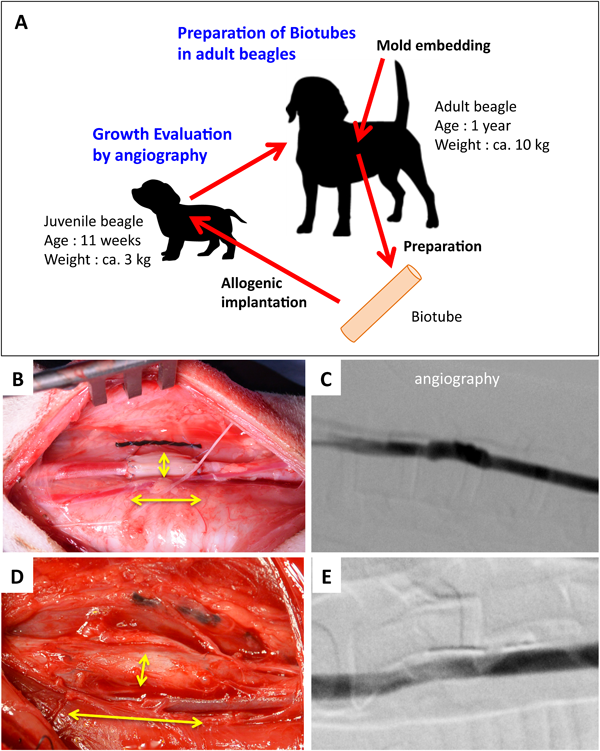
バイオチューブは移植後数か月で自己血管化するため,当然ながらその後の成長の可能性が開発当初から期待感を持って指摘されてきた.しかし,これまでそれを証明するには至っていなかった.一般に動物の成長はヒトに比べて急激に短期間で完了する.そのため動物で成長性を調べることは実験系として非常に難しい.ビーグル犬の場合も同様で,約20年かけて成人に達するヒトに比べて,わずか1年程度で1 kg程度の体重が約10倍に増加して成犬となる.通常乳養期間中の3か月間は実験動物として用いることができず,その間に体重は約3 kgに達する.そこから「鋳型」を埋め込んでバイオチューブを作製すると1,2か月を要するため,さらに体重は増加する.その後移植して1,2か月の生着期間を待つとほぼ成熟するため,既に成長は停止している.そこで,バイオチューブの作製期間だけでも省略するために,移植に用いるバイオチューブは成犬で作製した同種を用いることとした(Fig. 6A).
ビーグル成犬で作製した壁厚約1 mm,内径2~3 mmのバイオチューブをビーグル幼犬の頚動脈(内径約2 mm)に端々吻合で移植した(Fig. 6B, C).移植1か月後に一部を摘出して組織観察すると,これまでの成犬間での同種移植の例と同様に血管壁の再構築が進んでいた.移植後数か月の間は,生体血管の口径が増加したのに対して,バイオチューブ側ではほとんど変化はなかった.しかし,その後は生体血管の口径の増加の後を追うようにバイオチューブ側も増加した.1年後にはビーグルの体重は約10 kgとなり,バイオチューブと生体血管はともに口径が約4 mmとほぼ等しくなった(Fig. 6E).バイオチューブの口径は移植時に比べて最大約1.5倍に拡径しており,さらに長軸方向も最大約1.5倍に延伸していた(Fig. 6D).その間全例において破裂はもちろん瘤化などの異常所見はなかった.生体の成長の後追いの形にはなるが,十分許容な範囲でバイオチューブが成長することを証明できた11).
成長に関する研究例として,Hoerstrupらはpoly(4-hydroxybutyrene)でコーティングしたポリグリコール酸のメッシュを支持体として,血管構成細胞を播種し,拍動流回路内で培養することで組織工学血管組織体を作製した.これを子ヒツジの肺動脈に移植し,2年間継時的に経過観察した.その間,動物の体重が約2倍に増えたのに伴って,CT血管造影で血管径は約30%,長さは約45%増加したと報告している12).生体内では支持体が徐々に分解,吸収され,細胞が産生する細胞外マトリックスに置き換わり,やがて自己組織が再生する.自己化した組織が,その後体内で成長したと考えられる.Choらは,ブタ脱細胞大動脈に自己の骨髄由来細胞を播種することで,血管の再構築が起こることを報告した13).脱細胞組織も生体内で自己組織に置き換われば成長が起こることが示された.
IBTA技術を除いて現状の再生医療では完全に自己組織のみで移植物を作製することは難しく,何らかの異物が含まれる.したがって,移植物を体内で成長させるには,異物の分解が必須となる.分解速度と自己化とのバランスを保たせる必要があるのはもちろんであるが,移植前の段階で自己の細胞を支持体に生着させて,予め限りなく移植対象の自己組織に近づけておくことが肝要と考える.
カプセル化による生体内での組織形成は異物反応であり,埋め込まれた材料に対する弱い炎症反応によるものである.これまでその反応を促進させて厚い組織を得るために,DDS手法を用いた薬物や細胞増殖因子の固定化や徐放化14),LED照射15)や力学的刺激16)など生体反応を惹起させる工夫を開発してきた.しかし,複雑系による機能性の付与は残念ながら医療機器の薬事承認のハードルを上げることに直結する.一方,開発した「新しい鋳型」では形状の工夫という単純な作業原理によって,従来の形状に加えて厚さも自由に設計することが可能となった.得られた管状組織体であるバイオチューブは,これまでの高圧高流量系に加えて,低圧系や末梢系においてもほぼ完全な開存性が得られた.さらに,これまで期待だけに終わっていたバイオチューブの成長性に関して,ビーグル幼犬への同種移植モデルを用いることで初めて実証することができた.拡径だけでなく,伸張も認めることができた.移植時にはほぼコラーゲンだけであった組織は,自己細胞の侵入,生着の足場として優れていたことで,元々人工物を全く含んでいないこともあり完全な形で自己血管が再生されたことによるものと考えられた.
このIBTAを用いた再生医療は,種々の治療分野での組織作製への汎用性が高く,また「鋳型」さえあれば一般の医療施設においても現在の治療方法の範囲内で行えるため,一般治療として広く普及できる高い実現可能性を有していると考える.本稿で紹介した心血管系以外にも,バイオシートは硬膜,角膜,気管,皮膚,腹壁などの再生にも有用である(Fig. 7)17).でき上がる組織は完全に自己組織であるため安全性が高く,治療手技も単純であることから,臨床へのハードルは一見低いように考えられるかもしれない.実際一部は臨床応用に進んでいるが,薬事承認まではそう簡単ではない.IBTAでの移植物は,一般的な考えでは再生医療製品と考えられると思うが,薬機法上では,細胞を扱わないため医療機器製品に該当することになる.しかし,移植する組織は患者自身の体内で形成されるため,自分の体の一部であったものを医療機器としてみなすことは難しいと考える.そのため,組織を作製するための鋳型のみが医療機器に該当することになるであろう.しかし,鋳型は治療や診断をするためのものではないため,厳密な意味では医療機器には該当しないことになる.医療機器に該当するとしても,類似品が存在しないため分類ができない.したがって,このIBTA技術は従来医療の前例にあてはめられないため,薬事承認を得るためには新たな道を開拓していく必要がある.また,知財対策には特に注意が必要である18).本技術は簡便であることが最大の特徴の一つである.鋳型さえあれば容易に治療をすることができる.鋳型の形状は単純であるため,簡単に真似することができる.治療技術として広く普及させる上では簡便性は大きな利点と考えるが,事業化には大きな障害となる.参入障壁を如何に築くかが事業化の成否を左右し,結果的に治療技術としての普及に大きく影響することになると考える.
本論文の要旨は,第51回日本小児循環器学会総会・学術集会(2015年7月,東京)において発表した.本研究の一部は,文部科学研究費補助金挑戦的萌芽研究15K15513の助成を受けて行われた.
引用文献References
1) 中山泰秀:生体内をバイオリアクターとする組織構築.三次元ティッシュエンジニアリング:細胞の培養・操作・組織化から品質管理,脱細胞化まで2015; 337–346
2) Nakayama Y, Ishibashi-Ueda H, Takamizawa K: In vivo tissue-engineered small-caliber arterial graft prosthesis consisting of autologous tissue (biotube). Cell Trans 2004; 13: 439–449
3) Ishii D, Enmi J, Moriwaki T, et al: Development of in vivo tissue-engineered microvascular grafts with an ultra small diameter of 0.6 mm (MicroBiotubes): Acute phase evaluation by optical coherence tomography and magnetic resonance angiography. J Artif Organs 2016; in press
4) Furukoshi M, Moriwaki T, Nakayama Y: Development of an in vivo tissue-engineered vascular graft with designed wall thickness (biotube type C) based on a novel caged mold. J Artif Organs 2016; 19: 54–61
5) Furukoshi M, Nakayama Y: Application of in vivo tissue-engineered, autologous “Biotube” vascular grafts, prepared using a less invasive device, for hemodialysis access in a canine model. Circulation 2015; 132: A13903
6) Nakayama Y, Takewa Y, Sumikura H, et al: In-body tissue-engineered aortic valve (Biovalve type VII) architecture based on 3D printer molding. J Biomed Mater Res B Appl Biomater 2015; 103: 1–11
7) Takewa Y, Yamanami M, Kishimoto Y, et al: In vivo evaluation of an in-body, tissue-engineered, completely autologous valved conduit (biovalve type VI) as an aortic valve in a goat model. J Artif Organs 2013; 16: 176–184
8) Kishimoto S, Takewa Y, Nakayama Y, et al: Sutureless aortic valve replacement using a novel autologous tissue heart valve with stent (stent biovalve): Proof of concept. J Artif Organs 2015; 18: 185–190
9) Sumikura H, Nakayama Y, Ohnuma K, et al: In vitro hydrodynamic evaluation of a biovalve with stent (tubular leaflet type) for transcatheter pulmonary valve implantation. J Artif Organs 2015; 18: 307–314
10) Funayama M, Takewa Y, Oie T, et al: In situ observation and enhancement of leaflet tissue formation in bioprosthetic “biovalve”. J Artif Organs 2015; 18: 40–47
11) Furukoshi M, Iwai R, Moriwaki T, et al: Animal experimental evaluation of growth adaptation in in vivo tissue-engineered “biotube” vascular grafts. Eur Heart J 2015; 36: 868–869
12) Hoerstrup SP, Cummings I, Lachat M, et al: Functional growth in tissue-engineered living, vascular grafts-Follow-up at 100 weeks in a large animal model. Circulation 2006; 114 Suppl: I-159–I-166
13) Cho SW, Kim IK, Kang JM, et al: Evidence for in vivo growth potential and vascular remodeling of tissue-engineered artery. Tissue Eng Part A 2009; 15: 901–912
14) Nakayama Y, Tsujinaka T: Acceleration of robust “biotube” vascular graft fabrication by in-body tissue architecture technology using a novel eosin Y-releasing mold. J Biomed Mater Res B Appl Biomater 2014; 102: 231–238
15) Oie T, Yamanami M, Ishibashi-Ueda H, et al: In-body optical stimulation formed connective tissue vascular grafts, “biotubes,” with many capillaries and elastic fibers. J Artif Organs 2010; 13: 235–240
16) Huang H, Zhou YM, Ishibashi-Ueda H, et al: In vitro maturation of “biotube” vascular grafts induced by a 2-day pulsatile flow loading. J Biomed Mater Res B Appl Biomater 2009; 91: 320–328
17) Satake R, Komura M, Komura H, et al: Patch tracheoplasty in body tissue engineering using collagenous connective tissue membranes (biosheets). J Pediatr Surg 2016; 51: 244–248
18) 特許第5706282号(弁付き管腔形状組織形成用基材,管腔形状組織形成用基材,膜状組織形成用基材,弁付き管腔形状組織の生産方法,管腔形状組織の生産方法,及び膜状組織の生産方法),特許第5643011号(生体由来組織,その生産方法及びこれを生産するための装置),特許第4483545号(人工血管及びその製造方法)など