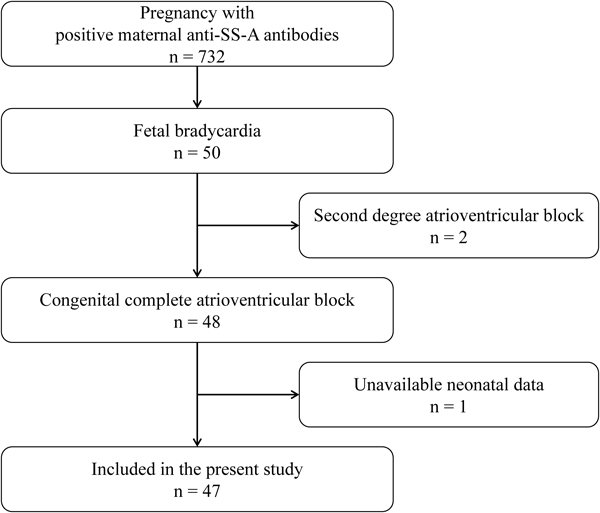
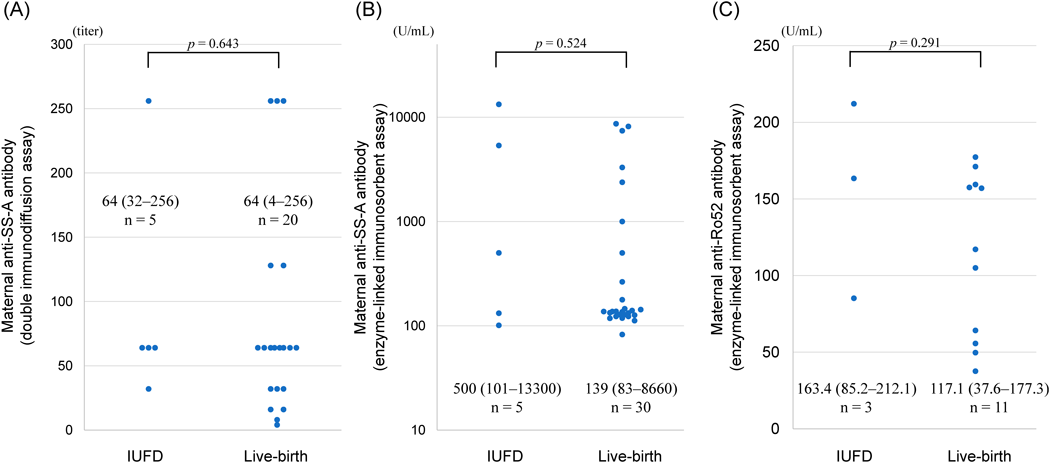
母体抗SS-A抗体陽性の先天性完全房室ブロックの胎児における子宮内胎児死亡の危険因子Risk Factors for Intrauterine Death in Fetuses with Congenital Complete Atrioventricular Block and Positive Maternal Anti-SS-A Antibodies
1 国立成育医療研究センター循環器科Division of Cardiology, National Center for Child Health and Development ◇ Tokyo, Japan
2 久留米大学小児科総合周産期母子センター新生児部門Maternal and Perinatal Medical Center, Kurume University School of Medicine ◇ Fukuoka, Japan
3 筑波大学医学医療系小児内科Department of Child Health, Faculty of Medicine, University of Tsukuba ◇ Ibaraki, Japan
4 国立成育医療研究センター母性内科Division of Maternal Medicine, National Center for Child Health and Development ◇ Tokyo, Japan