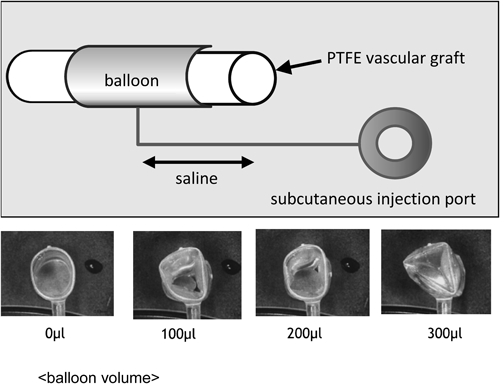
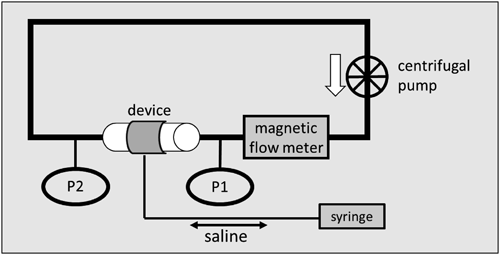
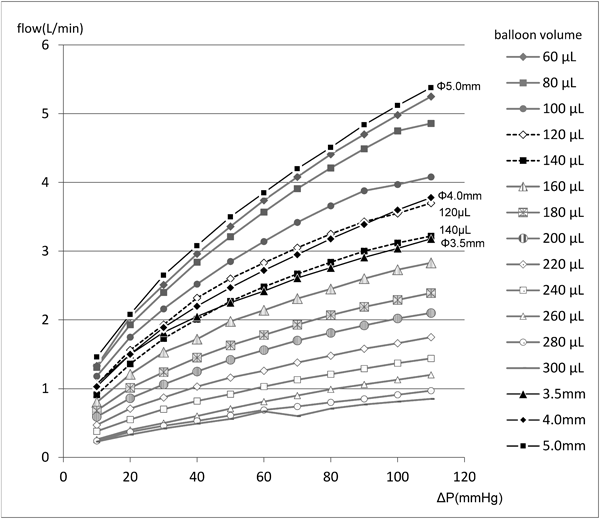
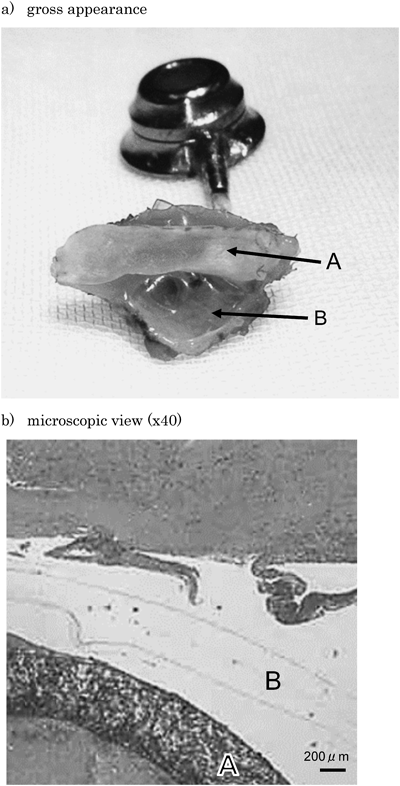
経皮的に小口径人工血管流量調整を可能とする簡易装置の開発:流量調整可能なBlalock–Taussig ShuntのためにDevelopment of a Simple Device Enabling Percutaneous Flow Regulation for a Small Vascular Graft: A Blalock–Taussig Shunt Capable of Flow Regulation
1 大阪医科大学医学部外科学講座胸部外科学教室Department of Thoracic and Cardiovascular Surgery, Osaka Medical College ◇ Osaka, Japan
2 東海メディカルプロダクツ株式会社Tokai Medical Products Inc. ◇ Aichi, Japan