本学会による2001年の「小児心不全薬物治療ガイドライン」の発表から14年の歳月が過ぎ,今回作成班の増員と一部の刷新により同ガイドラインを改訂することとなった.一般にガイドラインは科学的エビデンスに基づいて作成され,例えば日本循環器学会の慢性心不全治療ガイドライン(2000年版)は,日本人を対象とした慢性心不全患者の治療に関して信頼できるエビデンスを積み重ねて,2005年の改定を経て,最新2010年改訂版に反映させている.一方,小児心不全に関連した大きなエビデンスの蓄積状況は芳しくない.2007年,Shaddyらにより心不全治療薬としてベータ遮断薬カルベジロールのRCT結果が公表されたが,小児心不全診療におけるEBM確立が難しいことを再確認する結果となった.小児では狭義の心不全症例数は多くなく,またその基礎疾患のバリエーションが大きいため薬剤の効果判定も難しく,EBMの構築は困難である.その結果として,小児に使われている薬剤の多くがいまだ“薬事法上未承認”の状態での使用であること,さらにはエビデンスレベルの高い根拠に基づいていないという事実は認めねばならない.とは言え,成人で心不全に使用される薬剤が小児にも有効であるとする小さな報告はけっして少なくはなく,これらの薬剤を使用しないことで逆に当該疾患小児に不利益が生じる可能性もある.
小児循環器医が診療する患者の年齢層は,新生児(ときに胎児)・乳児はもとより,学童期・思春期さらには成人(成人先天性心疾患)へと広がっている.循環動態に問題を抱える患者のQOLを含めたよりよい状態の維持および循環動態の悪化・進行の防止,そしてその結果として循環器内科医に良好な状態で引き継ぐことは小児循環器医にとって最大の課題と言ってもよい.この意味で,慢性心不全に対するACC/AHAのガイドラインに示されたステージ分類に沿った治療戦略ないし病態悪化予防は,小児循環器医こそおおいに参考にすべきものであると考える.よって,今回の改訂にあたっても2001年版「小児心不全薬物治療ガイドライン」の基本方針を踏襲し,“小児においてはメガスタディでなくとも科学的手法で分析されて臨床的に有用であると判断されれば、エビデンスレベルが低くても採用する”とした.もちろん使用開始後は継続的にその薬効と副作用を厳重に監視し,いつでも使用の適否を見直す態勢を保つべきである.今後我々日本の小児循環器医が高レベルのエビデンスを発信し,日本発のエビデンスと経験に基づいたガイドラインの改定がなされることを期待する.
本ガイドラインを利用する医師像を前回同様,「専門施設に患者を紹介する機会が多い第一線の医師」を中心とし,primary careとして間違わない方向性を示すこと,第一線の小児科医が遭遇する90%ほどの病態を網羅すること,専門医の処方や治療法を理解する手助けとなること,専門医へ相談できない場合は本ガイドラインに沿って治療を開始できること(のち速やかに専門医と相談すること),教科書(専門書)を読む前に参考になること,という5項目を基本とした.さらには専門医を目指す医師のリファレンスとして,また専門医の知識の再確認としても有用であるレベルを目標とした.本ガイドラインの作成は日本循環器学会「慢性心不全治療ガイドライン(2010年改訂版)」の小児分野および日本循環器学会「小児期心疾患における薬物治療ガイドライン(2012年)」(班長;佐地勉,東邦大学)の内容とも整合性を持たせながら作業を進めた.今回の大きな変更点としては,
- 小児心不全を①収縮機能障害による急性心不全,②収縮機能障害による慢性心不全,③拡張機能障害,④小児期特有の先天性心疾患(心血管構築異常)に由来する広義の循環不全の4病態に区分した.
- 前ガイドラインから継続した④小児期特有の先天性心疾患(心血管構築異常)を補完することを目的に,小児循環器科領域でよく見られる病的循環動態の薬物治療を中心とした管理というセクションを追加した.
という二点である.後者においては“薬物治療ガイドライン”という枠組みを越えているが,心血管構築異常においては循環動態を理解した上で循環管理の一つの方法として薬剤投与が選択されることが多いことおよびこの領域のガイドラインが現在存在しないという二点の理由から新たに章立てを行ったものである.治療薬適応基準クラス分けは,日本循環器学会の「慢性心不全治療ガイドライン」に準じたが,前述のごとくエビデンスレベルはきわめて低いものとならざるをえないため,「エビデンスレベル」の設定は行わず,以下のような「クラス分類」のみを採用した.さらに,Class IIIは読者の誤解を避けるために“避けたい処置”としたことも前回同様である.
〈治療推奨度〉
- Class I……通常適応され常に容認できるもの
- Class II……容認されるが,有効性は不確実で異論もあるもの
- Class III(避けたい処置)……一般的には適応外または禁忌と考えるのが妥当なもの
ガイドラインは現時点の標準的指針であり,今後大きく変わる可能性は否定できない.成人の心室収縮能不全に対するベータ遮断薬がClass IIIからClass Iとなった例を忘れてはならず,常に新しい情報の収集に努めなければならない.
心不全とは単にポンプ不全を意味するものではなく“心臓機能障害により静脈圧上昇と心拍出量低下をきたし,身体各組織の酸素需要に見合う血流が保持できない状態で,運動能低下・不整脈頻発・生存率低下を招来する症候群であり,乳幼児期では体重増加不良を招来する”と定義されている.さらに近年の分子循環器病学あるいは心臓内分泌学の進歩により,慢性期の心不全は代償機転の慢性的な活性化が生じることにより交感神経系・RAA系・抗利尿ホルモンといった種々の神経内分泌因子が複雑に関連しあった一つの症候群であるとも定義されている.加えて,成人における心不全が文字通り心臓のポンプ機能の低下により惹起されることが多いのに対し,小児においてはその基盤として先天性心疾患が多いことから,心臓のポンプ機能は保たれているものの血行動態の異常から心不全に至ることが多い.
本ガイドラインでは薬物治療の視点から小児の心不全を①収縮機能障害による急性心不全,②収縮機能障害による慢性心不全,③拡張機能障害,④小児期特有の先天性心疾患(心血管構築異常)に由来する広義の循環不全の4病態に区分する.
薬物治療の前に
心不全の薬物治療の目的は予後の改善であるが短期的には血行動態の改善が目標となる.いわゆる急性心不全の治療目標は問題となっている血行動態の改善であり,慢性心不全の治療目標は予後改善である.血行動態改善薬の代表はカテコラミン・利尿薬であり,予後改善薬の代表はベータ遮断薬である.RAA系の遮断薬は血行動態改善薬であり予後改善薬でもある.
血行動態改善薬は症状・症候の改善を目的とするので血行動態の把握が重要である.特に小児循環器医は複雑な血行動態を有する先天性心疾患を対象に心不全治療を行うことが少なくないため,血行動態の問題を十分に把握し介入による影響を正確に判断する方法を十二分に考えることが必要である.もう一つ重要なことは血行動態改善薬による介入が予後を悪くする可能性を常に頭に入れておくことである.もちろん急性期を乗り越えなければ慢性期には至らないが,急性期以降に血行動態改善薬の投与を続けることは状況によっては予後を悪くする可能性がある.血行動態改善薬による介入は最小限の量で最短期間でということが基本となる.
一方,予後改善薬投与による効果判定は困難である.ことに血行動態的に多様な心不全診療を行うことの多い小児循環器医にとって,薬物治療による予後改善効果の有無を判断することは非常に難しい.予後改善薬としての効果判定は大きなRCTによってなされるべきであるが,小児においてはいまだ十分なデータは得られていない.小児における小さなデータや成人でのRCTをもとに“logically evidenced”な手法を用いて診療が行われているのが実情であるが,データの蓄積が重要であることは言うまでもない.
これから介入しようとする目的が血行動態の改善であるのか,予後改善であるのかを明確に意識することは重要である.そして血行動態改善を目的とする場合にはその介入が予後を悪くしないか(たとえ血行動態を改善したとしても),予後改善を目的とする場合には本当に予後を改善するという根拠があるのか,血行動態を悪くすることはないかを十分考慮して治療方針を決定しなければならない.
病態1. 収縮機能障害による急性心不全
病態
急性心不全とは“心臓に器質的および/あるいは機能的異常が生じて急速に心ポンプ機能の代償機転が破綻し、心室拡張末期圧の上昇や主要臓器への灌流不全をきたし、それに基づく症状や兆候が急性に出現、あるいは悪化した病態”と定義づけられている.心不全においては,血圧・心拍出量を維持するためにさまざまな代償機構が働く.すなわち血圧・心拍数・心収縮を維持するためのカテコラミンの分泌や,腎血流低下により引き起こされるRAA系システムの賦活である.この代償機転が破綻すると急速に状態が悪化し,急性心不全といわれる状態となる.心室の前負荷すなわち拡張末期圧の上昇は上流の静脈圧上昇による鬱血をきたす.体循環系の鬱血では浮腫・肝機能障害を生じ,肺循環系の鬱血では呼吸困難をきたす.心拍出量の低下は各臓器に虚血性の障害を与え,アシドーシスが進行すれば多臓器不全や死亡に至る.
薬物治療
血行動態を早期に改善し安定を維持することが治療の目標であるが,原因疾患の診断を確定しそれに対する加療も同時に考慮する.血圧や心拍出量を保つためカテコラミンなどの強心薬が,鬱血を改善するために利尿薬が投与される1).ベータ遮断薬投与中の慢性心不全患児の急性増悪の際にはβ受容体を介さないPDE-III阻害薬が投与される.酸塩基平衡・電解質の補正なども重要である.薬物治療が無効の場合には,速やかに機械的補助を考慮する2).急性心不全の重症度分類としては心係数と肺動脈楔入圧で4つの病態に分類するForrester分類が使用されてきたが,慢性心不全の急性増悪などの際にはNoria-Stevenson分類(Fig. 1)が適している3).
前述した代償機転の持続およびカテコラミンを代表とする強心薬の投与は心臓自体には悪影響を与えるために,循環動態が許せば可能な限りカテコラミン類は減量・中止し,可及的速やかにACE阻害薬を代表とする心保護薬を開始するべきである.ベータ遮断薬内服中の慢性心不全患児が急性増悪をきたした場合の急性心不全治療に際しては,ベータ遮断薬は可能であれば継続するが循環動態が不良であれば減量,また心原性ショックをきたしている場合には中止も考慮する4).
病態2. 収縮機能障害による慢性心不全
病態
心室機能障害による慢性心不全とは“慢性の心筋障害により心臓のポンプ機能が低下し,末梢主要臓器の酸素需要量に見合うだけの血液量を拍出できない状態”である5).これは単に心臓の障害をさすものではなく,神経内分泌系因子の賦活化と密接に関係しながら病状が進行する臨床症候群である6,7).虚血や高血圧,あるいは感染などにより心臓に何らかの一次的な障害が生じると,種々の代償機転が機能して生存に不可欠な臓器への血流は保たれるが,この代償機転の持続は心臓および関連諸臓器に進行性の二次的な障害を引き起こす.この二次的な障害は初期には可逆的であるが,最終的には代償不可能な終末期心不全から死に至る.主な代償機転として,交感神経系・RAA系に代表される神経内分泌系因子の亢進が挙げられる.この代償機転により組織への血液供給が維持されるが,後負荷増大に伴う酸素消費量増加から心筋リモデリング(心肥大・心拡大)が進行し,不整脈や突然死を惹起する.これらの変化は適切な治療により改善しうるが,不可逆的に悪化する前に開始されなければならない.
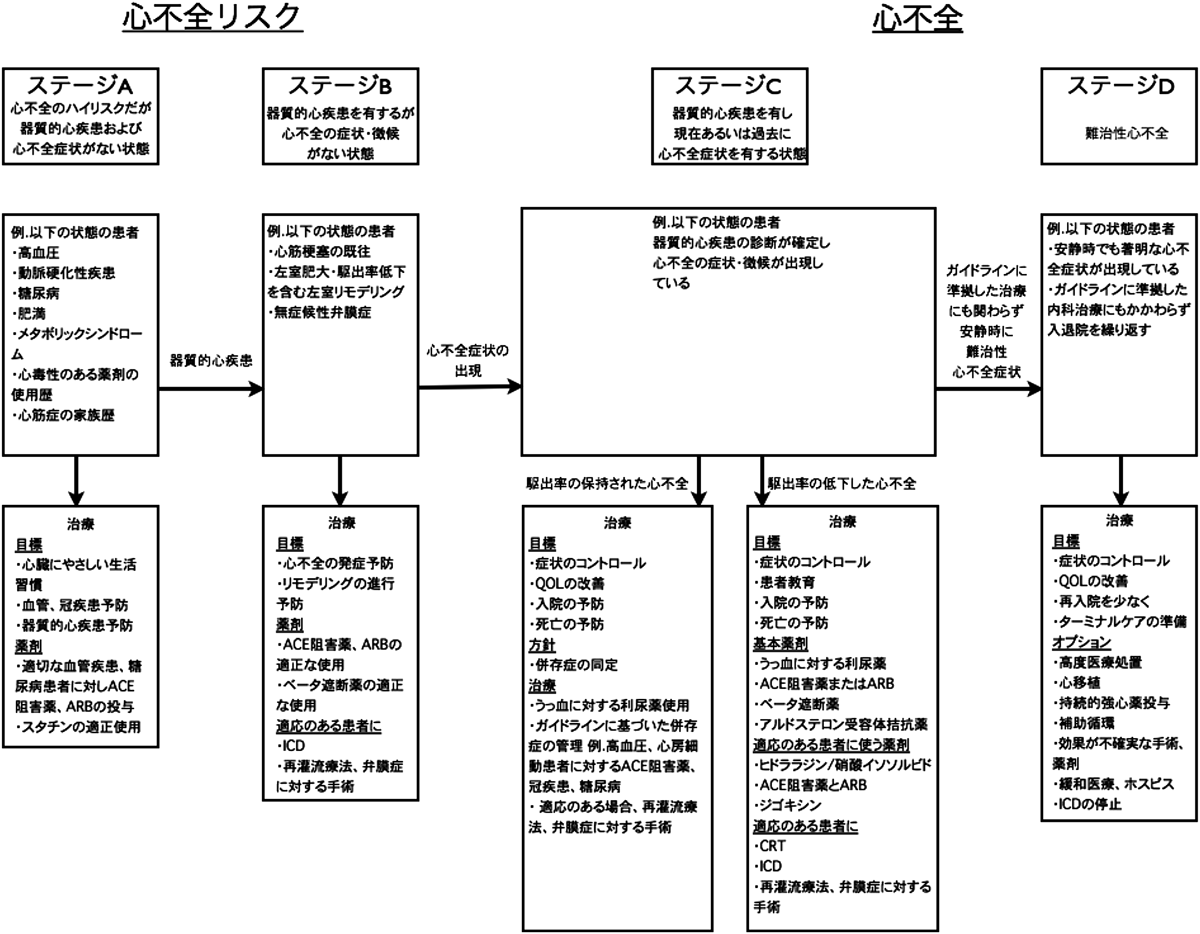
この慢性心不全と称される症候群の重症度を表す指標として成人ではNYHA分類,小児ではROSSスコアなどの指標が用いられてきた.しかしこれらの指標は時間的に一点の症候に焦点をあてた代償の程度から判断したものであり,病初期の患者の選別や現在の病態が改善傾向なのか代償されているのかを見分けるものではない.そこで2002年以降のACC/AHA心不全ガイドラインでは心不全をステージ分類することでNYHA分類を補っている(Fig. 2)8).このステージ分類では心不全リスクを定義し,そのリスクに対して早期介入することで症状発現を遅らせるように設計されている.症状が発現した患者に対してはより強力な薬物治療を行い,リバースリモデリングさせることで心不全ステージを逆行させる必要があることも記されている.小児における同様のステージ分類はISHLTが作成している小児の心不全ガイドライン9)に記載されている.しかしながらステージAすなわち無症状,検査値異常がない状態でも心不全発症のリスクが高い例として記載されているのは心毒性物質への曝露,遺伝性心筋症の家族歴,単心室のみである.小児心不全においては病態が複雑であるなどの理由から心不全のステージ分類はいまだ不十分であると考える(Table 1).
Table 1 乳児・小児心不全ステージ分類の提案(文献5より引用改変)| ステージ | 状態 |
|---|
| A | 心不全発症リスクが高いが心機能は正常で心腔拡大を認めない.例:心毒性物質への曝露,心筋症の家族歴,遺伝性心筋症の家族歴,単心室. |
| B | 心臓の形態または機能異常を有するが,過去および現在心不全症状を呈していない.例:左室拡大を伴う大動脈弁閉鎖不全,左室機能不全を呈するアントラサイクリン使用歴. |
| C | 過去または現在心不全症状を呈している構造的,機能的心疾患.例;有症状の心室収縮障害を呈する心筋症あるいは先天性心疾患. |
| D | 最大の内科治療にも関わらず安静時に著しい症状を呈する.例;特別な治療(強心剤の持続静注,機械的循環補助,移植あるいは末期患者としてのケア)を要する状態. |
薬物治療
心不全ステージ分類に沿った治療を行う.すなわち代償機転が不十分でサポートが必要な場合は急性心不全として加療する.リスク因子を有する場合(ステージA)や代償機転により無症状な状態(ステージB)でも介入が必要である.目標は心保護で,結果として予後やQOLの改善をはかることにある.
心不全の原因がポンプ機能不全であれば急性期にはポンプ機能をよりよくすることが治療戦略の柱である.しかし慢性心不全においては,心不全を進行させる神経体液性因子抑制に主眼がおかれている.陽性変力作用を有するカテコラミンなどの薬剤では心不全の予後は改善しないが,ベータ遮断薬を代表とする心保護薬を用いると予後が改善することが成人心不全で証明されている.心保護薬として予後改善が報告されている薬剤はRAA系を抑制する薬剤(ACE阻害薬・ARBおよびアルドステロン遮断薬)とベータ遮断薬である.神経体液性因子の亢進は代償機転として作用しており,この代償機転を過度に急激に抑制することは血行動態の増悪を生じる可能性がある.心保護薬の導入(各薬剤の章参照)はいずれも少量より開始し漸増するが,その間は注意深い観察が必要である.
上述の様に慢性心不全の治療は症状が出現してからではなく心不全リスクを有する状態からはじめるべきである.しかしながら前述のごとく小児心不全において予後からみたリスク因子はまだ明確になっていない部分が多い.すでに症状が出現した患者においても強力に薬物治療を行うことでステージを逆行させることが可能かもしれない.
病態3. 拡張機能障害
病態
心機能障害は収縮機能障害と拡張機能障害に大別される.収縮機能障害をきたす心不全においても拡張機能障害を伴うが,著しい収縮機能障害(左室駆出率≦35%)では収縮機能障害の治療が優先される.本ガイドラインでは拡張機能障害を,収縮機能障害を伴わない狭義の拡張機能障害と定義する.成人では左室駆出率が保持されていて心不全症状を呈する症例は“Heart Failure with preserved Ejection Fraction”と分類され,左室駆出率が低下して心不全症状を呈する心不全症例とは疫学,経過,治療効果などが異なる群として報告されている10–13)が,生命予後に関しては両者に大きな差を認めないとする報告もある14).心室駆出率,心室拡張末期容積が正常であっても心室の拡張障害のために充満が障害される結果,病態の進行に伴い心拍出量の減少(特に心拍数が増加する運動時に顕著になる),左房圧上昇に伴う肺鬱血,肺高血圧から易疲労感,息切れなどの症状を呈する.原疾患により,弁膜症や心外膜炎,アミロイドーシスなどの二次性なものと拘束型心筋症や心筋緻密化障害などの心筋疾患が原因であるものに分けられているが,成人においては圧倒的に高血圧に合併する症例が多い.いずれも小児ではまれな疾患であるが,いわゆるrestrictive physiologyに関しては小児でも報告されている15).また病態生理により,弛緩能の低下とスティフネスの上昇(コンプライアンスの低下)に分けることもできる.
薬物治療
狭義の拡張機能障害に対する治療は,成人においても大規模臨床試験に基づく確立したエビデンスはない.薬物治療は経験と病態に基づいた考え方によって対症的に行われる.
- ①利尿薬:肺鬱血および末梢浮腫に対し対症的に使用される.しかし,拡張不全をきたす心室に対する前負荷の軽減は心拍出量の低下につながる可能性もあり,慎重に投与すべきである.アルドステロンは心肥大や線維化の促進作用があることから,抗アルドステロン薬は拡張障害自体に有効である可能性がある.
- ②ベータ遮断薬:心拍数低下による心室充満と冠血流増加(特に運動時)や心筋酸素消費量の低下,血圧低下作用による心筋肥大の抑制などさまざまな利益を期待して投与される.少人数ではあるが成人での有効性の報告もある16).小児拡張機能障害でも考慮してもよい薬剤である.
- ③ACE阻害薬およびARB:成人では血圧低下による心肥大軽減作用とアンジオテンシンⅡ産生低下による心室のスティフネス低下を期待して投与されるが,生命予後改善に繋がる報告はない.心筋肥大を伴う拡張機能障害では小児においても考慮してもよい薬剤と考えられる.血管拡張にみあった心拍出量の増加が見られない場合,低血圧をきたす可能性があり注意が必要である.
- ④PDE-V阻害薬:成人での拡張機能障害の肺高血圧(平均肺動脈圧>40 mmHg)症例44例にてシルデナフィルのQOL改善効果が報告されている17).小児でも肺高血圧を伴う拡張機能障害では考慮してもよい薬剤である.
病態4. 心血管構築異常に由来する心不全/循環不全
心血管構築異常に由来する心不全は高心拍出性心不全あるいは血行動態異常を特徴とする小児特有の病態である.治療は手術あるいは心臓カテーテル治療による心血管構築異常の修復が基本である.薬物治療は術前の循環維持・改善を主な目的とする.また術後の血行動態的問題(遺残短絡,狭窄,閉鎖不全など)に対する薬物治療も重要である.病初期の治療方針が予後に大きく影響することがあるため,手術を含めた治療方針をたてるために必要があれば専門施設に速やかに相談する.
A. 新生児~乳児期早期に発症する心不全/循環不全
A-1 肺血流動脈管依存型代表疾患
- ・肺動脈閉鎖兼正常心室中隔(純型肺動脈閉鎖)
- ・肺動脈閉鎖または高度狭窄を伴う下記心疾患
- ファロー四徴症,単心室,三尖弁閉鎖,大血管転位,両大血管右室起始
- ・機能的肺動脈閉鎖を伴うエプスタイン病
心室から肺動脈への高度狭窄・閉鎖病変,あるいは高度の右心不全による拍出障害により肺血流を維持できない病態である.体循環への血流は維持されるがしばしば高度のチアノーゼを呈する.動脈管を介した肺血流の維持を目的にプロスタグランジンE1製剤の持続静注を開始する.リポプロスタグランジンE1で開始するが,十分な動脈管の開存が得られない場合はプロスタグランジンE1-CDを試みる.血圧低下,無呼吸などの副作用に留意する.動脈管の開存により逆に高肺血流の状態になることもあり注意が必要である.プロスタグランジンE1による動脈管開存維持後,各疾患の治療戦略に応じて外科治療(Blalock-Taussig短絡手術など)あるいは心臓カテーテル治療(経皮的肺動脈弁形成術など)により動脈管によらない肺循環の確立を目指す.酸素投与は動脈管収縮を促すので通常禁忌であるが,重症の低酸素血症の場合は酸素を投与する.いずれの場合も速やかに専門施設と相談する.
A-2 肺血流量増加型代表疾患
- ・肺高血圧を伴う下記心疾患
- 心室中隔欠損,完全型房室中隔欠損,単心室,三尖弁閉鎖,完全大血管転位,両大血管右室起始,動脈管開存,総動脈幹症,大動脈肺動脈窓
心内または大血管位短絡のため肺血流量が増加する.新生児期~乳児期早期の肺血管抵抗の低下に伴い肺血流は増加し心不全をきたす.増加した肺血流による呼吸症状を呈するため,喘息や呼吸器感染症と診断される症例もみられる.薬物治療は利尿薬により肺鬱血の改善を図る.ループ利尿薬(フロセミド)とカリウム保持性のあるスピロノラクトンとの併用が多い.
ミルクや輸液量を過度に制限することは低血糖や電解質異常を惹起する可能性がある.特に経口哺乳に関しては“飲んではいけない”状態ではなく“飲めない”疾患であるため基本的には哺乳制限は不要である.貧血は心不全の増悪因子で輸血が著効する場合がある.強い心不全で症状が改善しない場合は早期外科治療(心内修復術,肺動脈絞扼術など)を考慮し,速やかに専門施設に相談する.手術を前提に,術前管理として窒素を用いた低酸素換気療法や調節呼吸により肺血流量の制御を行うことがある.
A-3 体血流動脈管依存型代表疾患
- ・単純型大動脈縮窄
- ・大動脈縮窄または大動脈弓離断を伴う下記心疾患
- 心室中隔欠損症,単心室,三尖弁閉鎖,完全大血管転位,両大血管右室起始
- ・左心低形成症候群
大動脈弓の縮窄・離断により体循環が動脈管に依存する病態で,生命維持に動脈管開存が必須である.診断後は速やかにプロスタグランジンE1製剤を投与(A-1に準じる)して動脈管の維持を図る.
動脈管の生理的あるいは酸素投与による収縮により,体循環の急激な循環不全を呈することがある(ductal shock).
肺血流量増加型の病態を併発しやすく,A-2に準じた心不全管理を並行することが多い.プロスタグランジンE1による動脈管開存維持後,外科治療(大動脈弓再建術など)により体循環の確立を目指す.診断後は速やかに専門施設に連絡する.
A-4 必須の心房間交通に障害代表疾患
- ・三尖弁閉鎖,肺動脈閉鎖兼正常心室中隔(純型肺動脈閉鎖),僧帽弁閉鎖,左心低形成症候群,完全大血管転位,両大血管右室起始の一部
肺動脈閉鎖兼正常心室中隔(純型肺動脈閉鎖),三尖弁閉鎖,僧帽弁閉鎖,左心低形成症候群では心臓に還流してきた静脈血の心房レベルでの交通が必須である.不十分な場合,強い体静脈ないし肺静脈の鬱血から循環不全をきたす.また,完全大血管転位やそれに類似した血行動態を有する両大血管右室起始では体動脈血の酸素化に心房レベルでの交通が必要である.したがって,心房間交通が不十分な症例は心房中隔裂開術が必要である.
A-5 肺静脈血の還流障害代表疾患
胎児期は肺血流が少ないため胎児心エコーによる診断が困難な疾患であるが,生後肺循環の確立に伴い急速に肺鬱血が進行する.診断確定後は速やかに専門施設に紹介し,外科手術を行う.手術までは利尿薬による肺鬱血の軽減をはかり,重症度に応じて鎮静や人工呼吸管理を行う.酸素は肺鬱血を助長する可能性があり,通常使用しない.
A-6 高度半月弁狭窄による著しい低心拍出代表疾患
著しい弁狭窄のため体血流あるいは肺血流の前方拍出が著しく低下している病態で,動脈管開存維持を必要とする場合がある.診断後は速やかに専門施設に紹介し,カテーテル治療あるいは外科手術による大動脈弁/肺動脈弁形成術を行う.重症度に応じて利尿薬・カテコラミン投与,人工呼吸管理を行う.重症大動脈弁狭窄に対する血管拡張薬投与は冠動脈潅流低下から心筋虚血を惹起するため禁忌である.
A-7 その他:新生児遷延性肺高血圧新生児仮死,胎便吸引症候群,横隔膜ヘルニアなどが原因となる.生後肺血管抵抗が高く,動脈管開存や心房間交通を要する.基礎疾患に対する治療の他,人工呼吸管理,酸素投与,アシドーシス補正を行う.肺血管拡張薬としてNOガス吸入療法,シルデナフィル,ボセンタン,エポプロステノール持続静注の有効例が報告されている.難治例には体外式膜型人工肺を導入する.
B. 乳幼児期以降に発症する心不全/循環不全
B-1 肺血流量増加代表疾患
- ・心室中隔欠損,房室中隔欠損,動脈管開存,心房中隔欠損
心不全症状が強い場合はA-2に準じた管理を行う.肺血流増加により呼吸症状を呈する場合は利尿薬を投与する.ジゴキシンや経口強心薬については有効性が一定でない.手術適応は専門機関に相談する.
B-2 低酸素血症代表疾患
- ・ファロー四徴症,肺動脈漏斗部狭窄を伴う単心室,三尖弁閉鎖,大血管転位,両大血管右室起始
肺動脈弁下部狭窄を有する心疾患では流出路の発作的攣縮により無(低)酸素発作とそれに続く循環不全を呈することがある.貧血には積極的に鉄剤を投与する.無酸素発作の予防にベータ遮断薬(プロプラノロール,カルテオロール)の内服が用いられる.無(低)酸素発作時は胸膝位をとり,酸素投与,塩酸モルヒネの皮下注を行う.静脈内投与可能であれば輸液やアシドーシス補正を行う.改善が得られない場合はプロプラノロール静注が有効であることがある.プロプラノロール使用時は心電図に留意しながら5分以上かけて)静注する.血管収縮薬としてのフェニレフリン静脈内投与が有効である.
本疾患群は計画的に手術を行うため,診断後は早期に専門機関に相談する.
B-3 弁逆流代表疾患
- ・大動脈閉鎖不全,僧帽弁閉鎖不全,共通房室弁閉鎖不全
ACE阻害薬,ARBが使用される.鬱血の改善を目的に利尿薬を併用することがある.ジゴキシン,強心薬の有効性に十分なエビデンスはない.明らかな臨床症状を呈さない場合でも,心室拡大傾向を認めた場合には早めに専門機関に相談する.
B-4 半月弁狭窄代表疾患
軽度~中等度の弁性肺動脈弁または大動脈弁狭窄は心不全を呈さないことが多く薬物治療の適応がない.ACE阻害薬をはじめとする血管拡張薬は血行動態を悪化させるおそれがあり相対的禁忌とされている.中等症以上では専門施設においてカテーテル治療あるいは外科手術による大動脈弁/肺動脈弁形成術を行う.
B-5 心筋の異常代表疾患
- ・拡張型心筋症,肥大型心筋症,拘束型心筋症,心筋炎
拡張型心筋症では成人と同様にACE阻害薬,ARB,ベータ遮断薬の併用による心保護療法を行う.重症心不全の場合は急性心不全の治療に準じ,進行例については補助人工心臓,心臓移植を考慮すべく専門医と相談する.閉塞性肥大型心筋症や拡張障害のある非閉塞性肥大型心筋症に対してはベータ遮断薬,カルシウム拮抗薬(ベラパミル,ジルチアゼム)を使用する.非閉塞性肥大型心筋症に対しては血管拡張薬が禁忌とならないため,ACE阻害薬,ARBが投与される.収縮機能低下例や拡張相肥大型心筋症の場合もACE阻害薬,ARBが適応となる.
不整脈による突然死のリスク(家族歴,失神の既往など)が高い場合にはアミオダロン投与や植込み型除細動器を考慮する.拘束型心筋症は肺鬱血の改善を目的として利尿薬が使用されるが,拡張障害自体の改善に有効な薬剤はない(拡張機能障害の項参照).心筋炎は急性心不全の治療に準じるが,劇症型や難治性不整脈では経皮的心肺補助循環を導入することで回復が期待できることがある.高度房室ブロック例に対して一時的ペースメーカーが有効である.炎症に対してはステロイドやガンマグロブリンが使用されることがあるが効果は不明である.慢性心筋炎においては心保護療法(ACE阻害薬,ARB,ベータ遮断薬)を考慮する.最終的手段として心臓移植を常に考慮しながら治療にあたる.
1. カテコラミン
カテコラミンはアドレナリン受容体と結合して,種々の生理活性を発現する(Table 2).正常心筋に存在するβ受容体の大部分はβ1受容体であり,心筋収縮力の増強(positive inotropic effect),心筋弛緩速度の増加(lusitropic effect),心拍数の増加(chronotropic effect),刺激伝導速度の増加(dromotropic effect)作用を発現する.不全心ではβ1受容体のダウンレギュレーションにより相対的にα1A受容体の役割が大きくなる.一方,血管の交感神経支配は臓器・血管の種類によりさまざまである.血管平滑筋においてβ受容体刺激は拡張作用を示し,α1受容体刺激は収縮作用を惹起する.
Table 2 アドレナリン受容体の生理作用と作用する薬剤| 受容体 | 生理作用 | 薬剤 |
|---|
| 組織 | 作用 | 作動薬 | 遮断薬 |
|---|
| α1 | 平滑筋:血管,虹彩,尿管,立毛筋,子宮,括約筋(腸管,膀胱) | 収縮 | メトキサミン,フェニレフリン | プラゾシン,テラゾシン |
| 平滑筋:腸管 | 弛緩 | | ドキサゾシン,コリナンチン |
| 心筋 | 陽性変力作用(β1≫α1),心筋肥大 | | フェントラミン |
| 唾液腺 | 分泌 | | フェノキシベンザミン |
| 脂肪組織 | グリコーゲン分解 | | |
| 汗腺 | 分泌 | | |
| 腎(近位尿細管) | 糖新生,Na+再吸収 | | |
| α2 | 交感神経終末上にあるシナプス前自己受容体 | ノル工ピネフリン分泌抑制 | グアンファシン,クロニジン | ヨヒンビン,ピペラキソン |
| 血小板 | 凝集 | αメチルノルエピネフリン | ラウオルシン |
| 膵臓 | インスリン分泌抑制 | トラマゾリン | フェントラミン |
| 脂肪組織 | 脂肪分解抑制 | キシラジン | フェノキシベンザミン |
| 血管平滑筋 | 収縮 | グアナドレル | |
| 腎 | レニン分泌抑制 | オキシメタゾリン | |
| β1 | 心筋 | 陽性変力作用,陽性変時作用,心筋肥大 | イソプロテレノール,プレナテロール | プロプラノロール |
| 脂肪組織 | 脂肪分解 | ドブタミン | アテノロール |
| 腎 | レニン分泌 | | ビソプロロール,メトプロロール |
| β2 | 平滑筋:気管支,子宮,腸管,血管,排尿筋 | 弛緩 | サルブタモール,リミテロール,アルブテロール | 高濃度β1遮断薬 |
| 骨格筋 | 糖新生,乳酸分泌 | テルブタリン | ブトキサミン |
| 肝 | グリコーゲン分解,糖新生 | イソプロテレノール | プロプラノロール |
| 膵臓 | インスリン分泌 | | |
| 唾液腺 | アミラーゼ分泌 | | |
カテコラミン投与は,上記のような機序で心拍出量を増加し,血圧を上げうる.その一方で心筋細胞の酸素需要およびCa2+負荷を増強させるので,不整脈,心筋虚血,心筋障害を惹起する可能性がある.遠隔予後を改善する薬剤ではないためその使用は必要最小限にとどめ,可能な限り早期から心保護療法を開始することが肝要である.
薬剤が血管外漏出した場合,局所の血管収縮作用により組織の壊死をきたす可能性があることおよび確実な投与が必要であることから,可能な限り太い血管あるいは中心静脈ルートを用い,カテーテル先端が適切な位置にあることを確認した上で投与を開始することが望ましい.
以下に各薬剤の特徴を記載したが,その差異は各薬剤のそれぞれの受容体への親和性に依存している.また病態により効果が異なる.慢性心不全の急性増悪ではβ受容体のダウンレギュレーションや交感神経末端のカテコラミンの枯渇を考慮して薬剤を選択する必要がある18).使用量の目安を記載したが,循環動態を改善する薬剤であり,循環動態を評価しながら薬剤の種類および投与量を決定する.小児においては循環動態の把握にstress-velocity relationship評価の有用性が報告されている19,20).
(1)ドブタミン
ドブタミンは合成カテコラミン薬であり,強いβ受容体刺激作用と軽度のα受容体刺激作用を有する.β1受容体選択性が強く,用量依存的に陽性変力作用,陽性変時作用を発揮する.5 µg/kg/分以下では,β2受容体刺激を介して軽度の血管拡張作用を発揮するが,血圧はそれぞれの受容体刺激のバランスによりさまざまである.副作用として頻脈・不整脈が生じることがあり,投与量の調整が必要となることがある.また血圧の上昇・低下が認められることがある.
(2)ドパミン
ドパミンは内因性カテコラミンであり,ドパミン受容体,β受容体,α受容体刺激作用を有する.低用量(3 µg/kg/分以下)では,ドパミンシナプス後受容体(DA1受容体)を刺激して,腎動脈拡張作用による糸球体濾過量の増加と腎尿細管への直接作用により利尿効果を示す.中用量(3~10 µg/kg/分)では,β1受容体刺激作用と交感神経末端からのノルアドレナリン放出増加により,陽性変力作用,心拍数増加,α1受容体刺激による血管収縮作用をもたらす.高用量(10~20 µg/kg/分)ではα1受容体刺激作用が優位となり,血管抵抗が上昇する.そのため低心機能症例では心拍出量が増加しにくくなる.肺血管抵抗も上昇する.
(3)ノルアドレナリン
ノルアドレナリンは内因性カテコラミンであり,交感神経節後線維や副腎髄質においてドパミンから合成される.β1受容体刺激作用により陽性変力作用と陽性変時作用を示す.血管,特に抵抗血管においてはベータ受容体刺激作用よりα1受容体刺激作用が強く強力に血管平滑筋を収縮させ血圧を上昇させる.アナフィラキシーショック・敗血症性ショックなど,心収縮は保たれているが血管拡張が原因の低血圧がよい適応である.持続点滴として0.05~1.0 µg/kg/分にて用いる.高度の血管収縮により,心筋酸素消費量を増加させ,腎臓をはじめとする内臓血流量を減少させるので,注意が必要である.
(4)アドレナリン
ノルアドレナリンと同様,内因性のカテコラミンであるアドレナリンは,β1受容体に作用して洞房結節での陽性変時作用により心拍数を増加させるとともに,陽性変力作用により心筋収縮力を増強する.血管に対しては,α受容体刺激による血管収縮とβ受容体刺激による血管拡張のバランスで各臓器における作用はさまざまである.皮膚,内臓血管では血流低下,骨格筋では増加する.肺血管は収縮する.低心拍出状態において,持続点滴として0.05~1.0 µg/kg/分にて用いる.心停止時の蘇生にも用いられる.
(5)イソプロテレノール
非選択的にβ受容体を刺激するが,α刺激作用は少ない.心筋の収縮力増強,心拍数増加に作用が強く,同時に拡張期圧を低下させる.β2作用による気管支拡張作用も発現する.洞性徐脈や房室ブロックによる心機能異常,肺高血圧を伴う心機能障害時に有効で,0.01~1.0 µg/kg/分で用いる.
2. ホスホジエステラーゼ-Ⅲ阻害薬
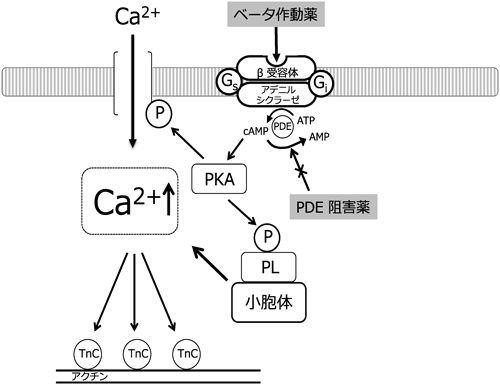
PDE-IIIは心臓,血管平滑筋,血小板,脂肪細胞に分布し,細胞内cAMPを分解する働きをもつ.cAMPはカテコラミンが作用するβ受容体のセカンドメッセンジャーである.PDE-III阻害薬はこれらの組織において細胞内cAMP分解を抑制し,心筋で陽性変力作用,血管平滑筋で血管弛緩作用を惹起する(Fig. 3).心拍数や心筋酸素消費を上げない特徴をもつ21).β受容体を介さないことから同受容体のダウンレギュレーションによる耐性を生じにくい.末梢血管からの投与が可能であり,左心機能不全による低心拍出状態,急性肺水腫,カテコラミン不応例に適応がある.またβ受容体を介さないことからβ遮断薬投与中の心不全増悪の際は第一選択となる薬剤である.血管拡張作用があるため血管内脱水がある場合や低血圧時の心原性ショックでの投与には注意を要する.現在ミルリノン,塩酸オルプリノンが使用可能であり,小児開心術に対してはミルリノンの有効性,安全性が報告されている22).副作用として血圧低下,頻脈性不整脈に留意する.
3. 経口強心薬
経口強心薬にはジギタリス製剤,PDE-III阻害/カルシウム感受性増強薬,β1受容体刺激薬,ドパミンプロドラッグがあり,利尿薬投与で症状が改善しない心不全,カテコラミン持続静注からの離脱,さらにベータ遮断薬導入の際に用いられている.必ずしも予後改善が期待できる薬剤ではなく,投与目的を明確にすることが重要である.
(1)ジギタリス製剤
ジギタリスは陽性変力作用,交感神経抑制作用,電気生理学的作用を有する.
ジギタリスの陽性変力作用はNa+/K+ ATPaseを選択的に阻害することで生じる.上昇した細胞内Na+によりNa+/Ca2+交換系を介したCa2+の汲み出しが低下し,結果的に細胞内Ca2+濃度が上昇し陽性変力作用を発揮する.交感神経抑制作用は圧受容器を介してあるいは直接的に交感神経を抑制すると言われている.電気生理学的には副交感神経亢進および交感神経低下作用により心房・房室結節の自動能を低下させ拡張期最大静止膜電位を上昇させる.この結果,有効不応期が延長し房室伝導速度が低下する.
従来は経口強心薬として心不全治療に大きな役割を占めていたが,現代の心不全治療においてはその役割は微妙である.急性心不全に関しては切れ味のよいカテコラミンが使用されることが多い.慢性心不全に対してはRADIENCE試験ではジゴキシン中止群(プラセボ群)で心不全増悪および運動耐容能低下が報告されている23).DIG試験によれば総死亡は変わらなかったが,心不全増悪による入院・死亡は減少している24).即ち予後を改善する薬ではないが,QOLを改善する薬である.ただしDIG試験のサブ解析では血中濃度1.2 ng/mL以上ではプラセボ群より死亡率が高く,投与量には留意が必要で0.5~1.0 ng/mLが推奨されている.左–右短絡性心疾患に対しては肺体血流比をむしろ増加させることがあり,推奨しない25).副作用としては高度の徐脈,多源性心室期外収縮,重篤な房室ブロック,心室頻拍症などの不整脈を呈することがある.悪心・嘔吐などの消化器症状や視覚異常はジギタリス中毒症状の可能性があり注意が必要である.カルベジロール,アミオダロンなどはジゴキシンの血中濃度を上昇させることがあり併用時には注意が必要である.利尿薬との併用では低カリウム血症によるジギタリス中毒になりやすく,注意深いモニタリングが必要である.
- Class II
- 低駆出率で心不全症状を有する左室不全に対するジギタリスの使用.
- Class III
- 無症状の左室不全に対するジギタリスの使用.
- 洞機能不全・房室伝導障害のある患者に対するジギタリスの使用.
(2)ピモベンダン
PDE-III阻害作用を有し,心筋細胞ではcAMP分解を抑制することで陽性変力作用を発揮する.一方血管平滑筋細胞においては血管平滑筋を弛緩させ血管拡張作用を表す.またカルシウム感受性増強薬でもあり,心筋の収縮調節蛋白であるトロポニンCのCa2+に対する感受性を増強させ強心作用を惹起する.
PICO研究26)では死亡率を上げず運動耐容能を改善し,EPOCH研究27)では心血管イベントをむしろ減少させている.収縮不全が心不全症状に寄与している場合には,QOL改善の点から心機能を改善させない程度の少量を使用することはメリットがあるかもしれない.副作用に不整脈がある.閉塞性肥大型心筋症・重篤な不整脈などの患者への投与は禁忌である.
- Class II
- 低駆出率で心不全症状を有する左室不全に対するピモベンダンの使用.
(3)デノパミン
β1受容体選択的刺激薬であり,陽性変力作用を惹起する.β1受容体への作用はイソプロテレノールに比し弱く,催不整脈作用,陽性変時作用も弱い.耐性は出現しにくい.副作用には不整脈がある.閉塞性肥大型心筋症・重篤な不整脈などの患者への投与は禁忌である.
(4)ドカルパミン
ドパミンのカテコール基およびアミノ酸基を保護した化学構造を持つドパミンの経口プロドラッグであり,ドパミン受容体D1および心筋細胞β1受容体を活性化させ,陽性変力作用を発揮する.カテコラミンの離脱困難例で持続静注から離脱する場合などに用いる.副作用に不整脈がある.閉塞性肥大型心筋症や褐色細胞腫の患者への投与は禁忌である.
4. アンジオテンシン変換酵素阻害薬/アンジオテンシン受容体拮抗薬
ACEは亜鉛を活性中心にもつメタロプロテアーゼの一種であり,ジペプチジルカルボキシペプチダーゼとしての働きを持つ.この働きにより,アンジオテンシンⅠは生理活性の強いアンジオテンシンⅡに変換される.アンジオテンシンⅡはアンジオテンシン1型受容体と結合して血管収縮,交感神経系の活性化,アルドステロン分泌の亢進を惹起し心筋組織においては心筋肥大や線維化を促進する.ACE阻害薬はACEが活性中心にもつ亜鉛と強力に結合することでACE活性を阻害し,アンジオテンシンⅠのアンジオテンシンⅡへの変換を阻害することで上記作用を抑制する.ACE阻害薬はブラジキニンの分解,不活化をも阻害するため,ブラジキニンを介したNO産生やエンドセリン抑制による血管拡張,臓器保護作用をも有する.心筋においてはリモデリング抑制として働くが,組織ACEとの親和性が重要である.ARBはアンジオテンシン1型受容体を阻害することでアンジオテンシンⅡの作用を抑制する.ACE阻害薬やARBはいずれも交感神経系の抑制や心筋リモデリング抑制作用を有することで慢性心不全に有効な薬剤と位置づけられている.一方,アンジオテンシンⅡはACE以外の酵素(キマーゼなど)によっても生成されるためACE阻害薬のみではアンジオテンシンⅡは完全には阻害されないことや,RAA系を長期に抑制すると他の経路よりアルドステロンが生成されること(アルドステロン・ブレイクスルー現象)が知られている.しかしながら慢性心不全に対する薬効は持続するのみならず,ARBがACE阻害薬を越える効果を有しないことからACE阻害薬には心不全に対してRAA系の抑制以外の効果があることが推察されている.
ACE阻害薬の慢性心不全に関する成人の主な大規模臨床試験としては,CONSENSUS試験による重症心不全に対する死亡抑制効果28),SOLVD治療試験やV-HeFT試験による軽~中等度心不全に対する心不全進行抑制効果29,30),SOLVD-予防試験やSAVE試験による心不全症状を伴わない左室機能低下に対する心不全発症や死亡の抑制効果などがある31,32).これらの結果はACE阻害薬が二次性心筋不全の進行に関わるRAA系を有効に抑制していることを示しているものと思われる.投与量に関する検討では,ATLAS試験による検討がなされており,心不全症例に対してリシノプリル高用量群の方が低用量群より予後改善効果があったと報告されている33).ただし,死亡率に有意差はなく,忍容性に問題がなければACE阻害薬を増量すべきだが低用量でも生命予後改善は期待できるとしている.さらにACE阻害薬は心保護効果のみならず,急性効果として前負荷・後負荷を下げ心拍出量を増加させるという血管拡張薬としての作用も強い34).ARBの心不全に関する成人の大規模臨床試験ではCHARM試験においてカンデサルタンの有用性が示されている.
小児の慢性心不全においても成人同様にRAA系が心筋リモデリングの進行に深く関わっており35),ACE阻害薬やARBによるRAA系の抑制は重要と考えられる.しかしながら大規模臨床試験はなく,小児で心不全を引き起こす下記病態でのACE阻害薬の症例報告にとどまる.ARBについての小児心不全に対する有効性の報告はないが,成人と同様にACE阻害薬に忍容性がない場合は考慮されるべき薬剤である.
- (1)拡張型心筋症に代表される心筋不全では小児においてもACE阻害薬により心不全症状の改善や心機能の改善を認めた報告がある36–38).
- (2)心室中隔欠損に代表される左右短絡性疾患による循環不全に対してのACE阻害薬は体重増加,心不全症状の改善を認めている38).
- (3)大動脈弁閉鎖不全,僧帽弁閉鎖不全に代表される左室容量負荷を伴う小児の心不全においてACE阻害薬は症状の改善および左室拡張末期径の縮小を認めており,有効と思われる39,40).
- (4)ファロー四徴症術後遠隔期の肺動脈弁閉鎖不全,三尖弁閉鎖不全に伴う右室容量負荷心でACE阻害薬により両心室機能の改善を認めた報告がある41,42).
ACE阻害薬やARBの投与は少量から開始し,血圧や腎機能に注意しながら漸増する.投与量は多いほど有効であるとされているが,成人に関して言えば多くのACE阻害薬は欧米で投与されている量は日本で使用されている量に比較して多い.例えば代表的なエナラプリルは日本では10 mg/日の投与量であるが欧米ではSOLVD治療試験の目標量20 mg/日,CONSENSUS試験の目標量20 mg/日,最大量40 mg/日を参考に20 mg/日が推奨されている.小児においては我が国では高血圧に関し承認されており,生後1ヶ月以上の小児に0.08 mg/kgを1日1回投与,年齢症状により適宜増減し成人用量を超えないこととなっている.一方米国では0.08~0.58 mg/kgを1日1回投与,最大用量40 mgと設定されている.心不全に関しては副作用に留意し可能な限り増量する事が予後の改善につながると考えられる.ACE阻害薬の副作用に咳,高カリウム血症,味覚異常,抗利尿ホルモン不適切分泌症候群43)などがある.催奇形性を有するため妊娠中の服用は禁忌である.
- Class I
- 心不全ステージB,Cで禁忌のない児に対するACE阻害薬使用.
- Class II
- 心不全ステージB,Cでも単心室の児に対してはACE阻害薬のルーチン使用は勧められないが,弁逆流・心室機能不全を有する場合には使用を考慮する.
- 体心室の収縮不全による心不全を有する児でRAA系遮断が有用と考えられるがACE阻害薬が使用できない児に対するARBの使用.
5. ベータ遮断薬
不全心においてはまず交感神経系の活性化・循環するカテコラミンの上昇で代償機転がはじまる.これは急性心不全における血圧の維持には有益である.しかしながらカテコラミン,特にノルエピネフリンの上昇は心筋の線維化,アポトーシスの促進,末梢血管の収縮,水およびナトリウム貯留を惹起し心不全の増悪を促進してしまう.ベータ遮断薬はこの悪循環を絶つことを目的に投薬される.
ベータ遮断薬は“心機能を落とす”薬剤であり心不全には禁忌であったが,Waagsteinらは拡張型心筋症患者にベータ遮断薬を投与することで心不全症状が改善し心機能が回復することを示した44,45).その後,US Carvedilol studyではカルベジロール46),CIBIS IIではビソプロロール47),MERIT-HFではメトプロロール48)の慢性心不全における予後改善効果が証明された.さらにCOPERNICUS試験ではNYHA IV度の重症心不全に対しても生命予後改善効果が示された49).
小児心不全161例を対象としてカルベジロールを投与したRCTが小児では最も大きな臨床試験であるがこの研究では臨床的改善度において有効性は認められていない50).しかしながらその理由として小児心不全の多様性が指摘されており,本臨床試験のサブ解析では”左室を主心室にする症例”に対しては有効で,これは他の小児拡張型心筋症を対象とした,より小さな臨床試験の結果と一致する51,52).このような背景から,小児においても左心室の収縮不全に起因する心不全に対してはエビデンスが十分ではないものの成人に準じてベータ遮断薬を用いた心保護療法が行われることが多い53).大規模臨床研究で成人に有効性が報告されている前述の三薬剤のうち,国内で成人の心不全に関して適応が認められているのはビソプロロールとカルベジロールである.メトプロロールとビソプロロールはβ1選択性が高く,カルベジロールはα,β1,β2受容体遮断作用と抗酸化作用を持つ.これらの薬剤はACE阻害薬と異なり,心筋リモデリングを抑制するだけでなく逆リモデリング,即ち左室リモデリングを逆行させ左室を小さくし,収縮性の改善をもたらすという特徴がある.この効果はACE阻害薬を併用した際により効果が大きいことが知られている54).
ベータ遮断薬は“心機能を低下させる薬剤”であるため,少量から開始し,漸増する55).投与初期は心機能が低下することが少なくないため,重症心不全では入院管理の上で導入する56).また導入時の心機能低下にはβ受容体を介さないPDE-III阻害薬の投与が有効である.ベータ遮断薬の投与量に関しては,少量でも有効であるという報告もあるが忍容性があれば投与量が多い方が有効であることが小児でも成人でも報告されている.しかしながら成人ではカルベジロールのAHAガイドライン推奨量50 mg/日に対して日本での投与量は5~20 mg/日と少なく設定されている.これは少量でも有効であるという日本での臨床研究57)に基づいて設定されているが,用量依存性に心不全入院・死亡率を減少させるという点はこの報告でも同様であった.その後に行われた日本人における投与量の検討では一定の結果をみていない.小児では成人に比較して血中濃度が上昇しにくいという報告もあり50),可能な限り増量が望ましいと考える.本ガイドラインの薬用量表に記載した用量は欧米での推奨量であり,日本国内ではメトプロロールは同程度の量が,カルベジロールはこの半量程度が投与されているものと推測される58).国内でも欧米と同量のカルベジロール投与で有効であったという報告もある56,59).ベータ遮断薬およびACE阻害薬の導入順に関してはCIBIS-IIIではベータ遮断薬とACE阻害薬はどちらを先に導入しても全死亡,全入院などに変わりがなかったものの低駆出率群ではベータ遮断薬先行群で成績が良かったとされている60).しかしながらベータ遮断薬は“心機能を低下させる薬剤”である一方でACE阻害薬は血行動態改善薬である一面も有している.重症心不全ではベータ遮断薬を安全に導入するために,ACE阻害薬を先に導入し心機能に余力を持たせた状態でベータ遮断薬を導入することも考慮されるべきであろう.Val-HeFT試験61)ではACE阻害薬,ベータ遮断薬投与患者にARB追加投与をすることで予後を悪化させる可能性が懸念されたが,CHARM-Added62)では3者併用で予後の改善が認められている.気管支喘息患児では原則禁忌であるが使用する場合はβ1選択性の高い薬剤を使用する.また心機能を落とすのみならず,心内伝導を抑制する薬剤であるので伝導障害を併発している際には注意が必要である.
- Class II
- 心不全ステージB,Cで体心室が左室形態の児に対するベータ遮断薬使用.
6. 硝酸薬
生体内でNOを生成し,グアニル酸シクラーゼの活性化を介して細胞内cGMPを増加させ,動脈および静脈を拡張させる.
ニトログリセリンは静脈の拡張作用が動脈の拡張作用に比べより強く,硝酸イソソルビド,ニトロプルシドは動静脈とも同等に拡張させる.静脈還流の減少から心臓への前負荷が減少し,心臓の仕事量が減り心筋の酸素需要が減少する.また冠動脈を含む比較的太い動脈を拡張し冠血管抵抗を減少させるとともに側副血行路も拡張するため冠動脈の血流量が増加し,心筋の酸素供給を増加する.硝酸薬を24時間以上持続して使用すると耐性を生じ,薬効が減弱する.8~12時間の休薬により耐性は消失する.
労作性狭心症,冠攣縮性狭心症の発作時および発作予防に,また開心術後などの急性心不全治療に用いられる.小児では左右短絡性先天性心疾患において肺体血流比を変えずに心室充満圧を低下させることが知られている63).貼付型の剤型は小児では血中濃度の上昇が良くないことが知られている.
PDE-V阻害薬との併用は細胞内cGMPの増大を招き硝酸薬の降圧効果が増強する可能性があることから,併用禁忌である.
- Class II
- 心筋虚血における,前負荷(静脈還流量)・後負荷の減少,冠血流の増加を目的とした硝酸薬の使用.
7. その他の血管拡張薬
(1)カルシウム拮抗薬
末梢血管を拡張し左室の後負荷を軽減することで血行動態を改善する.しかしながら成人における大規模臨床試験では予後の改善には結びつかなかった.アムロジピンやフェロジピンといった陰性変力作用のほとんどないカルシウム拮抗薬は心不全患者に使用しても少なくとも害はないと考えられる64)が,カルシウム拮抗薬には抗心不全薬としてACE阻害薬やベータ遮断薬のような予後改善作用は認められず,あくまで血行動態改善薬と考えられる.
一方,HCMにおけるベラパミルは左室拡張期の弛緩性を向上させ心内膜下の血流を改善し,臨床症状の改善をもたらすことが示唆されている65).小児においても有効性の報告があるが66),流出路の狭窄を増強させ突然死の原因となることもあり,投与には慎重を要する67).
- Class II
- カルシウム拮抗薬の心不全患者への使用.
- ベラパミルの肥大型心筋症患者への使用.
(2)ナトリウム利尿ペプチド製剤:カルペリチド(遺伝子組み換えhANP)
カルペリチドは血管平滑筋細胞内でカルシウム濃度を低下させ血管拡張作用を惹起する.また腎動脈拡張作用により腎血流を増加させ68),さらにNaや水の再吸収抑制による利尿効果68),心肥大の抑制,心筋線維化抑制効果,レニンやアルドステロンの合成抑制作用などの心筋保護作用も有しており,心不全において減負荷効果を発現する69).肺動脈楔入圧は低下し心拍出量は増加するが,心拍数は増加しない70).カテコラミンなどの強心薬と併用されることが多い.心不全における血行動態改善効果のほか,成人の慢性心不全における大規模臨床試験では死亡・心不全による再入院を有意に低下させることが報告されている71).投与初期に血圧低下があるため,低用量より開始する.
- Class II
- カルペリチドの難治性心不全におけるカテコラミンなどの強心薬との併用.
8. 利尿薬
うっ血は水・Na過多であるにもかかわらず循環血液量は減少することから,生体は交感神経系,RAA系,アルギニンバソプレッシン系などを亢進させ水・Naを保持するという悪循環に陥る.利尿薬はこのうっ血の解除を目的に投与され,心不全治療において中心的な役割を担っている薬物の一つである.特に即効性で強力なループ利尿薬であるフロセミドは急性心不全治療において欠かせない薬剤である.しかしフロセミドはあくまで血行動態を改善する薬剤であり生命予後を改善する薬剤ではないことから使用法に関しては注意が必要である.サイアザイド系利尿薬は心不全においてはループ利尿薬の効果を増強する目的で投与されることが多い.抗アルドステロン薬は収縮不全を基盤とした慢性心不全に対し予後改善効果が報告されている.バゾプレッシンV2受容体拮抗薬は水利尿を惹起する.
(1)ループ利尿薬
フロセミドに代表される臨床的にもっとも頻用される利尿薬である.近位尿細管から分泌されHenleの太い上行脚の尿細管腔側に存在するNa–K–2Cl共輸送体を阻害しNa再吸収を抑制することで強力な利尿作用を惹起する.副作用として低ナトリウム血症,低カリウム血症,低カルシウム血症,低マグネシウム血症といった電解質異常を引き起こしやすい.聴力障害にも注意が必要である.
フロセミドは最も強力な利尿薬で静注薬と内服薬が使用可能であるが,急性心不全では静脈内投与から開始し内服へ移行することが多い.蛋白結合率が高く,速やかに腎に到達することから即効性でかつ強力である.その結果,急激な体液量減少を引き起こすことから,体液量依存性に交感神経系およびRAA系を亢進させる.さらにNa–K–2Cl共輸送体は緻密斑におけるClイオンのセンサーでもあることから,尿細管糸球体フィードバックに影響することで体液量非依存性にもRAA系を亢進させ,水・Na貯留傾向となる.作用時間が短いことからこのリバウンドは大きい.腎機能低下があれば近位尿細管での分泌が低下するためより高用量が必要となる.
フロセミドは速やかにうっ血を解除する薬剤であるが上記の様に体液量依存性,非依存性に神経体液性因子を活性化する.そのため生命予後にあたえる影響について否定的な意見が多く,使用量が多いほど生命予後が悪いと報告されていた72).しかしながらDOSE研究では60日の経過観察期間ではあるが高用量群vs低用量群で予後に差を認めていない73).
フロセミド使用については適応症例を選んで速やかな投与によるうっ血解除と改善後の速やかな減量・中止が必要と考えられる.長期投与が必要であれはRAA系の亢進を防ぐため静注であれば持続静注あるいは分割静注.内服であれば分割投与あるいは半減期の長いトラセミド74),アゾセミド75)への変更が推奨される.トラセミドはRAA系抑制作用も有する74).RAA系抑制薬の投与や塩分制限も考慮が必要である.
(2)サイアザイド系利尿薬
遠位尿細管のNa–Cl共輸送体を阻害し,ナトリウム利尿を惹起する.ループ利尿薬は長期投与で遠位尿細管におけるNa再吸収が増加し利尿効果が減弱するため,サイアザイドを併用すると利尿効果を増大することができる.副作用としてはループ利尿薬と同様に電解質異常が問題となる.
(3)アルドステロン拮抗薬
アルドステロン受容体拮抗薬は集合管のミネラルコルチコイド受容体を阻害する.従来はループ利尿薬による低カリウム血症改善の目的で併用されていたが,今日では収縮不全の生命予後改善効果が報告され76,77),慢性心不全に対して積極的な投与が勧められている.日本ではスピロノラクトンとエプレレノンが使用可能である.鬱血性心不全に適応があるのは前者のみであるが,後者も慢性心不全における予後改善効果が報告されている77).副作用としては高K血症に注意が必要である.小児循環器領域で頻用されるスピロノラクトンはミネラルコルチコイド受容体のみならずアンドロゲン受容体,プロゲステロン受容体に対する親和性が高いため用量依存性に女性化乳房,乳房痛,月経異常などの内分泌系副作用が出現しやすい.エプレレノンはミネラルコルチコイド受容体に対する親和性が高いため上記のような副作用は少ない.
(4)バソプレッシンV2受容体拮抗薬
我が国ではバソプレッシンV2受容体拮抗薬であるトルバプタンが成人の心不全での適応が認められている.小児での報告も増加してきている78,79).本薬剤は集合管におけるV2受容体をブロックし,水の血管内への移動を抑制することで水利尿を促す.心不全においては有効循環血液量減少のため浸透圧とは無関係にバソプレッシンが分泌され低ナトリウム血症になりやすい.さらに上記の利尿薬の使用により低ナトリウム血症は増悪する.低ナトリウム血症は心不全患者において全死亡・心血管死亡と強い相関がある80,81).しかしながら,うっ血性心不全における低ナトリウム血症は水分過多が原因であり,多くの病態ではむしろナトリウムも過多であるためナトリウム投与は悪循環を促進する可能性がある.バソプレッシンV2受容体拮抗薬は水利尿を惹起し,低ナトリウム血症を改善する.高ナトリウム血症を引き起こす可能性があるため少量から開始し,特に投与開始時には頻回の血清電解質チェックが望ましい.肝機能障害の報告がある.Table 3は2013年秋に日本循環器学会・日本心不全学会から合同で発表された,“バソプレシンV2受容体拮抗薬の適正使用に関するステートメント”による注意点である.EVEREST試験82)では長期予後を改善しなかったがこの試験での低ナトリウム血症を呈した患者は8%に過ぎず,投与対象に問題があった可能性がある.最近の日本からのデータではresponderにおいて長期予後を改善しており,予後改善薬の面を有する可能性がある83).
- Class I
- 心機能低下による鬱血症状を呈する児(ステージC)に対する利尿薬の使用.
- Class II
- 体心室の収縮機能低下による心不全に対するアルドステロン受容体拮抗薬の使用.
Table 3 日本循環器学会・日本心不全学会による“バソプレッシンV2受容体拮抗薬の適せ使用に関するステートメント”によるトルバプタン使用の注意点| 1. 従来の利尿薬治療を先行させ,初期投与量は半量(7.5 mg)とする. |
2. 高ナトリウム血症を避けるために,- ・入院下で投与を開始・再開.
- ・血清ナトリウム測定を少なくとも,投与前,4~6時間後,8~12時間後,投与翌日から1週間程度は連日,それ以降継続する場合は適宜行い,過度の上昇が見られた場合は速やかに投与中止,必要に応じて補正.
- ・十分な利尿が認められた場合,飲水制限は原則的に緩和・解除.
- ・口渇を感じ,飲水できる患者に投与.
- ・高齢者・低体重では7.5 mgあるいは3.25 mgから投与.
|
| 3. 重篤な肝機能障害を示すことがあり,投与開始前から少なくとも2週間は頻回に肝機能検査を行う. |
| 4. 予後改善を示す薬剤ではないため,長期投与する場合には慎重な経過観察が必要. |
9. 肺血管拡張薬
肺血管拡張薬は肺細小動脈に作用し肺動脈圧や肺血管抵抗を下げる作用があり,肺動脈性肺高血圧症の治療に用いられる.この領域には有効な薬剤が少なかったが,近年さまざまな肺血管拡張薬が開発され,治療成績が向上してきた.現在ではプロスタグランジンI2誘導体,エンドセリン受容体拮抗薬,PDE-V阻害薬の作用機序が異なる3系統の薬剤が主流となっている.これらの薬剤は短期的な血管拡張作用のみならず長期的には肺血管の組織学的改善(リバース・リモデリング)にも期待がもたれている.「Ⅳ 主な循環動態の管理 10. 肺高血圧の管理」も参照のこと.
(1)経口プロスタグランジンI2誘導体:ベラプロスト
血管内皮細胞表面のプロスタグランジンI2受容体を介して平滑筋細胞内のcAMP濃度を上昇させ血管拡張作用を呈するとともに,血小板凝集抑制・血管平滑筋増殖抑制作用を有する.WHO機能分類クラス(WHO-FC)Ⅰ~Ⅱの軽症例が最もよい適応となる.わが国で開発され,off-labelの時期を含め10年以上の臨床実績がある.小児では忍容性も良好で使用しやすい.欧州での臨床試験では6分間歩行距離や自覚症状の有意な改善が認められた84).しかしその後の米国での臨床試験で投与後9ヶ月目以降は効果が持続せず85),最新の治療アルゴリズムから削除された.副作用として頭痛やほてり,消化器症状などがあるが,減量にて副作用は軽減することが多く,継続中止に至る症例は少ない.
(2)静注プロスタグランジンI2誘導体:エポプロステノール
ベラプロストと同様の機序で作用するが,急性肺血管反応性が乏しくても慢性効果が得られることが多い.その機序は十分解明されていない.適応はWHO-FC III~IV.半減期が3~5分と短いため持続静脈内投与が必要である.また溶解後のpHがアルカリ性で血管刺激性があるため長期投与の際は中心静脈カテーテル留置が不可欠となる.薬剤は室温や日光に不安定であるため,調製後は常にアイスパックで冷却状態を保ち,遮光する必要がある.低用量(1~2 ng/kg/分)から開始し,副作用や忍容性に注意しながら2~4週の間隔で1 ng/kg/分ずつ増量していく.一般に小児では成人に比べ増量に対する忍容性は良好である.増量の上限は定められていないが,開始後2,3年で安定維持量(20~30 ng/kg/分)に達することが多い86).小児特発性肺動脈性肺高血圧症に対する治療成績は成人例と遜色なく,生存率や血行動態を有意に改善させ,10年生存率は61%である87).副作用は頭痛,顔面紅潮,下痢が多いが,顎関節痛や足底部・踵の痛みなど本剤に特異的な症状もある.これらは用量依存性に増強するが,用量を固定すると軽減する傾向がある.留置カテーテルの脱落や自然抜去,皮下トンネル感染,菌血症,カテーテルの血栓性閉塞,カテーテルの損傷などに注意を要する.エポプロステノール注入が長時間中断した場合にはリバウンド現象による肺高血圧急性増悪の危険がある.したがってカテーテル閉塞が疑われた際には,速やかに末梢静脈路を確保して薬剤注入を再開する.
(3)エンドセリン受容体拮抗薬:ボセンタン,アンブリセンタン
エンドセリンファミリー(ET-1, 2, 3)の受容体にはETAとETBの2つがある.ETAは血管平滑筋に存在し,血管収縮・細胞増殖・細胞遊走などに関与,ETBは血管内皮細胞に存在し,NOやプロスタグランジンI2の産生を介してETAとは逆に血管拡張・細胞増殖抑制など保護的な作用を持つ.肺動脈性肺高血圧の病態ではETBが血管平滑筋にも発現し収縮過剰に関与している.そのためETA・B両受容体をブロックするボセンタンは肺動脈性肺高血圧治療薬として理にかなっている.適応はWHO-FC III~IVであるが,他の経口薬に反応不良なクラスⅡでも考慮される.小児を対象としたオープン試験で1年後の血行動態やWHO-FCを改善したが,重症例では1年以降はその効果を維持できなかった88).副作用として頭痛やほてり,ふらつき(浮遊感),筋痛などの他,7~11%に肝機能障害が出現するが小児では頻度が少なく,忍容性は良好である.投与前には必ず肝機能を確認し,開始後3ヶ月間は原則として2週間に1回,それ以降も月1回の肝機能検査が推奨され,基準値の3倍以上5倍未満では減量,8倍以上では中止するよう注意喚起されている.肝機能障害の出現時期は数日以内から3ヶ月以降と症例により差が大きく,増量の間隔も十分にあけたほうが無難である.肝機能障害のため一旦減量(中止)後に肝機能が改善して増量(再開)する場合は,より少ない量から十分な間隔を設けて小刻みに増量すべきである.ボセンタンはシルデナフィルの血中濃度を有意に下げることが報告され,両者を併用する際には薬剤相互作用の影響を考慮する89).
アンブリセンタンはETA受容体を選択的にブロックする経口薬剤で半減期が長い.我が国でも2010年に承認された.ボセンタンと比べ肝障害は少ないが,鼻閉塞感や体液貯留が報告されている.小児に関する安全性・有効性のデータは世界規模でも少ないが,成人と同等の薬物動態を示し血行動態や機能分類の改善が確認されている90).
(4)ホスホジエステラーゼ-Ⅴ阻害薬:シルデナフィル,タダラフィル
PDE-Vが存在する血管平滑筋においてNO-cGMPの代謝を減弱して血管拡張および血小板凝集抑制を増強させる.PDE-V阻害薬は肺血管に選択性が高い.適応はWHO-FC II~IVと軽症から重症例まで対象は幅広い.肺血管選択性が高く,換気血流不均衡を助長させないため,呼吸機能が低下した症例にも投与しやすい.NO吸入からの離脱を容易にさせる効果があり91),新生児や開心術周術期においても有用性が高い.更に肥大心ではPDE-Vの発現が亢進しており,心機能を改善させる効果も期待できる92).シルデナフィルの最高血中濃度到達時間が約50分と短く,急性負荷試験で効果の予測が可能である.小児を対象としたオープン試験では成人同等に血行動態や運動耐容能を改善させた.さらに無作為化比較試験も実施され,安全性と有効性が確認された93).副作用として頭痛やほてり,消化器症状,鼻出血があるが,多くは減量にて軽快する.羞明や色覚異常など眼に関する副作用(2%)があり,未熟児網膜症など眼科的合併症を持った小児への投与は控えたほうがよい.また,米国から報告された小児(1~17歳)対象の臨床第Ⅲ相試験において高用量投与群での死亡リスク増加が認められたため,長期投与では注意を要する94).
タダラフィルはPDE-Vに対する選択的阻害作用が強く,半減期が17時間と長い薬剤で2009年,我が国でも発売された.世界的にも小児での安全性・有効性の報告は少ないが,シルデナフィルと同等またはそれ以上の効果がある95,96).現在,小児肺動脈性高血圧を対象とした国際共同臨床試験が進捗中で我が国も参加している.
(5)カルシウム拮抗薬
欧米では急性血管反応性が良好な症例にはカルシウム拮抗薬が推奨されているが,我が国の実情は異なる.急性血管反応性陽性例は皆無に近く,実際にカルシウム拮抗薬のみで管理できる症例はほとんど経験されない.本薬剤の陰性変力作用を懸念し,我が国では代替としてベラプロストが投与される機会が多い.Sitbonらの検討では,特発性肺動脈性肺高血圧症で急性試験陽性を示したのは13%に過ぎず,カルシウム拮抗薬単独で1年後もWHO-FC I~IIを維持できた症例はわずか6.8%であった97).
(6)酸素
特発性肺動脈性肺高血圧症の小児で安静時は酸素化が保たれていても睡眠中に低酸素を呈する症例では夜間就寝中の酸素療法を検討する.また上気道感染罹患時は低酸素をきたす傾向があり,失神や緊急時に備えて携帯酸素ボンベの用意が望まれる98).
アイゼンメンジャー症候群では生存率や運動耐容能,QOLにおいて夜間の酸素療法の有益性は証明されておらず,一般的に酸素療法は推奨されない99).しかし重度の右心不全や高度の低酸素血症を呈する症例に症状軽減を目的とした酸素投与は有効である.
- Class I
- 肺動脈性肺高血圧に対するエポプロステノール,ボセンタン,アンブリセンタン,シルデナフィル,タダラフィルの投与.
- Class II
- 肺動脈性肺高血圧に対するベラプロスト,カルシウム拮抗薬,酸素の使用.
10. 動脈管を閉じる薬/開く薬
胎生期の動脈管は低い動脈酸素分圧と主に胎盤から供給されるプロスタグランジンEにより開存し,胎児循環に重要な役割を果たすが,生後は動脈酸素分圧の上昇と血中プロスタグランジンEの急激な減少により動脈管中膜平滑筋が収縮することで閉鎖する.従って,動脈管の開閉を制御するための薬剤はプロスタグランジンE(開存)と,その合成を阻害するシクロオキシゲナーゼ阻害薬(閉鎖)が中心となる.早産児では酸素に対する動脈管収縮性の低下および児のプロスタグランジン産生過多により,しばしば未熟児動脈管開存症を発症する.治療としてシクロオキシゲナーゼ阻害薬であるインドメタシンの静脈内投与法が行われる.一方,満期産の動脈管開存症はインドメタシンの効果は期待できず,薬物治療の適応はない.シクロオキシゲナーゼ阻害薬は消化管,腎,血小板などで恒常的に発現しているプロスタグランジン産生を抑制するため,壊死性腸炎や急性腎不全,頭蓋内出血などの副作用があり,このような副作用を認めた場合は直ちに使用を中止し外科的閉鎖術を考慮する.
生後に動脈管開存を維持する必要がある先天性心疾患(Table 4)にプロスタグランジンE1による動脈管拡張療法の適応がある.プロスタグランジンE1は肺通過時に容易に不活性化されるため,シトロデキストリンで包接して化学的に安定化させたプロスタグランジンE1-CD(一般名:アルプロスタジル アルファデスク注射用)が製剤化され動脈管拡張療法に適応がある.必要に応じて大量に使用できるため動脈管が狭小化した場合には有効であるが,無呼吸を生じることが多いため人工呼吸管理の準備が望ましい.また血圧低下にも留意する.投与中断により10~30分で作用がなくなるため静脈ライン閉塞に留意する.プロスタグランジンE1をリポ化した製剤(リポプロスタグランジンE1,アルプロスタジル)は肺での不活性化を防ぎ目標血管に集積する特徴があるためプロスタグランジンE1-CDの1/10量で動脈管の開存を維持可能で副作用が少ない.狭小化していない動脈管の開存維持に使用される.2~3日以上投与した場合は投与中止後も効果が2~3日持続するため,Blalock-Taussig手術などの際にはリポプロスタグランジンE1を中止しても自然閉鎖が遅れる場合がある.リポプロスタグランジンE1はヘパリンを含む他薬剤との併用で静脈ライン閉塞が起こることがあるため,単独ルートで使用することが望ましい.副作用として,無呼吸,血圧低下,長期使用による骨膜肥厚(使用中止後は改善する)がある.
- Class I
- 動脈管依存性先天性心疾患に対するプロスタグランジンE1製剤の使用.
- Class III
- 動脈管依存性先天性心疾患に対するシクロオキシゲナーゼ阻害薬の使用.
- 動脈管依存性先天性心疾患に対する高濃度酸素の使用(ただし蘇生を除く).
Table 4 動脈管依存性先天性心疾患| 1)肺循環依存型 | 肺動脈閉鎖兼正常心室中隔(純型肺動脈閉鎖) |
肺動脈閉鎖または高度狭窄を伴う下記心疾患- ファロー四徴症,単心室,三尖弁閉鎖,完全大血管転位,両大血管右室起始
|
| 機能的肺動脈閉鎖を伴うエプスタイン病 |
| 2)体循環依存型 | 単純型大動脈縮窄症 |
大動脈縮窄または大動脈弓離断を伴う下記心疾患- 心室中隔欠損症,単心室,三尖弁閉鎖,完全大血管転位,両大血管右室起始
|
| 左心低形成症候群 |
| 3)動静脈血混合型 | 完全大血管転位Ⅰ型 |
Ⅳ. 小児循環器科領域でよく見られる病的循環動態の薬物治療を中心とした管理
1. 拡張型心筋症など短絡のない左室心筋障害
遺伝子異常を基盤とする心筋構成蛋白の構造・機能異常やウイルス,自己免疫疾患による心筋の炎症などが引き金となり心筋の線維化,菲薄化がおこる.血行動態的には左室収縮性の低下に加えて左室容積の拡大,左室壁厚の菲薄化により左室壁応力が増大し,後負荷不整合がおこる.この過程には心筋組織のRAA系が深く関与している100).血圧低下など血行動態の破綻を呈している場合にはカテコラミン投与により状態の安定を図る.通常症状出現時には肺鬱血をきたしていることが多く,利尿剤持続静注,カルペリチド,PDE-III阻害薬により肺鬱血の軽減および後負荷軽減を図る.劇症型心筋炎などで治療抵抗性の低心拍出状態や致死的不整脈の場合はPCPSを積極的に導入する101–103).急性期心不全症状の改善が得られれば速やかに血行動態改善薬による治療から予後改善薬による治療へ移行する.すなわち,状態を観察しながらカテコラミンを可能なら減量,中止する.利尿薬は静注から経口へ移行し可能なら減量,中止する.予後改善薬であるACE阻害薬さらにはベータ遮断薬の導入を検討する.ARBやアルドステロン拮抗薬などについても成人においては有効とされている.これらの薬剤はいずれも降圧効果を有するため,急性期心不全から離脱しつつある状態での開始は循環動態を再度破綻させる可能性があり注意深い観察下に導入されるべきである.日本での小児におけるDCMに対する薬物治療については経験が少ない104–106).薬用量と注意点については各薬剤の項目を参照していただきたい.
経口強心薬として長年使用されてきたジゴキシンは成人の大規模試験(DIG試験)で予後を改善しないことが示されている.ピモベンダンはカルシウム感受性増強薬であるがPDE-III阻害作用も有し,成人では急性・慢性心不全治療およびベータ遮断薬導入の際に用いられる107).非薬物療法として心室同期不全に対する心臓再同期療法(CRT)や左室縮小手術,補助人工心臓植込術や心臓移植手術がある.
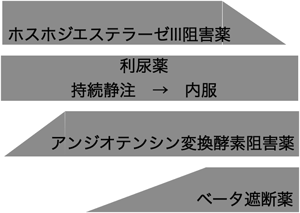
Fig. 4にDCMに対する予後改善薬導入の例をあげる.詳細は各薬剤の解説を参照していただきたい.要点は,
- (1)ベータ受容体を介さないで作用するPDE-III阻害薬で心機能をサポートする.
- (2)小児では重症化してから見つかることが少なくないため血行動態改善薬としての役割をも持つACE阻害薬をベータ遮断薬に先んじて導入することを考慮してもよい.
- (3)血圧が安定したら可及的速やかにACE阻害薬の導入を開始する.
- (4)利尿薬はRAA系の賦活化を防ぐため,当初は持続静注で使用し内服が可能となれば長時間作用型または短時間作用型であれば内服回数を多めにして投与する.可能な限り最少量にとどめる.
- Class I
- 小児拡張型心筋症に対するACE阻害薬の使用.
- 小児拡張型心筋症に対するベータ遮断薬の使用.
2. 肥大型心筋症
HCMにおける主たる病態は拡張不全,流出路狭窄,心筋虚血であり,これに不整脈を伴う.ベータ遮断薬,カルシウム拮抗薬,ACE阻害薬,ARBおよび抗不整脈薬としてⅠ群抗不整脈薬が治療薬剤となる.きわめて稀に小児期から拡張相HCMを呈する場合がある.症状および所見からみた治療チャートを図のごとく示す(Fig. 5).
(1)ベータ遮断薬
陰性変力作用により左室内圧較差を減少させ,陰性変時作用による心拍数低下,心筋酸素消費量減少などにより,左室流出路障害や拡張能および心筋虚血の改善が得られる.また,心筋虚血や交感神経活性亢進に伴う不整脈に対しても有効である.小児において,ベータ遮断薬の大量療法が生存率を改善させたとの報告がある108).ただし,無症状の患者に対する効果や心臓突然死の予防効果についての明確なエビデンスはない.
心機能を低下させる薬剤であり,鬱血性心不全の増悪をきたすことがあり注意が必要である.房室ブロックに代表される伝導障害を引き起こすこともある.気管支痙攣を増悪させることがあり,喘息患児への投与には注意する.特に乳児など低年齢の時では低血糖にも注意が必要である.
(2)カルシウム拮抗薬
ベラパミルは陰性変力作用,陰性変時作用および冠拡張作用を有し,拡張能および心筋虚血の改善や左室流出路障害に有効である.無症状の患者や,心臓突然死の予防効果についての明確なエビデンスはない.成人領域ではベータ遮断薬が効果不十分な左室拡張能の改善や流出路狭窄の改善にベラパミルが有効であったとの報告がある67,109).生後数ヶ月までの乳児には使用禁忌.ジルチアゼムにも拡張能や心筋虚血改善効果がある.一方,末梢血管拡張作用を有しており,狭窄前後の圧較差を助長することがあり,閉塞性肥大型心筋症(HOCM)には慎重に使用する.心不全・低血圧・徐脈性不整脈を引き起こす可能性があり,乳幼児では特に注意が必要である.
(3)ACE阻害薬,ARB
抗心筋線維化,抗心筋細胞肥大などに効果がある.一方,末梢血管を拡張するので左室流出路狭窄を有する場合には慎重に使用する.成人領域のメタ分析では冠動脈疾患・心不全の抑制においてACE阻害薬とARBとに差はなかったとの報告がある110).
(4)抗不整脈薬
ジソピラミドは抗不整脈作用の他に,強い陰性変力作用を有し左室流出路の圧較差を軽減する.シベンゾリンは弱いカルシウム受容体拮抗作用も有し,拡張能の改善が期待される.心房細動が出現した際には,ジソピラミドおよびシベンゾリンは共に心拍数を増加させるのでベータ遮断薬の併用が望ましい.臨床的または遺伝学的に突然死のリスクが高い症例の難治性の心房・心室性不整脈にはアミオダロンが有効である.ただし,小児でのエビデンスはない.なお,詳細については小児不整脈の診断・治療ガイドラインを参照のこと111).
- Class I
- 小児肥大型心筋症に対するベータ遮断薬の使用.
- 小児肥大型心筋症に対するカルシウム拮抗薬の使用.
- 左室流出路狭窄を有さない小児肥大型心筋症に対するACE阻害薬の使用.
3. 拘束型心筋症
小児では稀な疾患で,小児心筋症の2.5~5%を占めるに過ぎない112).心室のスティッフネスは増加し伸展性は低下することから心室拡張機能が障害されるが,収縮機能は保持されることが特徴的である.小児においてはほとんどが特発性RCMである.左室への流入障害から左房は拡大し左房圧は上昇する.その結果肺鬱血をきたし,さらには肺血管抵抗上昇もあいまって肺高血圧を呈する.進行すると心拍出量の低下から心不全に至る.成人では比較的緩徐な経過をたどるが,小児例では急激に心不全の増悪をきたすことが多く予後不良であり,心臓移植なしでは5年生存率は20%である113).若年齢,心不全例,左室駆出率低下例および左室壁肥厚例が予後不良と関係する113,114).また心房負荷に起因する心房細動をはじめとする上室性不整脈についても注意が必要である.左室流入をささえる心房機能が障害されるため急激な血行動態の悪化を呈することがある.
現在のところRCMに対する効果的な薬物療法はなく,対症療法に限られる.延命のためには心臓移植が必要となる.以下に補助的薬物療法を列記する.
- (1)抗血栓療法:小児RCMでは血栓症が生じやすいためワルファリンによる抗凝固療法が推奨される.
- (2)ベータ遮断薬:心拍数増多によるST低下などの虚血を呈する症例に適応となる.RCMでは心拍数増多により心拍出量を補っている症例もあり,使用にあたっては1回拍出量が減少する可能性があることから注意を要する.
- (3)ACE阻害薬:収縮機能低下を伴う場合は考慮すべき薬剤である.しかしながら,末梢血管拡張にみあうだけの心拍出増加が得られない場合には血圧低下をきたすことがあり,注意を要する.
- (4)利尿薬:肺鬱血および末梢浮腫が顕著な例に考慮する.前負荷軽減が心拍出量の低下につながる可能性があるため使用には注意を要する.
- (5)PDE-V阻害薬:成人DHFの肺高血圧(平均肺動脈圧>40 mmHg)症例44例に対するシルデナフィルのQOL改善効果が報告されている17).小児の報告はないが,肺高血圧を伴う拘束型心筋症では考慮すべき薬剤である.
RCMにて確実な延命効果が認められる唯一の治療は心移植である115).特に肺血管抵抗が上昇してくる症例については,無症状であっても早期から心移植治療を考慮する116).
4. 肺高血圧を伴う心室中隔欠損症
欠損孔が大きい心室中隔欠損では二つの心室が血行動態的に一つのポンプとして働くと考えられる(non restrictive).この結果右心室の血圧は左心室と同等となり肺高血圧を呈する.心室は体循環と肺循環の二つの出口を持ち,それぞれへの駆出量は体循環・肺循環の血管抵抗の比によって決定される.正常では肺血管抵抗が体血管抵抗より低くまた循環系の代償機転は体循環駆出量を維持するように働くため,肺血流量が正常より増加する(high flow pulmonary hypertension).生直後は比較的肺血管抵抗が高いため,肺血流の増加は軽度であるが肺血管抵抗の低下とともに肺血流は増加し,肺循環は高度の鬱血をきたし体循環は――特に新生児期・乳児期は――十分な代償性の肥大を起こせず低拍出に陥る.肺門部では拡大した肺動脈が気管を圧迫する.また末梢の気道は肺動脈と併走するため同様に肺動脈による圧迫が起こり末梢性の気道狭窄による症状(air trapping)も生じる.肺血流の増加は,肺コンプライアンスの低下をきたし,さらに左心系容量負荷による左室拡張末期圧を上昇させ肺鬱血を助長するため,重篤な呼吸器症状が出現する.
欠損孔が大きく肺高血圧を合併する場合には乳児期に手術治療が必要となる.ただし出生時に診断がついた場合でも自然閉鎖することが稀ではないため,肺血管抵抗低下による肺血流増加に伴う呼吸障害・循環障害の経過をみながら手術時期が決定される.この時期には前負荷軽減を目的として利尿薬が投与されるが前負荷不足は結果的に体循環量の低下を招く可能性があり注意する必要がある.従来,心筋の収縮力増強を目的にジギタリス製剤が投与されていた.しかしながら重篤な症例であるほどジギタリス製剤の投与により肺体血流比は増加することが知られており,現在では推奨できる治療ではない.カルシウム拮抗薬,ACE阻害薬が体血管抵抗を低下させ,肺体血流比を改善するという報告があるが,肺血管抵抗が相対的に高い症例ではむしろ肺体血流比が増加する可能性もあり注意が必要である.呼吸不全を呈した場合呼吸管理が必要となるが,酸素は肺血管抵抗を低下させ短絡血流を増加させるためバランスを十分考慮した上での使用が望ましい.吸入酸素濃度を低下させ肺体血流比を改善させる目的で窒素吸入が行われることがある.人工呼吸管理では肺血管抵抗を上昇させることを目的に血中二酸化炭素を高めに保持し平均気道内圧を高めに管理する方法もある.平均気道内圧を高めに保持することで静脈還流が低下し心不全を助長することがあり,特に十分量の利尿薬が投与されている場合などには注意が必要である.呼吸障害から哺乳が不足することがあり,栄養管理・水分管理は重要である.“飲ませてはいけない”病気ではなく“飲めなくなる”疾患であり,基本的に哺乳制限は避ける.
- Class I
- 高肺血流性肺高血圧を有する心室中隔欠損症に対する利尿薬の使用.
5. 心房中隔欠損症で注意を要する病態
心房中隔欠損は心房レベルでの左右短絡により,右心房・右心室・肺動脈・肺静脈に容量負荷をきたす疾患である.短絡量は欠損孔の大きさ・左右心房の血圧および左右心室の拡張能などに規定される.
新生児期にはまだ右心室の拡張性が良くないため左右短絡量は多くなく,啼泣時には右左短絡を呈することもある.成長に伴い右心室の拡張性が良くなり左右短絡が増加する.この短絡量が増加する時期には,生直後高めであった肺血管抵抗も低下するために肺血流量が増加しても肺動脈圧は上昇しない.
基本的に小児期には無症状であるがこれは右心室が容量負荷に対してはよく適応可能であるためである.しかしながら合併する病態によっては症状を呈することがある.
(1)肺血管抵抗が高い症例
ダウン症候群の合併例などで肺血管抵抗が高い場合には肺血流量増加に伴い肺動脈圧が高くなる場合がある.呼吸障害を呈する場合には早期の手術治療が必要となることがある.
(2)左上大静脈遺残
左上大静脈遺残合併例では拡大した冠静脈洞により心房中隔欠損を介した左右短絡が増加し,時に乳幼児期より肺高血圧を合併することがある.
(3)左心系の閉塞性疾患
僧帽弁狭窄や大動脈弁狭窄,あるいは大動脈縮窄(修復後であっても)を合併している場合には相対的に右室流入が亢進し,新生児期より短絡量が増える.その結果,肺血管抵抗がまだ十分に下がらない状態では肺高血圧を併発する.早期の手術が必要となることもある.
(4)Large Eustachian valve
健常児でも出生直後に大きなEustachian valveを認めることがある.心房中隔欠損例では下大静脈血がEustachian valveにより欠損孔を介して左心房に導かれチアノーゼを呈することがある.徐々に改善することが多い.
6. ファロー四徴症
チアノーゼ型先天性心疾患の代表である.発生的にはmonology(一徴症)すなわち漏斗部中隔の前方偏位により,(1)右室流出路障害(肺動脈狭窄),(2)malalignment typeの心室中隔欠損,(3)大動脈の心室中隔への騎乗,(4)右室肥大という四徴を呈する.右室流出路障害の程度はさまざまで,左右短絡優位でチアノーゼをほとんど呈さない(pink Fallot)症例から,高度の狭窄・閉鎖により動脈管もしくはMAPCAに肺血流を完全依存する症例まである.
本疾患は肺血流量の多少によりチアノーゼの程度,症状・兆候の発現時期および治療方針などが規定される.心血管構築異常は乳児期から幼児期の心内修復術(右室流出路再建と心室中隔欠損閉鎖)で改善されるが,治療方針からいくつかのタイプに分類できる.
- (1)肺循環が動脈管に依存する例は,プロスタグランジンE1製剤を持続投与することで動脈管経由の肺血流を確保し安定させたのち,Blalock-Taussig短絡手術により肺循環を確立する.プロスタグランジンE1製剤の副作用としての無呼吸に対しては人工呼吸管理も考慮する.
- (2)肺循環がMAPCAsに依存している症例に対してはMAPCAsに対してunifocalizationを考慮する.
- (3)右室流出路狭窄を有し,チアノーゼを呈する場合にはチアノーゼの程度によりBlalock-Taussig 短絡手術を施行した上で心内修復を行う症例,成長を待って一期的に心内修復を行える症例がある.患児の状態およびフォローアップの方法により方針が決定されるが,右室流出路狭窄の進行を念頭にいれ後述する低酸素発作に留意しながら経過観察をすることが重要である.
- (4)右室流出路狭窄が軽度で肺血流量の多いいわゆるpink Fallotに対しては心室中隔欠損症に準じた治療(貧血是正,利尿剤など)により心内修復術の準備をする.
- (5)まれに心室中隔欠損が狭小化し右室圧が左室圧を凌駕することがあるが,そのような場合には速やかに心内修復を予定する.
本疾患の乳児期には,特徴的な低酸素発作(hypoxic spell)が生じうる.啼泣などを契機に右室流出路からの肺血流が急激に減少し(この際収縮期雑音が小さくなる),チアノーゼ増悪,多呼吸・あえぎ呼吸,活動性低下,入眠・意識消失ときには痙攣・死にいたる発作であり,速やかな処置と予防を必要とする.低酸素発作時には膝胸位・酸素吸入およびモルヒネ皮下注などで鎮静を図る.さらに代謝性アシドーシスを是正するが,重症例には気管内挿管を躊躇しない.フェニレフリンにより体循環の末梢血管抵抗を上昇させることで心内の右左短絡の軽減・症状改善が得られることもある.低酸素発作の予防にはベータ遮断薬を投与する.貧血があれば鉄剤を開始する.外科治療を躊躇しないことが肝要である.
- Class I
- 動脈管依存性肺動脈血流のファロー四徴症におけるプロスタグランジンE1持続静注.
- 無酸素発作が懸念されるファロー四徴症における予防的ベータ遮断薬の使用.
- ファロー四徴症における無酸素発作時のベータ遮断薬・モルヒネ・フェニレフリンの使用.
7. 肺血流減少性疾患に対するBlalock-Taussig短絡手術後
体動脈肺動脈短絡手術は,ファロー四徴症をはじめとする肺血流減少型の先天性心疾患に対して一期的修復が困難な場合に肺血流を増加させ低酸素血症を軽減し肺血管床の発育を促す目的で行われる.最近では人工血管を使用し鎖骨下動脈から肺動脈に短絡するmodified Blalock-Taussig短絡手術が主流である.
日本胸部外科学会の2008~2010年の集計では死亡率は3.5%であった.肺動脈閉鎖兼正常心室中隔(純型肺動脈閉鎖)・単心室・低体重児(3 kg未満)がリスク因子であると報告されている117).Blalock-Taussig短絡手術後には,肺血流が過剰に増加したり,短絡血管の閉塞などで肺血流が不足してしまうことが生じうる.術後の肺血流増加は体心室への容量負荷をきたし急性心不全,房室弁逆流の増悪の可能性も考慮して管理にあたらなければならない.一方短絡血管の狭窄・閉塞は低酸素,突然死の要因となりうる118).
短絡量は短絡血管の状態だけでなく体血管抵抗と肺血管抵抗のバランスで決定されるため,とくに術後急性期にはさまざまな要因の影響を受けやすい.血圧・経皮酸素飽和度モニターおよび必要に応じて血液ガス分析による管理を要する.急性期は血圧を保ち良好な短絡血流を得るために,強心薬を投与することがある.短絡血流が過剰な場合は,肺鬱血の改善のために利尿薬や体血管抵抗を下げるために血管拡張薬の使用が考慮される.肺鬱血をきたしても体格が大きくなれば相対的な短絡量の減少が見込めるため,内科的な治療を行いながら体重増加を図り短絡量を至適な状態に調整することが多い.短絡量の多寡がコントロールできない心不全,低酸素を惹起する場合には速やかに再手術を考慮する.
血栓性閉塞の予防には低用量アスピリン(5 mg/kg,最大81 mgまたは100 mg分1)が使用される119).
- Class I
- 人工血管を用いた体動脈肺動脈短絡術後の低用量アスピリンの使用.
8. 高肺血流性疾患に対する肺動脈絞扼手術後
肺動脈絞扼術は肺血流増加により心不全あるいは肺高血圧進行のおそれがある疾患において,一期的な修復が困難な場合に行われる.一期的治療の進歩により単純な疾患では行われなくなってきたが,心室中隔欠損でも筋性部欠損など一期的な修復が有利でない場合には施行される.大動脈縮窄の合併では,大動脈弓の修復に加えて施行することが多い.また完全型房室中隔欠損では症例により肺動脈絞扼術を行うことも少なくない.三尖弁閉鎖症を含む単心室系疾患での肺血流増加の場合は,将来のFontan型手術を考慮し肺血管抵抗の上昇を防ぐ意味でも肺動脈絞扼術が適応になる120).
肺動脈絞扼術により肺血流増加による呼吸障害は改善し心臓に対する容量負荷は軽快するが,肺循環心室に圧負荷をかけ続けている状態であるということには留意が必要である.適切な肺血流の調節は難しく,死亡率は日本胸部外科学会の2008~2010年の集計によれば5.2%であり,慎重な管理を要する.
術後に生じうる血行動態上の問題としては①不十分な絞扼による心不全の持続,②過度な絞扼による低酸素血症,③肺循環心室の後負荷が高い状態が持続することによる心不全,④房室弁逆流の増悪,⑤大動脈弁下狭窄の進行などがある.絞扼が過度あるいは不十分であった場合には再手術が必要である.肺血流が過剰な場合は心不全治療を行い,体重増加を図ることで相対的な絞扼の増強を目指す.
成長に伴い相対的な絞扼増強により低酸素が進行するので適切な時期に次の手術を計画する.肺動脈弁下や大動脈弁下狭窄が進行することもある.絞扼が末梢側へ移動してしまうと,一側は肺血流増加による肺高血圧(通常の肺動脈では左),対側は高度な分岐部狭窄(通常の肺動脈では右)を生じるため注意深い経過観察が必要である.低酸素血症の進行は肺血管抵抗上昇による場合もあるので心臓超音波検査も含めた慎重な観察が望ましい.特に新生児期は肺血管抵抗などの変化により肺血流が変化をするので慎重な管理が必要である.
絞扼が適切であっても術直後にはカテコラミン・利尿薬などにより管理が必要であることが多い.
9. Fontan循環および両方向性Glenn手術後
(1)Fontan手術後の管理
Fontan手術とは二心室修復の不可能な症例に対する最終的な姑息手術であり,Fontan循環とは一つの機能的心室を体循環ポンプとして利用し,体静脈血をポンプとしての心室を介さずそのまま肺循環へ還流させる心肺直列循環の総称である.右心室を介さずに大静脈血を肺動脈に還流させることから右心バイパス手術とも言われる.Fontan循環において肺循環の駆動圧には,①心室拡張能,②横隔膜による胸腔内と頭部/腹腔の内圧差,③中心静脈圧が関与する.この循環の特性をよく理解して管理することが重要である.
術式の変遷があり長期予後の解釈は難しい121)が,周術期を乗り越えた後の生命予後は術後10年で概ね80%を超える121,122).加齢とともにさまざまな合併症を生じるが,薬物療法のエビデンスは多くない.
- 1)心室機能不全:通常の循環で左室収縮機能障害による慢性心不全に対する治療として有効性の証明されているRAA系阻害薬やベータ遮断薬の効果は立証されていない50).利尿薬などの対症的治療が主となる.近年の肺血管拡張薬の進歩から,肺血管抵抗を下げる治療が試みられている123).重症例では心移植が検討される124).
- 2)不整脈:上室性頻拍,徐脈性不整脈が多い.心房肺動脈吻合法で多いとされる.上室性不整脈は心房頻拍,心房内リエントリー性頻拍が多くカテーテルアブレーションは有効だが再発も多く薬物療法も重要である.徐脈性不整脈は特に多脾症合併例で多くペースメーカー植え込みが必要となることも少なくない.
- 3)血栓塞栓症:Fontan循環における血栓塞栓症の頻度は高く経年的に増加する125).原因として心房性不整脈・低心拍出・心室形態異常・人工物の使用・肝機能障害等が挙げられるが,Fontan循環そのものがProtein C欠乏等の凝固能異常を生じ,易血栓塞栓傾向を有するとする説もある.抗血小板療法・抗凝固療法を投与していない症例で血栓症が多いという報告はあるが122),その有効性については依然として結論が得られておらず,また日本人では出血性の合併症も少なくない.現実には年長児・成人例,不整脈を有する症例,血栓症の既往のある症例等で抗血小板療法・抗凝固療法が行われていることが多い.
- 4)低酸素血症:開窓のない大部分の症例で動脈血酸素飽和度は90%以上である.低値の場合には右左短絡(体静脈から左房・肺静脈へつながる側副血管)あるいは肺動静脈瘻の存在が疑われる.側副血管に対してはコイルによる塞栓術が有効なことがある.
- 5)蛋白漏出性胃腸症:Fontan循環における最重症の合併症の一つである.術後6.9年で4%の患者が発症するとされる.高い中心静脈圧や,感染(炎症)との関連が報告されているが発生機序は不明である.薬物療法としては高用量スピロノラクトン126),肺血管拡張薬,循環動態改善薬,抗炎症薬(ステロイドなど),ヘパリン,ソマトスタチン誘導体などの使用が報告されているが決め手となるものはない.
(2)両方向性Glenn手術後の管理
両方向性Glenn手術とは前述のFontan手術の前段階で行う姑息手術であり,上大静脈血流のみが肺動脈に還流される.合併症および管理方針は前述のFontan循環と原則同様であるが,下大静脈が心房に接続したままであるので開窓のないFontan循環より高度な低酸素血症を呈する(多くは酸素飽和度80%台).このため体肺短絡血管の発達が進行し,心室容量負荷が増大することがあり,鬱血性心不全や房室弁逆流の増悪に注意が必要である.上述の肺動静脈瘻をきたすことが少なくないため,低酸素が進行する場合には留意が必要である.低酸素血症の改善および肺血管抵抗軽減のため在宅酸素療法を用いる施設もある.
10. 肺高血圧
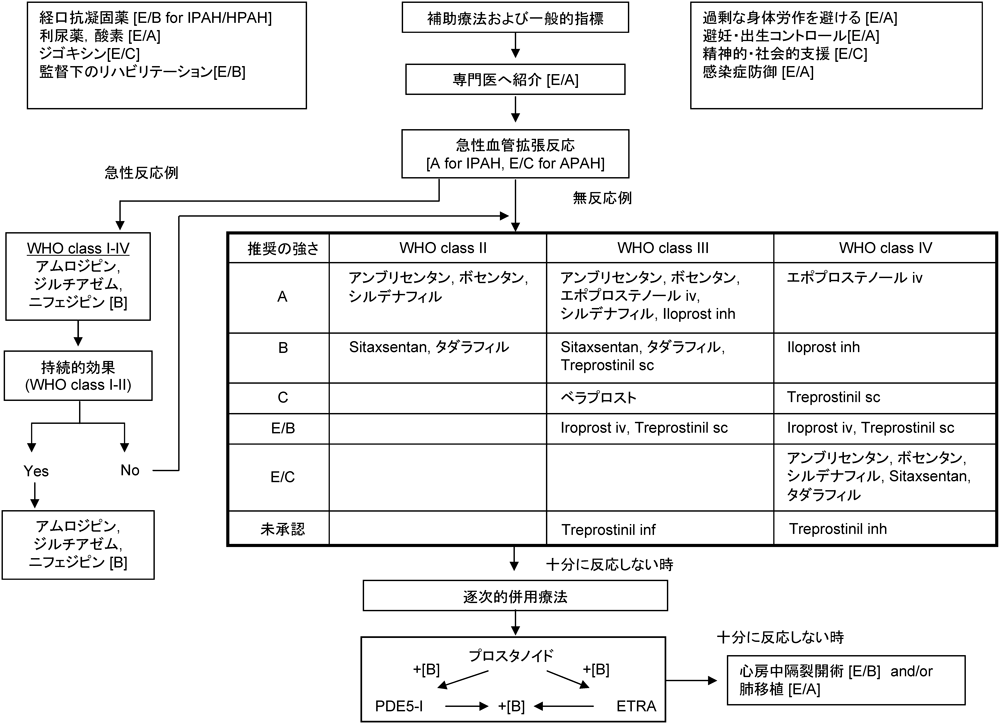
小児肺動脈性肺高血圧においては無作為化比較試験に基づいたエビデンスは少ないが,成人で提唱されている治療アルゴリズム(Fig. 6)127)を小児へ適用することは専門家の意見として許容されている.ここでは特発性/遺伝性肺動脈性肺高血圧および先天性心疾患に伴う肺動脈性肺高血圧について述べる.
(1)肺動脈性肺高血圧治療の実際
短期的な肺血管拡張作用のみならず長期的に肺血管のリバースリモデリングを得ること,肺循環と全身循環のバランスを考えた全身管理を目指す.治療の基本は,成人で推奨されている治療ガイドラインと同様,一般的な支持療法と,プロスタサイクリン,PDE-V阻害薬,エンドセリン受容体拮抗薬の3系統の肺血管拡張薬である.
欧米では急性血管反応性が良好な反応群ではカルシウム拮抗薬が推奨されているが,我が国では通常,軽症例には経口プロスタサイクリン誘導体べラプロストが選択される.WHO-FC別に,FC-IIではPDE-V阻害薬(シルデナフィル,タダラフィル)またはエンドセリン受容体拮抗薬(アンブリセンタン,ボセンタン)を単剤で,FC-IIIでは単剤または併用で開始し,3ヶ月程度の短期効果が不十分であれば追加治療を行う.FC-IIIから脱しない難治例はエポプロステノール持続静注療法を考慮する.右心不全ならびに左心還流血流低下が著しい重症例(FC-IV)では体血管拡張による心拍出量増加・右心への還流静脈血流増加に対する肺血管拡張反応が弱く,かえって肺動脈圧上昇や右心不全増悪をきたすことがあり,少量から開始し急速な増量は避けるべきである.またカテコラミン(ドブタミンやPDE-III阻害薬など)の併用が望まれ,体血圧低下や脈拍数増加,水分バランスにも留意する.
血漿hANP・BNP,6分間歩行テスト,心エコー,心臓カテーテル検査等による定期的な血行動態・心機能評価を行い,治療効果が不十分な症例では早めに治療内容を見直す.FC-III~IVの重症例では専門施設による治療開始と慎重な経過観察が求められる.エポプロステノールを含む最大限の内科治療に反応不良な症例では肺移植の適応があり,患者家族へのインフォームドコンセントと適切な時期での肺移植施設への照会を考慮すべきである.
(Classは肺血管拡張薬の項を参照)
(2)先天性心疾患に伴う肺動脈性肺高血圧の治療
適切な時期に心内修復術を実施すれば肺高血圧は可逆的である.しかし,手術適応のない症例や手術時期の遅れた症例に合併する肺高血圧,特にアイゼンメンジャー症候群に対しては,特発性肺動脈性肺高血圧症に準じた治療アルゴリズム(Fig. 7)が適用される128).アイゼンメンジャー症候群では増悪危険因子に留意した日常生活上の指導も重要である(12. アイゼンメンジャー症候群の管理を参照).
特異的薬物療法では,ボセンタン,シルデナフィル/タダラフィル,エポプロステノール持続静注が肺血行動態,心機能分類,6分間歩行距離や運動耐容能の改善に有効である129–132).他の内科的治療では在宅酸素療法,経口抗凝固薬,利尿薬,抗心不全療法,瀉血などが検討される.内科治療に反応しない症例には肺および心肺移植が治療選択肢の一つとなる.先天性心疾患に伴う肺動脈性肺高血圧に関する推奨事項(ESC/ERSガイドライン)をTable 5に示す.
Table 5 先天性心疾患に伴う肺動脈性肺高血圧に関する推奨事項(文献128より引用改変)| 推奨事項 | 推奨度 | エビデンスレベル |
|---|
| WHO-FC IIIのESはERAボセンタンの適応となる | I | B |
| ESの他のERA,PDE-V阻害薬およびプロスタノイドも検討すべき | IIa | C |
| 有意な喀血がなければ,肺動脈血栓や心不全徴候が認められる症例には経口抗凝固療法を検討すべき | IIa | C |
| 酸素投与で動脈血酸素飽和度の持続的な上昇と症状軽減が得られる場合には,酸素療法を検討すべき | IIa | C |
| 過粘稠度の症状が認められる場合,ヘマトクリット>65%で等容置換による瀉血を検討すべき | IIa | C |
| ESに併用療法を検討してもより | IIb | C |
| ESにCCBの使用は勧められない | III | C |
| CCB,カルシウム拮抗薬;ERA,エンドセリン受容体拮抗薬;ES,アイゼンメンジャー症候群;PDE,ホスホジエステラーゼ |
近年,肺血管抵抗が中等度上昇した手術適応境界例の先天性心疾患症例に対して肺血管拡張薬を併用して手術適応を拡大する試みの報告が増えているが,現時点では症例選択,治療期間など検討課題は多く,治療効果判定には長期的視点に立って検討すべきである133).
11. ファロー四徴症術後
心臓外科手術の進歩によりファロー四徴症の術後遠隔期の予後は改善し,我が国では術後25年生存率95%と欧米諸国と比べても良好である134).しかしながら成人期には遺残病変や続発病変により心不全や不整脈を発症し,介入を余儀なくされることが少なくない.また不整脈による突然死は重大な問題である134–136).よって術後遠隔期においても十分な管理が必要であり,以下に諸問題を概説する137,138)が,複数の病態が混在することが多く,またそれぞれの病態が他の病態の進行を招く.
(1)肺動脈弁閉鎖不全
時に三尖弁閉鎖不全とあいまって右室容量負荷となる.進行すると右心機能低下を惹起し右心不全症状を呈する.右室心筋が不可逆的な変化をきたす前に肺動脈弁置換術および三尖弁形成術を行う必要がある.MRIによる右室容積の計測にて,右室拡張末期容積係数>160 mL/m2,右室収縮末期容積係数>82 mL/m2を超えないように肺動脈弁置換術を行うのが望ましいという報告があるが139),手術介入の適応は現在のところ各施設でさまざまである.最近欧米では肺動脈弁閉鎖不全に対し,弁付きステントによる経皮的肺動脈弁形成術が行われ,良好な中期成績が報告されている140).薬物治療としては鬱血症状に対して対症療法として利尿薬が使用される.心不全に対してRAA系抑制薬を使用する施設もある42)が明確なエビデンスはないのが現状である.
(2)右室流出路系狭窄(右室流出路,肺動脈弁,肺動脈狭窄)
右室流出路系の狭窄は右室に対する圧負荷となる.また一側の肺動脈狭窄は肺血流分布の不均等を引き起こす.心エコー検査で右室–肺動脈間に50 mmHg以上の収縮期圧較差が推定される場合,右室圧/左室圧比が0.7を超える場合,進行性の高度の右室拡大もしくは右心機能異常を伴う場合は外科的治療が考慮される.
(3)心室中隔欠損症の遺残短絡
肺体血流比が1.5を超えるような遺残短絡は再手術が考慮されるがその時期に関しては他の遺残病変・続発病変も考慮することが重要である.右室流出路狭窄が高度であれば肺体血流比の評価にも注意が必要である.
(4)左心系の異常
右室容量負荷に伴い左心収縮機能低下をきたすことがあり,再手術時期の決定因子の一つとするべきである.大動脈基部拡大,大動脈閉鎖不全を呈することがあり経時的な観察が必要である.
(5)不整脈
心房粗細動,心室頻拍をきたし,失神,突然死に至る場合もある.抗不整脈薬の投与,カテーテルアブレーションが行われるが失神の既往があり突然死が危惧される症例では,植込み型除細動器の装着も考慮される.
(6)感染性心内膜炎
このリスクは生涯継続し特に人工導管を用いたRastelli型の修復を行った場合には頻度が高く,厳格な患者教育が必要である.
12. アイゼンメンジャー症候群
近年,肺血管拡張薬の使用によりアイゼンメンジャー症候群の予後改善効果が見込めるようになってきた141,142).しかしながら肺血管抵抗が上昇しチアノーゼを認めるがまだ肺血流は多いという時期にはむしろ肺鬱血を助長する可能性もあり,厳密な血行動態の把握が必要である.アイゼンメンジャー症候群に生じるさまざまな合併症は低酸素血症と多血症によって生じる.ヘマトクリットが65%を超え過粘稠度症候群を併発した場合には瀉血が考慮されるが,単なる瀉血は小球性低色素性貧血を惹起し過粘稠度症候群を増悪させる可能性があり,十分な鉄の補給が必要である.鉄の補給にあたっては 経口投与が望ましい.鉄剤の投与により非酸素結合ヘモグロビンの絶対量は増加することから,“見た目”のチアノーゼは増悪する可能性のあることはあらかじめ説明しておくことが望ましい.血液の粘稠度が増加していても基盤に血小板減少・機能低下および凝固因子の減少を抱えているため脳梗塞予防のための抗血小板薬・抗凝固薬の投与は行わないが,心房細動を併発した場合などケースバイケースの対応を求められることが少なくない.腎機能低下(GFRの低下)を合併することがあり薬剤投与(造影剤を含む)の際には注意が必要である.チアノーゼ性腎症にはアンジオテンシン変換酵素阻害薬の有効性が報告されているが,体血管拡張によりチアノーゼを増悪させることがあるため投与にあたっては十分な注意が必要である.高尿酸血症をきたすことが多いが,痛風性関節炎はチアノーゼ性心疾患を基盤にしない高尿酸血症に比較し頻度が低いため無症状の高尿酸血症に対しては原則的には治療は不要である.
- Class I
- 小球性低色素性赤血球を呈するアイゼンメンジャー症候群に対する鉄剤の投与.
- Class II
- アイゼンメンジャー症候群に対する肺血管拡張薬の投与.
本ガイドラインは日本小児循環器学会が作成する小児心不全薬物治療ガイドラインの第二版である.第一版では心臓の収縮障害による心不全と心血管構築異常に由来する心不全/循環不全を明確に区別しようというメッセージが基盤になっていた.今回の第二版ではいわゆる慢性心不全と急性心不全の治療方針を区別しようというメッセージが込められている.そのためにあえて誤解を恐れず,“血行動態改善薬”と“予後改善薬”という名称を採用した.もちろん血行動態改善薬は予後を改善しないわけではなく,“適切に”使用すれば予後改善に寄与する薬剤であることは論を待たない.血行動態改善薬の使用にあたっては血行動態の評価が必要である.ISHLTの小児心不全ガイドラインでも検査に関して多くのページが割かれている.本ガイドラインではstress-velocity indexを紹介している程度であるが,次の版では心機能評価について記載する必要があるかもしれない.他のガイドラインとの調整が必要になるであろう.また予後改善薬の小児における効果に関するデータは非常に乏しい.ISHLTのガイドラインでは各薬剤について“成人では/小児では”という形式で構成されているが,今後エビデンス,特に日本人でのエビデンスが蓄積され“logically evidenced”ということばが本ガイドラインから消えることを祈りながら稿を終える.
略語Abbreviations
| ACC | American College of Cardiology(米国心臓病学会) |
|---|
| ACE | angiotensin converting enzyme(アンジオテンシン変換酵素) |
|---|
| AHA | American Heart Association(米国心臓協会) |
|---|
| ARB | angiotensin receptor blocker(アンジオテンシン受容体拮抗薬) |
|---|
| ATP | adenosine triphosphate(アデノシン三リン酸) |
|---|
| cAMP | cyclic adenosine monophosphate(環状アデノシン一リン酸) |
|---|
| cGMP | cyclic guanosine monophosphate(環状グアノシン一リン酸) |
|---|
| CRT | cardiac resynchronization therapy(心臓再同期療法) |
|---|
| DCM | dilated cardiomyopathy(拡張型心筋症) |
|---|
| DHF | diastolic heart failure(拡張不全) |
|---|
| EBM | evidence-based medicine(科学的根拠に基づく医療) |
|---|
| ET | endothelin(エンドセリン) |
|---|
| GFR | glomerular filtration rate(糸球体濾過率) |
|---|
| HCM | hypertrophic cardiomyopathy(肥大型心筋症) |
|---|
| ISHLT | International Society for Heart and Lung Transplantation(国際心肺移植学会) |
|---|
| MAPCA | major aortopulmonary collateral arteries(主要体肺動脈側副血行路) |
|---|
| NO | nitric oxide(一酸化窒素) |
|---|
| NYHA | New York Heart Association(ニューヨーク心臓協会) |
|---|
| PCPS | percutaneous cardiopulmonary support(経皮的心肺補助) |
|---|
| PDE | phosphodiesterase(ホスホジエステラーゼ) |
|---|
| QOL | quality of life(生活の質,クオリティ・オブ・ライフ) |
|---|
| RAA | renin-angiotensin-aldosterone(レニン・アンジオテンシン・アルドステロン) |
|---|
| RCM | restrictive cardiomyopathy(拘束型心筋症) |
|---|
| RCT | randomized control trial(無作為対照試験) |
|---|
付 主な心不全治療薬の小児薬用量
本ガイドラインではさまざまな薬剤についてその使用法・使用量を記載している.小児循環器領域の実臨床で使用されている薬ばかりではあるが,小児科医であれば誰しも知っての通り必ずしも国内で小児に認可されている薬剤ではない.投与量に関しては各パートに記載されている引用文献および日本医薬品集,教科書(臨床発達心臓病学,MOSS AND ADAMS' Heart Disease in Infants,Children, and Adolescentsなど),他のガイドライン(日本循環器学会 小児期心疾患における薬物療法ガイドラインなど)を参考に実臨床現場の状況にのっとり記載した.小児での投与経験に乏しい薬剤に関しては成人投与量を参考に小児の特性を考慮の上,治療量を決定するのが望ましい.
本ガイドラインでは薬剤を血行動態改善薬と予後改善薬の二つに分類した.血行動態改善薬は目標が血行動態の改善であり量の設定は血行動態をモニターしながら有害事象に留意して設定する.しかしながら予後改善薬は効果をその場でみることができないため量の設定が困難である.予後改善薬の代表であるACE阻害薬およびベータ遮断薬は成人では量が多いほど有効であるとされている薬剤であるが,国内で認可されている成人量は欧米でのそれと比較して少ないものが殆どである.そこで本ガイドラインではこれらの薬剤の最大量に関しては基本的に欧米のデータを参考に記載することとした.この量を使用するにあたっては,ガイドライン本文を参考にしながら少量から開始し,注意深い観察の上での増量が必要であると考える.各施設での状況にのっとって投与量を決定していただきたい.
主な心不全治療薬の小児薬用量 | 薬剤(一般名) | 薬剤(商品名) | 適応 | 禁忌・慎重投与 | 特徴的な有害反応 | 一般的な用法用量 | コメント | 成人量 |
|---|
| 1. カテコラミン | ドブタミン | ドブトレックス | 急性循環不全 | 閉塞性肥大型心筋症 | 不整脈 | 1~20 µg/kg/分 | 使用量で作用が異なる(本文参照) | |
| ドパミン | イノバン | 1~20 µg/kg/分 | |
| ノルアドレナリン | ノルアドレナリン | ショック・低血圧 | 高血圧 | 不整脈・高度の血管収縮 | 0.05~1.0(−2.0)µg/kg/分 | 敗血症性ショックでは単独投与 | |
| アドレナリン | ボスミン | ショック・低血圧・心停止 | 不整脈・高血圧 | 0.05~1.0(−2.0)µg/kg/分,蘇生時0.01 mg/kg静注 | | |
| イソプレテレノール | プロタノール | 徐脈性不整脈 | | 不整脈 | 0.01~1.0 µg/kg/分 | | |
| 2. PDE-III阻害薬 | ミルリノン | ミルリーラ | 急性心不全 | 閉塞性肥大型心筋症.頻脈性不整脈,腎機能障害,低血圧の際は慎重投与. | 不整脈,低血圧 | 0.25~0.75 µg/kg/分 | 持続静注前に50 µg/kgを10分かけて投与しても良い.腎不全時は投与量を減量する. | |
| オルプリノン | コアテック | 閉塞性肥大型心筋症,妊婦または妊娠している可能性のある婦人.頻脈性不整脈,冠動脈疾患,腎機能障害,低血圧の際は慎重投与. | 0.1~0.3(0.4)µg/kg/分 | 持続静注前に10 µg/kgを5分かけて投与しても良い.腎不全時は投与量を減量する. | |
| 3. 経口強心薬 | ジギタリス製剤 | ジゴキシン | うっ血性心不全 | 徐脈性不整脈,閉塞性肥大型心筋症 | 房室伝導障害による徐脈性不整脈,心室性不整脈,消化器症状 | 経口飽和量 新生児0.03~004 mg/kg/日,乳児0.04~0.06 mg/kg/日,幼小児0.03~0.05 mg/kg/日.急速飽和の際はまず経口飽和量の1/2量を投与し,12時間後以降に経口飽和量の1/4量を1日の維持量として分2で投与する. | 近年,心不全に対して急速飽和はあまり行われず,最初から維持量が投与されることが多い. | 維持量0.25~0.5 mg/日.急速飽和では初回0.5~1.0 mg, 以後0.5 mgを6~8時間毎に効果が出るまで(飽和量1~4 mg) |
| ピモペンダン | アカルディ | 急性心不全,慢性心不全 | 肥大型閉塞性心筋症,弁狭窄,重篤な不整脈 | 不整脈 | 小児投与量の参考となるデータに乏しい.成人2.5 mg/回 1日1~2回 | | 2.5 mg/回 1日1~2回 |
| デノパミン | カルグート | 慢性心不全 | 肥大型閉塞性心筋症,重篤な不整脈 | 1~1.5(3)mg/kg/日 分3, 成人量を超えない | | 15~30 mg/日 分3 |
| ドカルパミン | タナドーパ | ドパミン・ドブタミン持続静注からの離脱困難 | 肥大型閉塞性心筋症,褐色細胞腫 | 小児投与量の参考となるデータに乏しい.成人2250 mg/日 分3 | | 2250 mg/日 分3 |
| 4. アンジオテンシン変換酵素阻害薬・アンジオテンシン受容体拮抗薬 | カプトプリル | カプトリル | (高血圧) | 腎機能障害,腎血管障害,大動脈縮窄症,左室流出路狭窄,左室流入路狭窄,妊婦または妊娠している可能性のある婦人 | 低血圧(特に初回投与時),腎機能障害,乾性咳嗽,血管浮腫 | 0.1~0.5 mg/kg/回 1日3回(最大4~6 mg/kg/日分3)成人量(37.5~75 mg/日 分3, 最大量150 mg/日)を超えない | ACE阻害薬.カリウム保持性利尿薬と併用する場合は高カリウム血症に注意する.血圧と腎機能に注意して使用する. | 12.5 mg~25 mg/回 1日3回(最大150 mg/日) |
| エナラプリル | レニベース | 慢性心不全,高血圧 | 低血圧(特に初回投与時),腎機能障害,乾性咳嗽,抗利尿ホルモン不適切分泌症候群,血管浮腫 | 0.1~0.4 mg/kg/日分1~2 成人量(2.5~5 mg/日,10~40 mg/日まで増量)を超えない | 日本では5~10 mg/回 1日1回が認可されている |
| リシノプリル | ゼストリル,ロンゲス | 0.08 mg/kg/日 1日1回 最大40 mg | 5~10 mg/回 1日1回 |
| シラザプリル | インヒベース | (高血圧) | 0.005~0.03 mg/kg/回 1日2回 | 高血圧症に対して最大2 mg/日 |
| ロサルタン | ニューロタン | 低血圧(特に初回投与時),腎機能障害 | 0.5 mg/kg 1日1回内服,2 mg/kg 1日1回まで増量可 | アンジオテンシンⅡ受容体拮抗薬.ACE阻害薬と同様の薬効であるが,ACE阻害薬に特徴的な乾性咳嗽を認めない.腎機能障害,肝機能障害を認める場合は投与量を減量する.血圧と腎機能に注意して使用する. | 25~50 mg/回 1日1回,100 mg/日まで増量可能 |
| カンデサルタン | ブロプレス | 慢性心不全,高血圧 | 1歳以上6歳未満の小児に対し0.05~0.4 mg/kgを1日1回.6歳以上の小児に対し2~8 mgを1日1回. | 4 mg/回 1日1回,8 mg/日まで増量可能(高血圧では12 mgまで増量可能) |
| 5. ベータ遮断薬 | カルベジロール | アーチスト | 慢性心不全 | 気管支喘息,高度の徐脈性不整脈,ショック,妊婦または妊娠している可能性のある婦人 | 高度な徐脈性不整脈,ショック,心不全,低血圧 | 0.05 mg/kg/回 1日2回から開始し0.1~0.4(0.5)mg/kg/回1日2回までゆっくり増量.成人の最大量を超えないのが原則であるが,欧米での成人目標量は25~50 mg/回 1日2回である. | | 日本では10 mg/回 1日2回が認可されている |
| ビソプロロール | メインテート | 高度の徐脈性不整脈,ショック,妊婦または妊娠している可能性のある婦人 | 小児心不全に対する投与量の参考となるデータに乏しい.抗不整脈薬としての投与量は0.08~0.1 mg/kg/回 1日1回. | | 日本では1.25~5 mg/回 1日1回が認可されている |
| メトプロロール | セロケン | (高血圧・狭心症・頻脈性不整脈) | 気管支喘息,高度の徐脈性不整脈,ショック,妊婦または妊娠している可能性のある婦人 | 0.5~1 mg/kg/回 1日2回 | | 日本では高血圧・狭心症・頻脈性不整脈に対して60~120 mg/日(分2~3)が認可されている |
| 6. 硝酸薬 | ニトログリセリン | ニトログリセリン(0.3 mg/錠),ニトロペン(0.3 mg/錠),バソレーター(注・貼付剤27 mg/枚),ミリスロール(注),ミオコール(注),ニトロダーム-TTS(貼付剤25 mg/枚),ミニトロ(貼付剤27 mg/枚),ミリステープ(貼付剤5 mg/枚) | (錠:狭心症,心筋梗塞),注・貼付剤;急性心不全,狭心症 | 重篤な低血圧,心源性ショック,頭部外傷・脳出血,閉塞隅角緑内障,高度貧血,PDE5阻害薬との併用 | 低血圧,頭痛 | 舌下:体格に合わせ1/2~1/3錠,テープ:体格に合わせて1/4~1枚/回(1~2回/日),持続静注:1.0~20 µg/kg/分 | 耐薬性を生じ作用減弱あり(休薬により耐薬性は軽減) | 舌下:1~2錠(0.3 mg~0.6 mg),貼付:1日1回1枚(2枚まで増量可),ミリステープは1回1枚1日2回,注:(急性心不全)0.05~0.1 µg/kg/分で開始,0.1~0.2 µg/kg/分づつ増量 |
| 硝酸イソソルビド | ニトロール(5 mg/錠・注),サークレス(注),フランドル(20 mg/錠・貼付剤40 mg/枚),アンタップR(貼付剤40 mg/枚) | (狭心症,心筋梗塞) | 舌下:体格に合わせ1/2~1/3錠1, テープ:体格に合わせて1/4~1枚/回(1~2回/日) | 舌下または内服:1回1~2錠を1日3~4回,貼付:1回1枚を24時間または48時間毎に交換 |
| ニトロプルシド | ニトプロ(注) | (手術時の低血圧維持,手術時の異常高血圧の救急処置) | 脳の高度循環障害,甲状腺機能不全,重篤な肝・腎機能障害,高度貧血,PDE5阻害薬との併用 | 低血圧,頭痛,シアン中毒(96時間以上の投与,4.0 µg/kg/分以上は注意) | 持続静注:0.5~4.0 µg/kg/分 | | 0.5~3.0 µg/kg/分 |
| 7. その他の血管拡張薬 | 塩酸ベラパミル | ワソラン(40 mg/錠・注) | (小児の頻脈性不整脈) | 錠:重篤なうっ血性心不全,Ⅱ度以上の房室ブロック,洞房ブロック,妊婦,注:重篤な低血圧あるいは心源性ショック,高度除脈,Ⅱ度以上の房室ブロック,洞房ブロック,ベータ遮断薬静注中の患者.妊婦 | 新生児及び乳児はカルシウム拮抗薬の感受性が高いため,徐脈,心停止等を生じる危険性が大きい.新生児及び乳児に本剤を投与した際,重篤な徐脈や低血圧,心停止等が認められたとの報告がある. | 錠:1日3~6 mg/kg(ただし1日240 mgを超えない)を1日3回に分けて経口投与,注:1回0.1~0.2 mg/kg(ただし1回5 mgを超えない)を希釈し5分以上かけて緩徐に静注 | 左室流出路狭窄のある症例では低血圧に注意 | 錠:1回40~80 mgを1日3回,注:1回5 mgを5分以上かけて緩徐に静注 |
| カルペリチド | ハンプ | 急性心不全(慢性心不全の急性増悪を含む) | 重篤な低血圧,心源性ショック,右室梗塞,脱水症状 | 血圧低下,電解質異常,除脈,心室頻拍 | 0.025~0.05 µg/kg/分より開始,0.1 µg/kg/分にて継続(最大0.2 µg/kg/分まで増量可) | 投与初期の血圧低下に注意 | 0.1 µg/kg/分を持続静注,0.2 µg/kg/分まで増量可 |
| 8. 利尿薬 | フロセミド | ラシックス | 高血圧 心性浮腫(うっ血性心不全) | 重篤な電解質異常 | 電解質異常 | 内服:0.5~4 mg/kg/日 分1~4内服, 静注:1~2 mg/kg静注, 持続静注:0.05~0.1 mg/kg/時で開始し0.3 mg/kg/時まで増量可能 | | 内服:40~80 mg/日 1日1回,静注:20 mg 1日1回 |
| アゾセミド | ダイアート | うっ血性心不全,浮腫 | 小児心不全に対する投与量の参考となるデータに乏しい.成人ではアゾセミド30 mgがフロセミド20 mgに換算される. | | 60 mg/日 1日1回 |
| トラセミド | ルプラック | 浮腫 | 小児心不全に対する投与量の参考となるデータに乏しい.成人ではトラセミド4 mgがフロセミド20 mgに換算される. | | 4~8 mg/日 1日1回 |
| ヒドロクロロチアジド | ニュートライド | うっ血性心不全,浮腫,高血圧 | 急性腎不全,重篤な電解質異常,高尿酸血症,高血糖 | 2~3.5 mg/kg/日 分2 | | 25~100 mg/回 1日1~2回 |
| トリクロルメチアジド | フルイトラン | 0.05~1.6 mg/kg/日 分1~2 | | 2~8 mg/日 分1~2 |
| スピロノラクトン | アルダクトンA | 急性腎不全,電解質異常 アジソン病 | 電解質異常,女性化乳房 | 1~4 mg/kg/日 分1~4 | | 50~100 mg/日 分割投与 |
| エプレレノン | セララ | (高血圧症) | 電解質異常 腎機能障害 | | 小児心不全に対する投与量の参考となるデータに乏しい | | 50~100 mg/日 1日1回 |
| トルバプタン | サムスカ | 心不全における体液貯留 | 高ナトリウム血症,水分摂取が困難な状態 | 高ナトリウム血症,肝機能障害,口渇 | 0.3~0.5 mg/kg/日 1日1回 半量程度から開始する | | 15 mg/日 1日1回 |
| 9. 肺血管拡張薬 | ベラプロストナトリウム | ドルナー,プロサイリン20 µg, ケアロードLA*,ベラサスLA*, *徐放錠(60 µg) | 肺動脈性肺高血圧症 | 出血している患者(上部消化管出血,喀血など),*原発性肺高血圧症及び膠原病に伴う肺高血圧症以外の肺動脈性肺高血圧症における有効性・安全性は確立していない | 出血傾向 | 1 µg/kg/日(分3)から開始,最大3~5 µg/kg/日(分3~4) | | 1日60 µg(分3)から開始,最大1日180 µg(分3~4),*徐放錠では最大360 µg(分2) |
| エポプロステノールナトリウム | フローラン | 右心不全の急性増悪時,重篤な左心機能障害,重篤な低血圧 | 過度な血圧低下や過度な徐脈,肺水腫 | 2 ng/kg/分で持続静注を開始,低心拍出状態の重症例では少量(0.5~1 ng/kg/分)から開始 | 適切な補液やカテエコラミン併用下での開始が望ましい | |
| ボセンタン水和物 | トラクリア | 中等度~重度の肝障害 | 重篤な肝機能障害 | 4~8 mg/kg/日(分2)*, 40 kg以上(成人同様):250 mg(分2).最初の4週間は半量で投与. | 肝機能を定期的にチェックする | 1回62.5 mg, 1日2回から開始,最大1日250 mgまで |
| アンブリセンタン | ヴォリブリス | 貧血,体液貯留 | 0.1~0.2 mg/kg/日(分1),40 kg以上(成人同様):5~10 mg(分1) | 肝機能ならびに血算を定期的にチェックする | 1回5 mg, 1日1回から開始,最大1日10 mgまで |
| シルデナフィルクエン酸塩 | レバチオ | 硝酸薬及びNO供与薬(ニトログリセリン,亜硝酸アミル,硝酸イソソルビド等)との併用,アミオダロンとの併用(QTc延長作用) | 過度な血圧低下 | 1 mg/kg/日(分3),最大3 mg/kg/日(分3~4) | 他のPAH薬剤との併用時は半量から開始が無難 | 1回20 mg, 1日3回,最大1回40~80 mg, 1日3回 |
| タダラフィル | アドシルカ | 硝酸薬及びNO供与薬(ニトログリセリン,亜硝酸アミル,硝酸イソソルビド等)との併用 | 1 mg/kg/日(分1),最大40 mg(成人量) | 1回40 mg, 1日1回 |
| 10. 動脈管を閉じる薬/開く薬 | アルプロスタジル アルファデックス | プロスタンディン | 新生児における動脈管開存の維持 | | 無呼吸,多呼吸,低血圧,発熱,長管骨の骨膜肥厚,壊死性腸炎 | 50~100 ng/kg/分で開始.症状に応じて適宜増減し,有効最少量で持続投与.10 ng/kg/分でも有効な場合がある. | 心拍,呼吸,体温のモニタリングが必要,無呼吸に対して人工呼吸管理を要することあり | |
| アルプロスタジル(リポ化製剤) | リプル,パルクス | | 5 ng/kg/分 持続静注.その後は症状に応じて適宜増減し有効最少量とする. | lipo-PGE1は末梢静脈より投与可 ヘパリンで凝集 | |
| 11. ファロー四徴症 | プロプラノロール | インデラル | 右室流出路狭窄による低酸素発作の発症抑制 | 気管支喘息,房室ブロック,低血圧,心機能低下 | 徐脈,心不全,房室ブロック,末梢血管収縮,易疲労感 | 無酸素発作予防:1~2(~4)mg/kg/日 経口 分3~4, 無酸素発作治療:10 µg/kgを静注,心電図モニター下で100 µg/kgまで注意して増量可 | ベラパミルと併用禁忌,腎機能低下,肝機能低下時は投与量を減量する | |
| 塩酸モルヒネ | モルヒネ | (鎮痛・鎮静・麻酔前投薬)(ファロー四徴症における無酸素発作時に投与されている) | 気管支喘息 | 呼吸抑制,血圧低下 | 0.05~0.2 mg/kg静注 | | |
| カルテオロール塩酸塩 | ミケラン | ファロー四徴症に伴うチアノーゼ発作[小児用細粒] | 血圧低下 | 0.2~0.3 mg/kg/日 経口 分2 | | |
| フェニレフリン | ネオシネジン | 急性低血圧・ショック(ファロー四徴症における無酸素発作治療時に投与されている) | | | 0.05~0.1 mg/kg静注 0.1~0.5 µg/kg/分で持続静注可 | 血管外に漏出した場合,局所の虚血性壊死があらわれることがある | |
引用文献References
1) Dickstein K, Cohen-Solal A, Filippatos G, et al; ESC Committee for Practice Guidelines (CPG): ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J 2008; 29: 2388–2442
2) Feldman D, Menachemi DM, Abraham WT, et al: Management strategies for stage-D patients with acute heart failure. Clin Cardiol 2008; 31: 297–301
3) Nohria A, Tsang SW, Fang JC, et al: Clinical assessment identifies hemodynamic profiles that predict outcomes in patients admitted with heart failure. J Am Coll Cardiol 2003; 41: 1797–1804
4) 循環器病の診断と治療に関するガイドライン.急性心不全治療ガイドライン(2011年改訂版)http://www.j-circ.or.jp/guideline/pdf/JCS2011_izumi_h.pdf
5) 循環器病の診断と治療に関するガイドライン.慢性心不全治療ガイドライン(2010年改訂版)http://www.j-circ.or.jp/guideline/pdf/JCS2010_matsuzaki_h.pdf
6) Katz AM: Definition, Histrical Aspects. Heart failure: pathophysiology, molecular biology, and clinical management. 2nd ed. Philadelphia, Lippincott, Williams & Wilkins, 2009, pp1–49
7) Dzau V, Braunwald E: Resolved and unresolved issues in the prevention and treatment of coronary artery disease: A workshop consensus statement. Am Heart J 1991; 121: 1244–1263
8) Yancy CW, Jessup M, Bozkurt B, et al: 2013 ACCF/AHA guideline for the management of heart failure: Executive summary: A report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013; 128: 1810–1852
9) ISHLT Guideline for the Management of Pediatric Heart Failure. Birmingham, UAB Printing, 2014
10) Ahmed A, Rich MW, Fleg JL, et al: Effects of digoxin on morbidity and mortality in diastolic heart failure: The ancillary digitalis investigation group trial. Circulation 2006; 114: 397–403
11) Cleland JG, Tendera M, Adamus J, et al; PEP-CHF Investigators: The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27: 2338–2345
12) Massie BM, Carson PE, McMurray JJ, et al; I-PRESERVE Investigators: Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359: 2456–2467
13) van Veldhuisen DJ, Cohen-Solal A, Bohm M, et al; SENIORS Investigators: Beta-blockade with nebivolol in elderly heart failure patients with impaired and preserved left ventricular ejection fraction: Data From SENIORS (Study of Effects of Nebivolol Intervention on Outcomes and Rehospitalization in Seniors With Heart Failure). J Am Coll Cardiol 2009; 53: 2150–2158
14) Senni M, Tribouilloy CM, Rodeheffer RJ, et al: Congestive heart failure in the community: A study of all incident cases in Olmsted County, Minnesota, in 1991. Circulation 1998; 98: 2282–2289
15) Masutani S, Little WC, Hasegawa H, et al: Restrictive left ventricular filling pattern does not result from increased left atrial pressure alone. Circulation 2008; 117: 1550–1554
16) Bergstrom A, Andersson B, Edner M, et al: Effect of carvedilol on diastolic function in patients with diastolic heart failure and preserved systolic function. Results of the Swedish Doppler-echocardiographic study (SWEDIC). Eur J Heart Fail 2004; 6: 453–461
17) Guazzi M, Vicenzi M, Arena R, et al: Pulmonary hypertension in heart failure with preserved ejection fraction: A target of phosphodiesterase-5 inhibition in a 1-year study. Circulation 2011; 124: 164–174
18) Port JD, Gilbert EM, Larrabee P, et al: Neurotransmitter depletion compromises the ability of indirect-acting amines to provide inotropic support in the failing human heart. Circulation 1990; 81: 929–938
19) Colan SD, Borow KM, Neumann A: Left ventricular end-systolic wall stress-velocity of fiber shortening relation: A load-independent index of myocardial contractility. J Am Coll Cardiol 1984; 4: 715–724
20) 片山博視:End-systolic wall stressから見た先天性心疾患の非侵襲的心機能評価の検討.東女医大誌1990; 60: 69–81
21) 八鍬 聡,盛一享徳,武田充人,ほか:塩酸オルプリノンが小児左室機能に及ぼす影響の検討.術後症例を対象として.呼吸と循環2005; 53: S4–S5
22) Hoffman TM, Wernovsky G, Atz AM, et al: Efficacy and safety of milrinone in preventing low cardiac output syndrome in infants and children after corrective surgery for congenital heart disease. Circulation 2003; 107: 996–1002
23) Packer M, Gheorghiade M, Young JB, et al: Withdrawal of digoxin from patients with chronic heart failure treated with angiotensin-converting-enzyme inhibitors. RADIANCE Study. N Engl J Med 1993; 329: 1–7
24) Digitalis Investigation Group: The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525–533
25) Seguchi M, Nakazawa M, Momma K: Further evidence suggesting a limited role of digitalis in infants with circulatory congestion secondary to large ventricular septal defect. Am J Cardiol 1999; 83: 1408–1411, A8
26) Lubsen J, Just H, Hjalmarsson AC, et al: Effect of pimobendan on exercise capacity in patients with heart failure: Main results from the Pimobendan in Congestive Heart Failure (PICO) trial. Heart 1996; 76: 223–231
27) The Epoch Study Group: Effects of pimobendan on adverse cardiac events and physical activities in patients with mild to moderate chronic heart failure: The effects of pimobendan on chronic heart failure study (EPOCH study). Circ J 2002; 66: 149–157
28) The CONSENSUS Trial Study Group: Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316: 1429–1435
29) The SOLVD Investigators: Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325: 293–302
30) Cohn JN, Johnson G; Veterans Administration Cooperative Study Group: Heart failure with normal ejection fraction. The V-HeFT Study. Veterans Administration Cooperative Study Group. Circulation 1990; 81 Suppl: III48–III53
31) Das SR, Drazner MH, Yancy CW, et al: Effects of diabetes mellitus and ischemic heart disease on the progression from asymptomatic left ventricular dysfunction to symptomatic heart failure: A retrospective analysis from the Studies of Left Ventricular Dysfunction (SOLVD) Prevention trial. Am Heart J 2004; 148: 883–888
32) Pfeffer MA, Braunwald E, Moye LA, et al; The SAVE Investigators: Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med 1992; 327: 669–677
33) Packer M, Poole-Wilson PA, Armstrong PW, et al; ATLAS Study Group: Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. Circulation 1999; 100: 2312–2318
34) Yoshimura M, Yasue H, Tanaka H, et al: Responses of plasma concentrations of A type natriuretic peptide and B type natriuretic peptide to alacepril, an angiotensin-converting enzyme inhibitor, in patients with congestive heart failure. Br Heart J 1994; 72: 528–533
35) Venugopalan P, Agarwal AK, Worthing EA: Chronic cardiac failure in children due to dilated cardiomyopathy: Diagnostic approach, pathophysiology and management. Eur J Pediatr 2000; 159: 803–810
36) Stern H, Weil J, Genz T, et al: Captopril in children with dilated cardiomyopathy: Acute and long-term effects in a prospective study of hemodynamic and hormonal effects. Pediatr Cardiol 1990; 11: 22–28
37) Eronen M, Pesonen E, Wallgren EI, et al: Enalapril in children with congestive heart failure. Acta Paediatr Scand 1991; 80: 555–558
38) Leversha AM, Wilson NJ, Clarkson PM, et al: Efficacy and dosage of enalapril in congenital and acquired heart disease. Arch Dis Child 1994; 70: 35–39
39) Mori Y, Nakazawa M, Tomimatsu H, et al: Long-term effect of angiotensin-converting enzyme inhibitor in volume overloaded heart during growth: A controlled pilot study. J Am Coll Cardiol 2000; 36: 270–275
40) Kula S, Tunaoglu FS, Olgunturk R, et al: Atrial natriuretic peptide levels in rheumatic mitral regurgitation and response to angiotensin-converting enzyme inhibitors. Can J Cardiol 2003; 19: 405–408
41) Babu-Narayan SV, Uebing A, Davlouros PA, et al: Randomised trial of ramipril in repaired tetralogy of Fallot and pulmonary regurgitation The APPROPRIATE study (Ace inhibitors for Potential PRevention Of the deleterious effects of Pulmonary Regurgitation In Adults with repaired TEtralogy of Fallot). Int J Cardiol 2010
42) Furukawa T, Murakami T, Ueno M, et al: The cause of B-type natriuretic peptide elevation and the dose-dependent effect of angiotensin-converting enzyme inhibitor on patients late after tetralogy of Fallot repair. Pediatr Cardiol 2012; 33: 264–271
43) Murakami T, Horibata Y, Morimoto Y, et al: Syndrome of inappropriate secretion of antidiuretic hormone associated with angiotensin-converting enzyme inhibitor administration. Pediatr Cardiol 2012
44) Waagstein F, Hjalmarson A, Varnauskas E, et al: Effect of chronic beta-adrenergic receptor blockade in congestive cardiomyopathy. Br Heart J 1975; 37: 1022–1036
45) Swedberg K, Hjalmarson A, Waagstein F, et al: Prolongation of survival in congestive cardiomyopathy by beta-receptor blockade. Lancet 1979; 1: 1374–1376
46) Packer M, Bristow MR, Cohn JN, et al; U.S. Carvedilol Heart Failure Study Group: The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med 1996; 334: 1349–1355
47) The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): A randomised trial. Lancet 1999; 353: 9–13
48) Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999; 353: 2001–2007
49) Packer M, Coats AJ, Fowler MB, et al; Carvedilol Prospective Randomized Cumulative Survival Study Group: Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001; 344: 1651–1658
50) Shaddy RE, Boucek MM, Hsu DT, et al; Pediatric Carvedilol Study Group: Carvedilol for children and adolescents with heart failure: A randomized controlled trial. JAMA 2007; 298: 1171–1179
51) Azeka E, Franchini Ramires JA, Valler C, et al: Delisting of infants and children from the heart transplantation waiting list after carvedilol treatment. J Am Coll Cardiol 2002; 40: 2034–2038
52) Bajcetic M, Kokic Nikolic A, Djukic M, et al: Effects of carvedilol on left ventricular function and oxidative stress in infants and children with idiopathic dilated cardiomyopathy: A 12-month, two-center, open-label study. Clin Ther 2008; 30: 702–714
53) 村上智明:小児心不全の治療.医事新報2009; 4454: 46–51
54) Abdulla J, Kober L, Christensen E, et al: Effect of beta-blocker therapy on functional status in patients with heart failure—A meta-analysis. Eur J Heart Fail 2006; 8: 522–531
55) 石川司朗,青墳裕之,越後茂之,ほか:小児心不全薬物治療ガイドライン.日小循誌2001; 17: 501–512
56) 盛一享徳,仲西正憲,村上智明.パルボウイルス心筋炎による心不全に対するβ遮断薬の効果.日児誌2007; 111: 765–769
57) Hori M, Sasayama S, Kitabatake A, et al; MUCHA Investigators: Low-dose carvedilol improves left ventricular function and reduces cardiovascular hospitalization in Japanese patients with chronic heart failure: The Multicenter Carvedilol Heart Failure Dose Assessment (MUCHA) trial. Am Heart J 2004; 147: 324–330
58) 片山博視,小野安生,松下 亨:β遮断薬療法の現状に関するアンケート調査結果.日小循誌2002; 18: 626–632
59) 村上智明,八鍬 聡,上野倫彦,ほか:両方向性グレン手術・共通房室弁置換術後重症心不全に対しベータ遮断薬を導入し改善した心房錯位症候群の1例.心臓2003; 35: 170–174
60) Willenheimer R, van Veldhuisen DJ, Silke B, et al; CIBIS III Investigators: Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: Results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation 2005; 112: 2426–2435
61) Cohn JN, Tognoni G; Valsartan Heart Failure Trial Investigators: A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med 2001; 345: 1667–1675
62) McMurray JJ, Ostergren J, Swedberg K, et al; CHARM Investigators and Committees: Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: The CHARM-Added trial. Lancet 2003; 362: 767–771
63) 富松 宏,宮尾 益:左右短絡を有する血行動態に及ぼすニトログリセリン軟膏の影響(心不全を伴わない心室中隔欠損症および動脈管開存症について).日小児会誌1984; 88: 726–732
64) Cohn JN, Ziesche S, Smith R, et al: Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III. Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Circulation 1997; 96: 856–863
65) Gistri R, Cecchi F, Choudhury L, et al: Effect of verapamil on absolute myocardial blood flow in hypertrophic cardiomyopathy. Am J Cardiol 1994; 74: 363–368
66) Spicer RL, Rocchini AP, Crowley DC, et al: Chronic verapamil therapy in pediatric and young adult patients with hypertrophic cardiomyopathy. Am J Cardiol 1984; 53: 1614–1619
67) Maron BJ, McKenna WJ, Danielson GK, et al; Task Force on Clinical Expert Consensus Documents. American College of Cardiology; Committee for Practice Guidelines. European Society of Cardiology: American College of Cardiology/European Society of Cardiology clinical expert consensus document on hypertrophic cardiomyopathy. A report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the European Society of Cardiology Committee for Practice Guidelines. J Am Coll Cardiol 2003; 42: 1687–1713
68) Ishihara T, Aisaka K, Hattori K, et al: Vasodilatory and diuretic actions of alpha-human atrial natriuretic polypeptide (alpha-hANP). Life Sci 1985; 36: 1205–1215
69) 日高寿範,相坂一雄,猪俣則夫:Carperitide(α-human atrial natriuretic peptide)の循環器系に対する作用.日薬理誌1993; 101: 309–325
70) Anker SD, Ponikowski P, Varney S, et al: Wasting as independent risk factor for mortality in chronic heart failure. Lancet 1997; 349: 1050–1053
71) Hata N, Seino Y, Tsutamoto T, et al: Effects of carperitide on the long-term prognosis of patients with acute decompensated chronic heart failure: The PROTECT multicenter randomized controlled study. Circ J 2008; 72: 1787–1793
72) Eshaghian S, Horwich TB, Fonarow GC: Relation of loop diuretic dose to mortality in advanced heart failure. Am J Cardiol 2006; 97: 1759–1764
73) Felker GM, Lee KL, Bull DA, et al; NHLBI Heart Failure Clinical Research Network: Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med 2011; 364: 797–805
74) Cosin J, Diez J; TORIC investigators: Torasemide in chronic heart failure: Results of the TORIC study. Eur J Heart Fail 2002; 4: 507–513
75) Masuyama T, Tsujino T, Origasa H, et al: Superiority of long-acting to short-acting loop diuretics in the treatment of congestive heart failure. Circ J 2012; 76: 833–842
76) Pitt B, Zannad F, Remme WJ, et al; Randomized Aldactone Evaluation Study Investigators: The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999; 341: 709–717
77) Pitt B, Remme W, Zannad F, et al; Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators: Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309–1321
78) Regen RB, Gonzalez A, Zawodniak K, et al: Tolvaptan increases serum sodium in pediatric patients with heart failure. Pediatr Cardiol 2013; 34: 1463–1468
79) Horibata Y, Murakami T, Niwa K: Effect of the oral vasopressin receptor antagonist tolvaptan on congestive cardiac failure in a child with restrictive cardiomyopathy. Cardiol Young 2014; 24: 155–157
80) Gheorghiade M, Rossi JS, Cotts W, et al: Characterization and prognostic value of persistent hyponatremia in patients with severe heart failure in the ESCAPE Trial. Arch Intern Med 2007; 167: 1998–2005
81) Gheorghiade M, Abraham WT, Albert NM, et al; OPTIMIZE-HF Investigators and Coordinators: Relationship between admission serum sodium concentration and clinical outcomes in patients hospitalized for heart failure: An analysis from the OPTIMIZE-HF registry. Eur Heart J 2007; 28: 980–988
82) Konstam MA, Gheorghiade M, Burnett JC Jr., et al; Efficacy of Vasopressin Antagonism in Heart Failure Outcome Study With Tolvaptan (EVEREST) Investigators: Effects of oral tolvaptan in patients hospitalized for worsening heart failure: The EVEREST Outcome Trial. JAMA 2007; 297: 1319–1331
83) Imamura T, Kinugawa K, Fujino T, et al: Increased urine aquaporin-2 relative to plasma arginine vasopressin is a novel marker of response to tolvaptan in patients with decompensated heart failure. Circ J 2014; 78: 2240–2249
84) Galie N, Humbert M, Vachiery JL, et al; Arterial Pulmonary Hypertension and Beraprost European (ALPHABET) Study Group: Effects of beraprost sodium, an oral prostacyclin analogue, in patients with pulmonary arterial hypertension: a randomized, double-blind, placebo-controlled trial. J Am Coll Cardiol 2002; 39: 1496–1502
85) Barst RJ, McGoon M, McLaughlin V, et al; Beraprost Study Group: Beraprost therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2003; 41: 2119–2125
86) Nakayama T, Shimada H, Takatsuki S, et al: Efficacy and limitations of continuous intravenous epoprostenol therapy for idiopathic pulmonary arterial hypertension in Japanese children. Circ J 2007; 71: 1785–1790
87) Yung D, Widlitz AC, Rosenzweig EB, et al: Outcomes in children with idiopathic pulmonary arterial hypertension. Circulation 2004; 110: 660–665
88) van Loon RL, Hoendermis ES, Duffels MG, et al: Long-term effect of bosentan in adults versus children with pulmonary arterial hypertension associated with systemic-to-pulmonary shunt: Does the beneficial effect persist? Am Heart J 2007; 154: 776–782
89) Paul GA, Gibbs JS, Boobis AR, et al: Bosentan decreases the plasma concentration of sildenafil when coprescribed in pulmonary hypertension. Br J Clin Pharmacol 2005; 60: 107–112
90) Takatsuki S, Rosenzweig E, Zuckerman W, et al: Clinical safety, pharmacokinetics, and efficacy of ambrisentan therapy in children with pulmonary arterial hypertension. Pediatr Pulmonol 2013; 48: 27–34
91) Namachivayam P, Theilen U, Butt WW, et al: Sildenafil prevents rebound pulmonary hypertension after withdrawal of nitric oxide in children. Am J Respir Crit Care Med 2006; 174: 1042–1047
92) Nagendran J, Archer SL, Soliman D, et al: Phosphodiesterase type 5 is highly expressed in the hypertrophied human right ventricle, and acute inhibition of phosphodiesterase type 5 improves contractility. Circulation 2007; 116: 238–248
93) Barst RJ, Ivy DD, Gaitan G, et al: A randomized, double-blind, placebo-controlled, dose-ranging study of oral sildenafil citrate in treatment-naive children with pulmonary arterial hypertension. Circulation 2012; 125: 324–334
94) Barst RJ, Beghetti M, Pulido T, et al; STARTS-2 Investigators: STARTS-2: Long-term survival with oral sildenafil monotherapy in treatment-naive pediatric pulmonary arterial hypertension. Circulation 2014; 129: 1914–1923
95) Takatsuki S, Calderbank M, Ivy DD: Initial experience with tadalafil in pediatric pulmonary arterial hypertension. Pediatr Cardiol 2012; 33: 683–688
96) Sabri MR, Beheshtian E: Comparison of the therapeutic and side effects of tadalafil and sildenafil in children and adolescents with pulmonary arterial hypertension. Pediatr Cardiol 2014; 35: 699–704
97) Sitbon O, Humbert M, Jais X, et al: Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005; 111: 3105–3111
98) Balfour-Lynn IM, Field DJ, Gringras P, et al; Paediatric Section of the Home Oxygen Guideline Development Group of the BTS Standards of Care Committee: BTS guidelines for home oxygen in children. Thorax 2009; 64 Suppl 2: ii1–ii26
99) Sandoval J, Aguirre JS, Pulido T, et al: Nocturnal oxygen therapy in patients with the Eisenmenger syndrome. Am J Respir Crit Care Med 2001; 164: 1682–1687
100) Patten RD, Konstam MA: Ventricular remodeling and the renin angiotensin aldosterone system. Congest Heart Fail 2000; 6: 187–192
101) Oshima K, Kunimoto F, Hinohara H, et al: Fulminant myocarditis treated with percutaneous cardiopulmonary support system (PCPS). Ann Thorac Cardiovasc Surg 2008; 14: 75–80
102) 中本祐樹,上田秀明,後藤建次郎,ほか:経皮的人工心肺補助を10日間使用して救命しえた劇症型心筋炎の1例.日児誌2009; 113: 1721–1725
103) 丹羽淳子,中島弘道,佐藤純一,ほか:経皮的心肺補助装置を使用し救命しえた劇症型心筋炎の幼児例.日児誌2000; 104: 459–462
104) Tsuda E, Matsuo M, Sakaguchi H, et al: Combined amiodarone and low-dose carvedilol treatment for severe heart failure in childhood. Pediatr Int 2010; 52: e39–e42
105) 佐野仁美,武田充人,山崎健史,ほか:アンギオテンシン変換酵素阻害剤の増量が有効であった拡張型心筋症の1例.日児誌2011; 115: 629–634
106) 辻 靖博,船田裕昭,橋田祐一郎,ほか:β遮断薬投与により10年間安定した状態を維持している拡張型心筋症の1男児例.小児科2009; 50: 789–793
107) Yoshikawa T, Baba A, Suzuki M, et al; For Keio Interhospital Cardiology Study (KICS) Group: Effectiveness of carvedilol alone versus carvedilol+pimobendan for severe congestive heart failure. For the Keio Interhospital Cardiology Study (KICS) Group. Am J Cardiol 2000; 85: 1495–1497, A7
108) Ostman-Smith I, Wettrell G, Riesenfeld T: A cohort study of childhood hypertrophic cardiomyopathy: Improved survival following high-dose beta-adrenoceptor antagonist treatment. J Am Coll Cardiol 1999; 34: 1813–1822
109) Maron BJ: Hypertrophic cardiomyopathy. Curr Probl Cardiol 1993; 18: 639–704
110) Turnbull F, Neal B, Pfeffer M, et al; Blood Pressure Lowering Treatment Trialists’ Collaboration: Blood pressure-dependent and independent effects of agents that inhibit the renin-angiotensin system. J Hypertens 2007; 25: 951–958
111) 住友直方,岩本眞理,牛ノ濱大也,ほか:小児不整脈の診断・治療ガイドライン.日小循誌2010; 26 Suppl: 30–39
112) Denfield SW, Webber SA: Restrictive cardiomyopathy in childhood. Heart Fail Clin 2010; 6: 445–452, viii
113) Wilkinson JD, Landy DC, Colan SD, et al: The pediatric cardiomyopathy registry and heart failure: Key results from the first 15 years. Heart Fail Clin 2010; 6: 401–413, vii
114) Williams GD, Hammer GB: Cardiomyopathy in childhood. Curr Opin Anaesthesiol 2011; 24: 289–300
115) Bograd AJ, Mital S, Schwarzenberger JC, et al: Twenty-year experience with heart transplantation for infants and children with restrictive cardiomyopathy: 1986–2006. Am J Transplant 2008; 8: 201–207
116) Fenton MJ, Chubb H, McMahon AM, et al: Heart and heart-lung transplantation for idiopathic restrictive cardiomyopathy in children. Heart 2006; 92: 85–89
117) Petrucci O, O’Brien SM, Jacobs ML, et al: Risk factors for mortality and morbidity after the neonatal Blalock-Taussig shunt procedure. Ann Thorac Surg 2011; 92: 642–651, discussion, 651–652
118) Moszura T, Zubrzycka M, Michalak KW, et al: Acute and late obstruction of a modified Blalock-Taussig shunt: A two-center experience in different catheter-based methods of treatment. Interact Cardiovasc Thorac Surg 2010; 10: 727–731
119) Li JS, Yow E, Berezny KY, et al: Clinical outcomes of palliative surgery including a systemic-to-pulmonary artery shunt in infants with cyanotic congenital heart disease: Does aspirin make a difference? Circulation 2007; 116: 293–297
120) Kajihara N, Asou T, Takeda Y, et al: Pulmonary artery banding for functionally single ventricles: Impact of tighter banding in staged Fontan era. Ann Thorac Surg 2010; 89: 174–179
121) Ohuchi H, Kagisaki K, Miyazaki A, et al: Impact of the evolution of the Fontan operation on early and late mortality: A single-center experience of 405 patients over 3 decades. Ann Thorac Surg 2011; 92: 1457–1466
122) Khairy P, Fernandes SM, Mayer JE Jr., et al: Long-term survival, modes of death, and predictors of mortality in patients with Fontan surgery. Circulation 2008; 117: 85–92
123) Goldberg DJ, French B, McBride MG, et al: Impact of oral sildenafil on exercise performance in children and young adults after the fontan operation: A randomized, double-blind, placebo-controlled, crossover trial. Circulation 2011; 123: 1185–1193
124) Hsu DT, Lamour JM: Changing indications for pediatric heart transplantation: Complex congenital heart disease. Circulation 2015; 131: 91–99
125) Ohuchi H, Yasuda K, Miyazaki A, et al: Prevalence and predictors of haemostatic complications in 412 Fontan patients: Their relation to anticoagulation and haemodynamics. Eur J Cardiothorac Surg 2015; 47: 511–519
126) Ringel RE, Peddy SB: Effect of high-dose spironolactone on protein-losing enteropathy in patients with Fontan palliation of complex congenital heart disease. Am J Cardiol 2003; 91: 1031–1032, A9
127) Barst RJ, Gibbs JS, Ghofrani HA, et al: Updated evidence-based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2009; 54 Suppl: S78–S84
128) Galie N, Hoeper MM, Humbert M, et al; Task Force for Diagnosis and Treatment of Pulmonary Hypertension of European Society of Cardiology (ESC); European Respiratory Society (ERS); International Society of Heart and Lung Transplantation (ISHLT): Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2009; 34: 1219–1263
129) Rosenzweig EB, Kerstein D, Barst RJ: Long-term prostacyclin for pulmonary hypertension with associated congenital heart defects. Circulation 1999; 99: 1858–1865
130) Gatzoulis MA, Beghetti M, Galie N, et al; BREATHE-5 Investigators: Longer-term bosentan therapy improves functional capacity in Eisenmenger syndrome: Results of the BREATHE-5 open-label extension study. Int J Cardiol 2008; 127: 27–32
131) Iversen K, Jensen AS, Jensen TV, et al: Combination therapy with bosentan and sildenafil in Eisenmenger syndrome: A randomized, placebo-controlled, double-blinded trial. Eur Heart J 2010; 31: 1124–1131
132) Mukhopadhyay S, Nathani S, Yusuf J, et al: Clinical efficacy of phosphodiesterase-5 inhibitor tadalafil in Eisenmenger syndrome—A randomized, placebo-controlled, double-blind crossover study. Congenit Heart Dis 2011; 6: 424–431
133) Rosenzweig EB, Barst RJ: Congenital heart disease and pulmonary hypertension: Pharmacology and feasibility of late surgery. Prog Cardiovasc Dis 2012; 55: 128–133
134) Nakazawa M, Shinohara T, Sasaki A, et al; Study Group for Arrhythmias Long-Term After Surgery for Congenital Heart Disease: ALTAS-CHD study: Arrhythmias late after repair of tetralogy of fallot: A Japanese Multicenter Study. Circ J 2004; 68: 126–130
135) Niwa K, Hamada H, Nakazawa M, et al; Japanese Multi-center Study Group: Mortality and risk factors for late deaths in tetralogy of Fallot: The Japanese Nationwide Multicentric Survey. Cardiol Young 2002; 12: 453–460
136) Apitz C, Webb GD, Redington AN: Tetralogy of Fallot. Lancet 2009; 374: 1462–1471
137) Warnes CA, Williams RG, Bashore TM, et al: ACC/AHA 2008 Guidelines for the Management of Adults with Congenital Heart Disease: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to develop guidelines on the management of adults with congenital heart disease). Circulation 2008; 118: e714–e833
138) Huehnergarth KV, Gurvitz M, Stout KK, et al: Repaired tetralogy of Fallot in the adult: Monitoring and management. Heart 2008; 94: 1663–1669
139) Oosterhof T, van Straten A, Vliegen HW, et al: Preoperative thresholds for pulmonary valve replacement in patients with corrected tetralogy of Fallot using cardiovascular magnetic resonance. Circulation 2007; 116: 545–551
140) Frigiola A, Tsang V, Bull C, et al: Biventricular response after pulmonary valve replacement for right ventricular outflow tract dysfunction: Is age a predictor of outcome? Circulation 2008; 118 Suppl: S182–S190
141) Galie N, Beghetti M, Gatzoulis MA, et al; Bosentan Randomized Trial of Endothelin Antagonist Therapy-5 (BREATHE-5) Investigators: Bosentan therapy in patients with Eisenmenger syndrome: A multicenter, double-blind, randomized, placebo-controlled study. Circulation 2006; 114: 48–54
142) Dimopoulos K, Inuzuka R, Goletto S, et al: Improved survival among patients with Eisenmenger syndrome receiving advanced therapy for pulmonary arterial hypertension. Circulation 2010; 121: 20–25