新生児期に必要なカテーテル治療Essential Catheter Interventions in Neonatal Period
独立行政法人国立循環器病研究センター小児循環器科Department of Pediatric Cardiology, National Cerebral and Cardiovascular Center ◇ 〒565-8565 大阪府吹田市藤白台5-7-15-7-1 Fujishirodai, Suita-shi, Osaka 565-8565, Japan
独立行政法人国立循環器病研究センター小児循環器科Department of Pediatric Cardiology, National Cerebral and Cardiovascular Center ◇ 〒565-8565 大阪府吹田市藤白台5-7-15-7-1 Fujishirodai, Suita-shi, Osaka 565-8565, Japan
ロープロファイルな治療器具が開発されたことで,新生児においても様々なカテーテル治療が施行されるようになった.本稿では,1. 通常の心房中隔裂開術が困難な場合のその方法,2. 長期経過から再検討した心室中隔欠損を伴わない肺動脈閉鎖に対するカテーテル的弁形成術,3. 左心低形成症候群における安全な動脈管ステント留置術の3項目に関して,臨床の場で役立つように解説した.新生児のカテーテル治療は外科治療よりも低侵襲で遂行できるが,重篤な合併症が起こりえるので,その合併症と対応策を熟知してから治療に臨む必要がある.
Development of low-profile materials has enabled various catheter interventions to be performed in the neonatal period. In this study, three clinically important issues related to neonatal catheter interventions are discussed: 1) alternative methods when balloon atrial septostomy is difficult to perform; 2) balloon pulmonary valvuloplasty in neonates with pulmonary atresia with intact ventricular septum, and the long-term outcomes of the procedure; and 3) the safe technique of ductal stenting in patients with hypoplastic left heart syndrome. Although neonatal catheter interventions are less invasive than surgical procedures, there are several severe complications. Therefore, it is important that these procedures are performed with sufficient information and understanding of the potential complications and ways to deal with them.
Key words: balloon atrial septostomy; balloon pulmonary valvuloplasty; ductal stenting; complications; neonates
© 2015 特定非営利活動法人日本小児循環器学会© 2015 Japanese Society of Pediatric Cardiology and Cardiac Surgery
近年様々なロープロファイルな治療器具が開発・使用可能になり,新生児期においても様々なカテーテル治療が施行されるようになった.その詳細をTable 1に示す.本稿では第11回教育セミナーで講義した内容,即ち新生児期に施行されているカテーテル治療の内の主要な3手技に関して解説する.
| 1. Opening of Atrial Communications |
| ・Atrial Septostomy |
| ・Transseptal Technique |
| 2. Transcatheter Balloon Dilation of Cardiac Valves |
| ・Pulmonary Valvuloplasty |
| ・Aortic Valvuloplasty |
| 3. Transcatheter Balloon Angioplasty or Stent Implantation |
| ・Native Coarctation and Recoarctation Angioplasty |
| ・Pulmonary Artery Angioplasty and Stent Implantation |
| ・Pulmonary Vein Stenting |
| ・Vertical Vein Stenting |
| ・Ductal Stenting |
| 4. Transcatheter Vascular Occlusion |
| ・Patent Ductus Arteriosus |
| ・Aortopulmonary Collateral Vessels |
| 5. Hybrid Procedures |
| ・Ductal Stenting with Bilateral Pulmonary Artery Banding in HLHS and Complex Single-Ventricle Physiology |
| Note: Common procedures are indicated in bold type. |
房室弁の損傷をきたす可能性があるので必ず正面・側面透視を使用する.右房(RA)内にあるカテーテルを後左方へ向けて左房(LA)へ通す.軽くテストインフレーションして心室に引き込まれないことを確認してから,力まずにスピードを付けてシャフトを手前に短く引く(B).抵抗を感じるが直ぐに下大静脈(IVC)へ入り込むので(C),RAへ押し戻す(D).小さめ(1 ccの注入)から開始し,徐々にサイズアップするのが安全である.
現在日本でBASに保険適応されているカテーテルは2種類ある.Rashkind catheterは最大注入量が2 cc,最大径が14 mm,適合シースは6Fである.一方Miller catheterは最大注入量が4 cc,最大径が19 mmと大きいが,適合シースは7Fである.できる限り大腿静脈(FV)の閉塞を避けるためにRashkind catheterが選択されることが多い.低体重児の場合はさらにFVが細いので,BASには保険適応がないが,4F,5Fのシースで使用できる血栓除去用のFogaty catheterが有用である(Table 2).新生児期にBASが必要となる疾患としては,心房間mixingが必要な完全大血管転位(TGA)・両大血管右室起始(DORV),生存に心房間左右短絡が必要な左心低形成症候群(HLHS)・重症大動脈弁狭窄(cAS),反対に右左短絡が必要な三尖弁閉鎖(TA)・心室中隔欠損を伴わない肺動脈閉鎖(PA IVS)などがある.
| Catheter | Maximum infusion volume | Maximum balloon diameter | Appropreate sheath size |
|---|---|---|---|
| Miller | 4 cc | 19 mm | 7F |
| Rashkind | 2 cc | 14 mm | 6F |
| Fogaty | 1.5 cc | 11 mm | 5F |
| 0.75 cc | 9 mm | 4F |
通常のBASが困難,危険,無効な状況としては,肥厚した心房中隔壁,intact atrial septum(IAS),小さいLA,低体重児,両側FVの閉塞・IVC離断などがある.肥厚した心房中隔壁に対して以前はblade atrial septostomyが施行されたが,心房壁や右室流出路(RVOT)の裂傷から死亡する合併症があり,近年はあまり施行されなくなっている2,3).これに対してballoon atrial septal dilationは効果がやや劣るが安全に施行できる.有効な欠損孔を得るためには新生児でも10~12 mm径のバルーンが必要である4,5).inflation/deflationが素早くできるArmada(12 mm×20 mm; Abot)などが適している.当院での経験になるが,Balloon atrial septal dilationにBASを組み合わせることで十分な効果が得られている.IASに対して日本では昨年までBrockenbrough needleを使用せざるを得なかった.新生児・乳児の体格でも心房中隔穿孔は不可能ではないが,特にHLHSでは心房中隔壁が厚く,それを穿孔するだけのLA容積(奥行き)がない場合が多く(Fig. 2),心房壁の穿孔・心タンポナーデの合併率が高くなる6,7).欧米では10数年前からradiofrequency wireを用いた心房中隔穿孔が施行されている(Fig. 3)8).心房中隔に接触させて通電するだけで中隔を穿孔できるので,LAが小さい新生児の肥厚したIASでもより安全に穿孔できる.日本でも2014年8月からNykanen RF wireが使用可能となった(Fig. 4).このwireの直径は0.024″,長さは265 cmで,先端のActive atraumatic tipの直径は0.016″,長さは1.5 mmである.Active tip以外の部分は整形が可能である.Connector cableでGeneratorと接続し,5~10 W,1~10 secの通電で組織の穿通が可能である.現在日本ではPA IVSの肺動脈弁穿孔とIASの心房中隔穿孔に適応があり,その使用には講習が必要である.肥厚した心房中隔のためにBASが無効の場合にはstent septostomyも有効である.留置後抗血小板薬だけでは血栓形成の報告があることから抗凝固療法が必要と思われる9).またstent migrationの報告や強度の内膜増殖を来す期間が不明であり,注意を要する10).

Photograph A shows the left atrial angiogram after transseptal puncture. On transthoracic echocardiogram, immediately before the needle entered the septum, the thick atrial septum (between broken lines) was elongated (broken arrow) and the tip of the needle (arrow) was almost in contact with the left atrial posterior wall (B). Immediately after passing the septum, the tip barely escaped passing through the posterior wall (C; arrow). RA, right atrium; LA, left atrium.
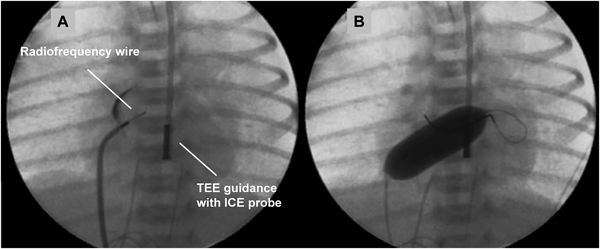
TEE, transesophageal echocardiography; ICE, intra-cardiac echocardiography.
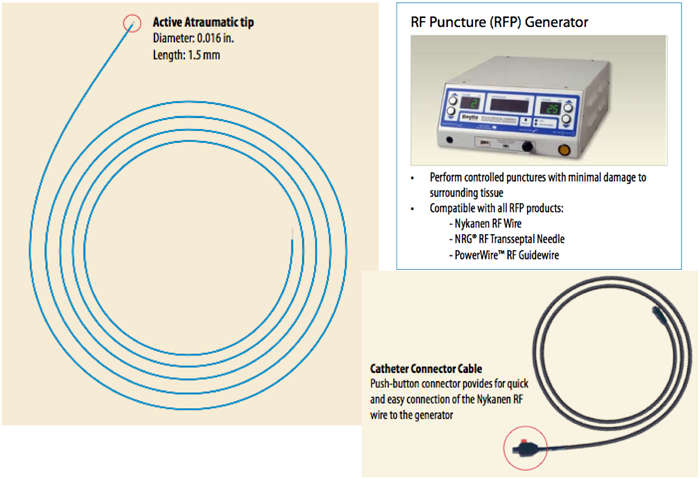
Wire: outer diameter 0.024″, length 265 cm; Active tip: diameter 0.016″, length 1.5 mm.
バルーンの破裂,破裂バルーン片による塞栓,バルーンデフレーション困難,IVC閉塞・損傷,三尖弁(TV)・僧帽弁(MV)損傷,心房壁裂傷,肺静脈裂傷,高度房室ブロック・徐脈,出血などがあるが,合併症を熟知して臨むことでその多くは回避できる.近年日本で発生したBASに関連した合併症をTable 3に示す.Brockenbrough法による心タンポナーデが多いこと,近年でも心房壁等の穿孔・裂傷から死亡する症例があることを銘記すべきである.
| Year | Complications (number) |
|---|---|
| 2011 | Atrial fibrillation (1),hypotesion-death (Balloon dilation) (1) |
| 2010 | Left atrium perforation-death (1),cerebral infarction (1),stent migration-surgery (1), retroperitonear bleeding (1),atrioventricular block (1) |
| 2009 | Supraventricular tachycardia (1),pericardial effusion (2) - (Brockenbrough) (1), cardiac tamponade (Brockenbrough) (1) |
| 2008 | Tricuspid regurgitation (1),bleeding (1),stent migration-surgery (1) , internal iliac artery occlusion due to embolization of ruptured-balloon fragment (1) |
| 2007 | Atrial fibrillation (1),atrial flutter (1) |
| 2006 | Mitral regurgitation (1),tricuspid regurgitation (1), cardiac tamponade (Brockenbrough) (1) |
| 2005 | Atrial fibrillation (1),pericardial effusion (1) |
PA IVSはRVの容積と形態から3群に分類される(Figs. 5, 6).この分類はBPVの適応判断と治療後の経過の予測に有用である11).正確なRV容積は造影検査などをしないと計測できないが,TV弁輪径はRV容積と相関するので,エコー検査でもある程度の適応判定が可能である.
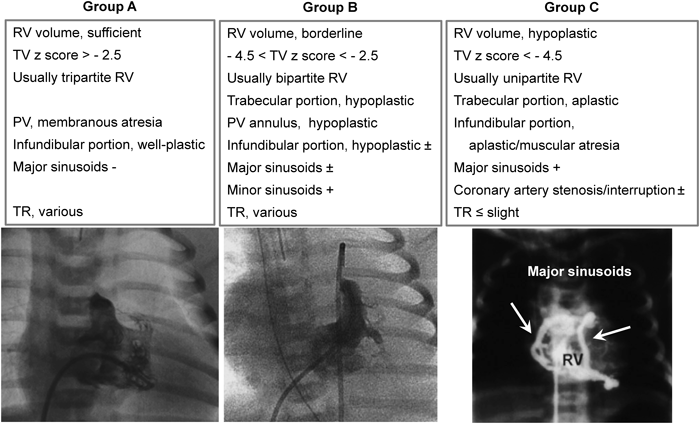
RV, right ventricle; TV, tricuspid valve; PV, pulmonary valve; TR, tricuspid regurgitation.

RV, right ventricle; BT, Blalock-Taussig; DS, ductal stenting; BAS, balloon atrial septostomy.
RVは減圧されても拡張能の改善に1~2週間要するので,1週間程度PGE1で動脈管(AD)を開存させ,酸素は使用せずに十分な鎮静と人工呼吸管理を継続する.エコーでTVの流入およびRVから肺動脈への順行性血流の増加が十分であればPGE1を中止してみる.ADが収縮してもSpO2が70%以上に維持されれば,酸素を使用して,人工呼吸から離脱する.その後RVは徐々に発育し,SpO2は上昇する.ADが収縮するとSpO2が70%以上に維持されない場合はPGE1を再開し,さらに1週間RVの拡張能が改善するのを待ってからPGE1を中止してみる.この時点でSpO2が維持できない場合は,Blalock-Taussig(BT)shuntかductal stenting(DS)が必要である.
当院で1995年10月から2008年11月の間に新生児PA IVS 14症例に対して施行したBPVの遠隔成績から新生児期の治療方針を再検討した.14症例ともRV構造はtripartiteでsinusoidal communicationはない.14症例のBPV時の詳細をTable 4に示す.BPV後の経過はFig. 8にあるように13症例で手技に成功し,その内の7症例は外科治療が不要であったが,残りの6症例は経過中に新生児期のBT shuntまたは遠隔期の右室流出路形成(RVOTR)やTV-plastyなどの外科治療介入が必要であった.最終的に11症例に二心室循環が成立している.Fig. 9に示すように右室拡張末期容積(RVEDV)が40%未満ではBPVに成功しても肺血流量が不十分なために新生児期にBT shuntが必要であった.Fig. 10に示すようにBPV後RVは徐々に発育する.RVEDVが40%未満であるものが2症例あった.その内のTV弁輪径のz-valueが−4以上のものはBT shunt施行後の経過中にRVが発育した.しかしTV弁輪径のz-valueが−4未満のものはRVを通過する血流量が増加しないので,RVが発育せず,結局二心室循環が成立しなかった.一方RV圧は経過中徐々に低下してゆく(Fig. 11).Fig. 12に示すように,遠隔期に肺動脈弁狭窄(PS)の程度は徐々に軽減してゆくのに対して,PRは徐々に増加してゆく.Fig. 13に示すようにPSとPRが相反関係にあることから最終目標はPS,PRともに軽度な状態である.そのためにも新生児期のBPVで使用するballoonのサイズは可能な限りPV弁輪径の120~125%程度に留めるべきである.またPRに伴って三尖弁閉鎖不全(TR)が増悪する傾向があり,形態的に弁形成が可能であれば形成術を考慮する.これら11症例の最近の状態は心室性期外収縮以外に問題となる不整脈はなく,運動制限も疲労を感じたら休憩する程度と比較的QOLは高い.
| Range | Median | ||
|---|---|---|---|
| Age | 1–21 | 7 | [day] |
| Weight | 2.4–3.6 | 3.2 | [kg] |
| Tricuspid valve annulus | 6.1–16.5 | 10 | [mm] |
| z-value | −5.6–3.4 | −1.5 | |
| Right ventricle (RV) end-diastolic volume | 2.6–10.6 | 5.2 | [mL] |
| % of normal | 36–161 | 63 | |
| Pulmonary valve (PV) annulus | 4–8.1 | 5.9 | [mm] |
| z-value | −5.8–0.7 | −1.9 | |
| Balloon diameter/PV diameter | 0.67–1.3 | 1.12 | |
| Note: All patients have tripartite RV and no sinusoidal communication. | |||
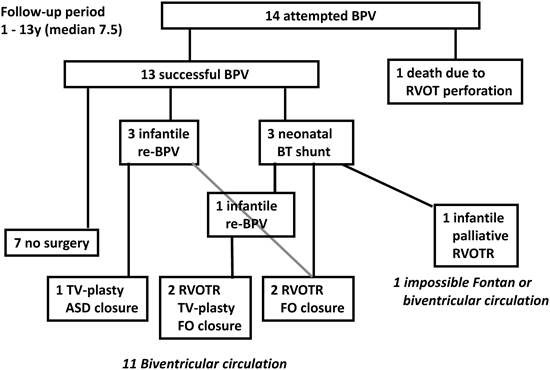
PA IVS, pulmonary atresia with intact ventricular septum; BPV, balloon pulmonary valvuloplasty; RVOT, right ventricle outflow; RVOTR, right ventricular outflow reconstruction; TV, tricuspid valve; ASD, atrial septal defect; FO, foramen ovale.

BT, Blalock-Taussig; BPV, balloon pulmonary valvuloplasty; BD, balloon diameter; PVD pulmonary valve annulus diameter; RVEDV, right ventricular end-diastolic volume; RVp, right ventricular systolic pressure; LVp left ventricular systolic pressure.
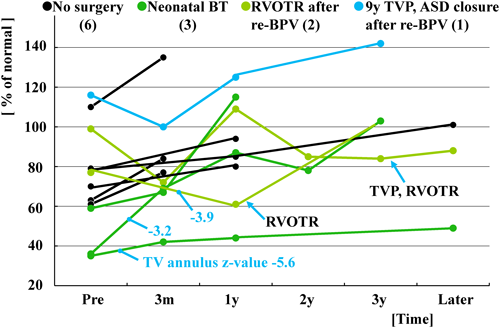
BPV, balloon pulmonary valvuloplasty; RVOTR, right ventricular outflow reconstruction; TVP, tricuspid valvuloplasty; ASD, atrial septal defect.

BPV, balloon pulmonary valvuloplasty; RV, right ventricle; LV left ventricle; BT, Blalock-Taussig; RVOTR, right ventricular outflow reconstruction; TVP, tricuspid valvuloplasty; ASD, atrial septal defect.

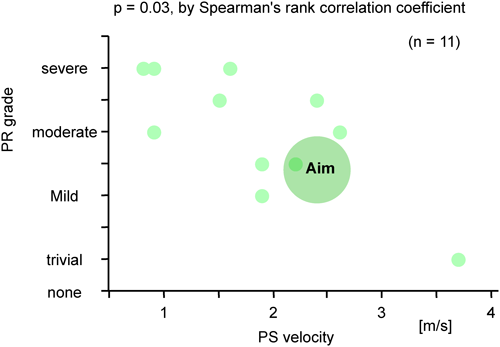
結論として適応を厳密にすれば,即ちtripartite RV, sinusiodal communicationなし,TV annulus z-score>−4, RVEDV≥60% of normal, PV annulus z-score≥−4を満たす場合に新生児期に施行するBPVの予後は良好と判断される.
新生児期にDSが施行される場合がある疾患としてHSHS,cAS; 大動脈弓離断(IAA),大動脈縮窄(CoA);PA IVS,重症肺動脈弁狭窄(cPS);ファロー四徴(TOF),DORVなどが挙げられる.以後HLHSにおけるDSに関して述べる.BT shuntから右室肺動脈(RV-PA)conduitを用いたNorwood手術が主流となり,その成績はここ20年間に劇的に改善した12–15).しかし低体重児,右室機能低下,重度TR,IAS,染色体異常などの危険因子がある場合の死亡率は20~50%と高く,両方向性Glenn(BDG)までのinterstageの死亡もある16,17).これらのhigh risk群では高侵襲なNorwood手術を回避して,First palliationとしてより低侵襲な両側肺動脈絞扼(Bil-PAB)とDSを施行して,発育後にNorwood & BDG手術を施行することで生存率が上昇した16–18).
DSはhybrid roomでBil-PABと同時にhybridアプローチで主肺動脈にシースを挿入して留置する方法と後にカテーテル室でFVから経静脈的に留置する方法がある.ステントはself expandableとballoon expandableのものがある.経静脈的に留置する場合は合併症を起こさずに手技を遂行するための配慮が必要である.
HLHSではBil-PAB後であってもカテーテルなどをRVから下行大動脈(DAo)まで進めるとRVのストレッチ,PR・TRの出現などから血圧が低下しやすいので,極力RVをストレッチさせないmaterialsを使用する.人工呼吸管理下の施行が安全だが,鎮静剤等の使用から血管拡張による血圧低下がある場合は昇圧剤を併用して血圧を高めに保つように心掛ける.
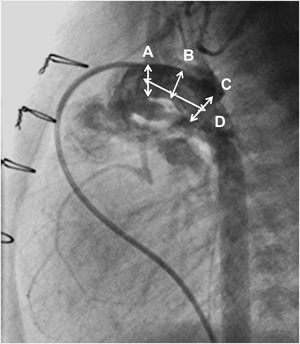
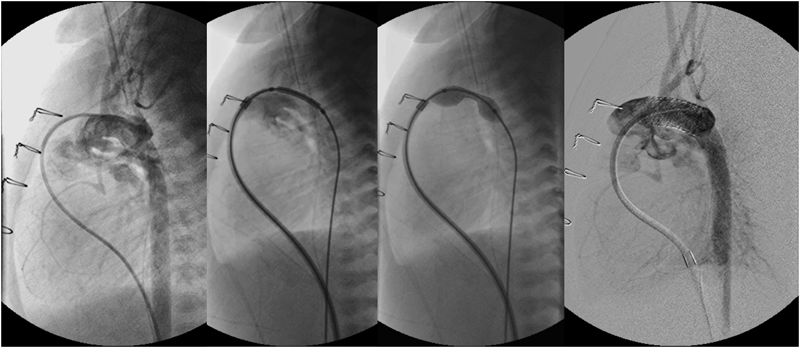
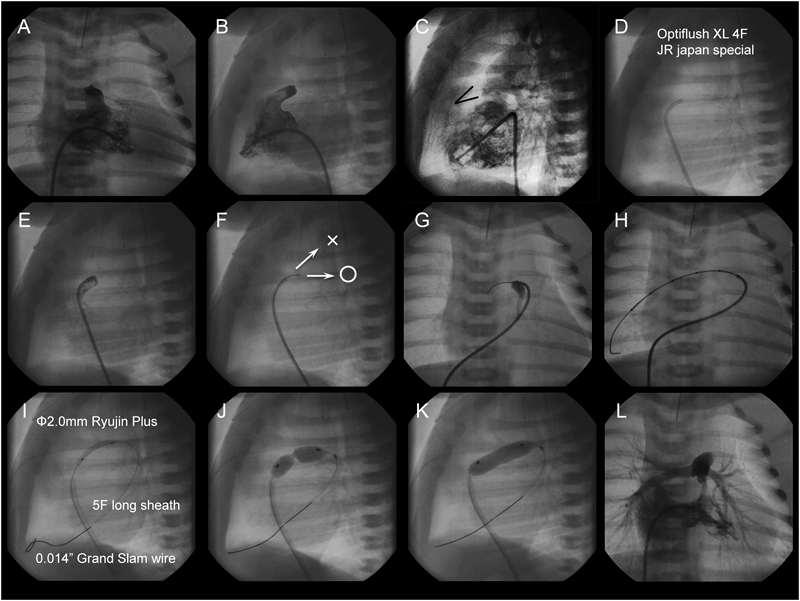
Wire: 0.035″ Hanako; Long sheath: 6F Brite tip; Stent: Express™ LD Vascular stent (1880).

The main pulmonary arteriogram revealed the constriction of the pulmonary arterial side of the arterial duct (AD), which was not covered by the previously implanted stent (A; arrow). The guide wire was formed in vitro into an inverted U-shape to fit the curvature of the AD (B, arrows). During the procedure, blood pressure was maintained at a higher level after intravenous infusion of epinephrine (10 µg), and a stent (6 mm in diameter and 18 mm in length) (Palmaz Genesis® 1860) was delivered into the AD by bare delivery (C) and implanted (D).
2006年10月から2013年10月の間に当院で12症例(Table 5)に施行したDSの最中または後に生じた合併症・問題点をTable 6に示す.最多の問題は手技中の血圧低下であり,12症例中7症例に認められ,その内の5症例はHLHSであった.特に大動脈弁閉鎖では血圧低下から冠血流が低下して重篤な心機能低下をきたし得るので,Bare stent deliveryやエピネフリン静注などの対応を施して手技に臨む必要がある.
| Age (day) | 3–107 (median 24) |
| Weight (kg) | 2.0–3.3 (median 2.7) |
| Underlying disaese | HLHS (6), cAS (2), unbacanced AVSD (1), IAA (2), TA TGA (1) |
| Length of AD (mm) | 4.3–32.7 (median 17.0) |
| Diametr of AD (mm) | |
| Pulmonary arterty side | 2.7–9.4 (median 6.3) |
| Center | 1.9–7.9 (median 3.9) |
| Ao side | 3.8–10.5 (median 6.9) |
| Stent *before remount | |
| Size | Medium (5), Small (9) |
| Diameter (mm) | 5–10 (median 6) |
| Length (mm) | 12–29 (median 18) |
| Way of implantation | Common (5), Bare delivery (6), Hybrid (1) |
| Stent afer implantation | |
| Diameter (mm) | 4.9–9.7 (median 8.0) |
| Length (mm) | 9.8–18.3 (median 15.5) |
| DS, ductal stenting; HLHS, hypoplastic left heart syndrome; cAS, critical aortic valve stenosis; AVSD, atrioventricular septal defect; IAA, interrupted aortic arch; TA, tricuspid atresia; TGA, transposition of the great arteries; AD, arterial duct. | |
| Problems/complications | n | How to deal with it |
|---|---|---|
| Decrease of blood pressure during the procedure | 7 | Forming the guide wire into an invert U shape |
| Bare stent delivery | ||
| Injection of epinephrin (5–10 µg) | ||
| Ductal constricriction of the part where is not covered the previous stent | 2 | Additional stenting |
| Fear to compress the bronchus because of right DAo and a long course of the AD | 1 | Covering only the narrow part of pulmonary artery side in the AD |
| Alternative way: use of selfexpandable stent | ||
| Dissection of DAo | 1 | Additional stenting |
| Development of CoA | 1 | Norwood procedure |
| Need for the catheter to turn in the LV to delivery | 1 | Delivery from FA |
| DS, ductal stenting; DAo, descending aorta; CoA, Coarctation of the Aorta; LV, left ventricle; FA, femoral artery. | ||
ロープロファイルなマテリアルが開発され,新生児においても様々なカテーテル治療が施行されるようになった.新生児のカテーテル治療は外科治療よりも低侵襲で施行できることが最大の利点であるが,外科治療と同様に重篤な合併症が起こりえ,また術者の違いが成績に反映される手技である.新生児のカテーテル治療を行う場合は,合併症とその対応策を熟知した上で,合併症が起きてからではなく,起こらないように配慮しながら手技を遂行することが最も大切である.
1) Rashkind WJ, Miller WW: Creation of an atrial septal defect without thoracotomy. A palliative approach to complete transposition of the great arteries. JAMA 1966; 196: 991–992
2) Park SC, Neches WH, Zuberbuhler JR, et al: Clinical use of blade atrial septostomy. Circulation 1978; 58: 600–606
3) Park SC, Neches WH, Mullins CE, et al: Blade atrial septostomy: Collaborative study. Circulation 1982; 66: 258–266
4) Shrivastava S, Radhakrishnan S, Dev V, et al: Balloon dilatation of atrial septum in complete transposition of great artery—A new technique. Indian Heart J 1987; 39: 298–300
5) Thanopoulos BD, Georgakopoulos D, Tsaousis GS, et al: Percutaneous balloon dilatation of the atrial septum: Immediate and midterm results. Heart 1996; 76: 502–506
6) Ali Khan MA, Mullins CE, Bash SE, et al: Transseptal left heart catheterisation in infants, children, and young adults. Cathet Cardiovasc Diagn 1989; 17: 198–201
7) Atz AM, Feinstein JA, Jonas RA, et al: Preoperative management of pulmonary venous hypertension in hypoplastic left heart syndrome with restrictive atrial septal defect. Am J Cardiol 1999; 83: 1224–1228
8) Justino H, Benson LN, Nykanen DG: Transcatheter creation of an atrial septal defect using radiofrequency perforation. Catheter Cardiovasc Interv 2001; 54: 83–87
9) Danon S, Levi DS, Alejos JC, et al: Reliable atrial septostomy by stenting of the atrial septum. Catheter Cardiovasc Interv 2005; 66: 408–413
10) Bacha EA, Daves S, Hardin J, et al: Single-ventricle palliation for high-risk neonates: The emergence of an alternative hybrid stage I strategy. J Thorac Cardiovasc Surg 2006; 131: 163–171
11) Alwi M: Management algorithm in pulmonary atresia with intact ventricular septum. Catheter Cardiovasc Interv 2006; 67: 679–686
12) Sano S, Ishino K, Kado H, et al: Outcome of right ventricle-to-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome: A multi-institutional study. Ann Thorac Surg 2004; 78: 1951–1957, discussion, 1957–1958
13) Ashburn DA, McCrindle BW, Tchervenkov CI, et al: Outcomes after the Norwood operation in neonates with critical aortic stenosis or aortic valve atresia. J Thorac Cardiovasc Surg 2003; 125: 1070–1082
14) Gaynor JW, Mahle WT, Cohen MI, et al: Risk factors for mortality after the Norwood procedure. Eur J Cardiothorac Surg 2002; 22: 82–89
15) Stasik CN, Gelehrter S, Goldberg CS, et al: Current outcomes and risk factors for the Norwood procedure. J Thorac Cardiovasc Surg 2006; 131: 412–417
16) Galantowicz M, Cheatham JP: Lessons learned from the development of a new hybrid strategy for the management of hypoplastic left heart syndrome. Pediatr Cardiol 2005; 26: 190–199
17) Akintuerk H, Michel-Behnke I, Valeske K, et al: Stenting of the arterial duct and banding of the pulmonary arteries: Basis for combined Norwood stage I and II repair in hypoplastic left heart. Circulation 2002; 105: 1099–1103
18) Bacha EA, Daves S, Hardin J, et al: Single-ventricle palliation for high-risk neonates: The emergence of an alternative hybrid stage I strategy. J Thorac Cardiovasc Surg 2006; 131: 163–171
This page was created on 2015-03-09T16:15:12.972+09:00
This page was last modified on 2015-03-23T20:50:03.808+09:00
このサイトは(株)国際文献社によって運用されています。