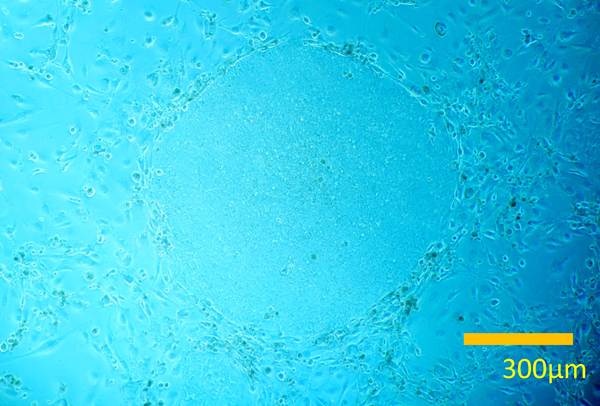
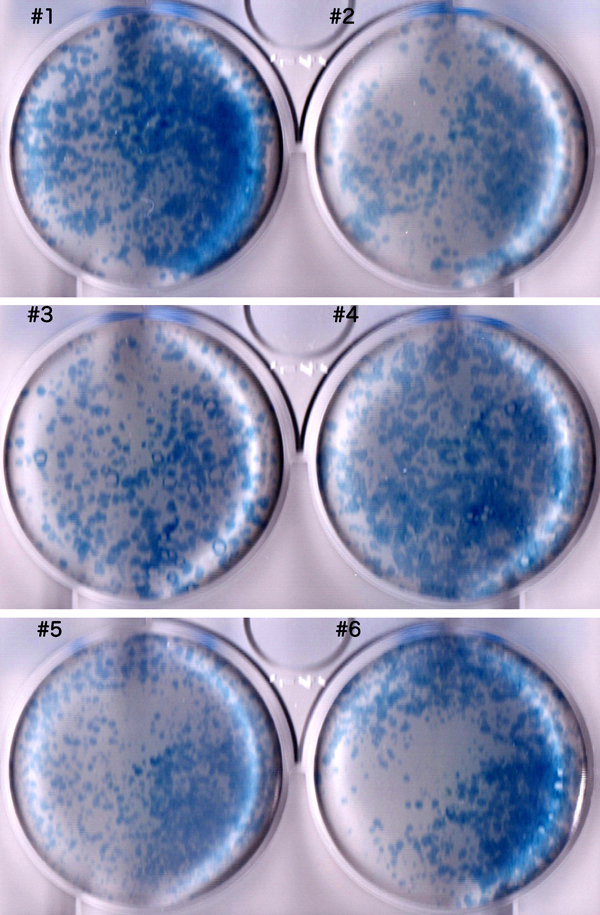
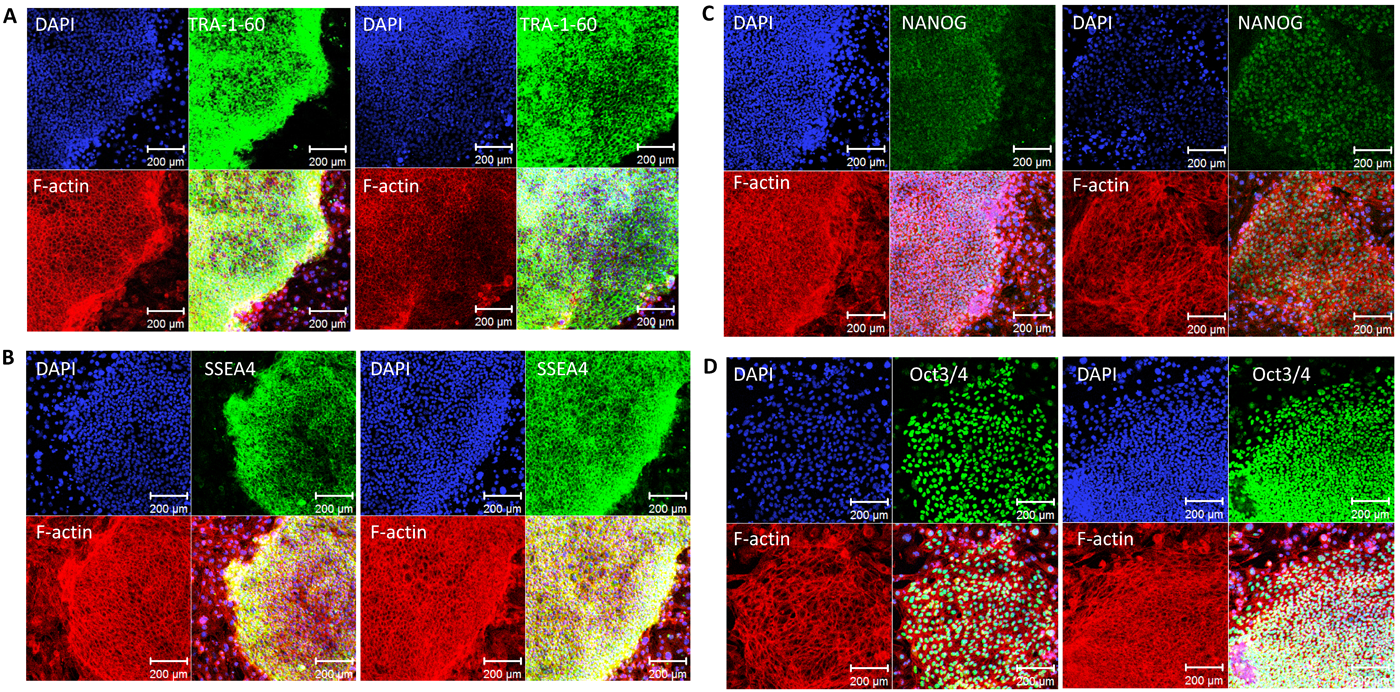
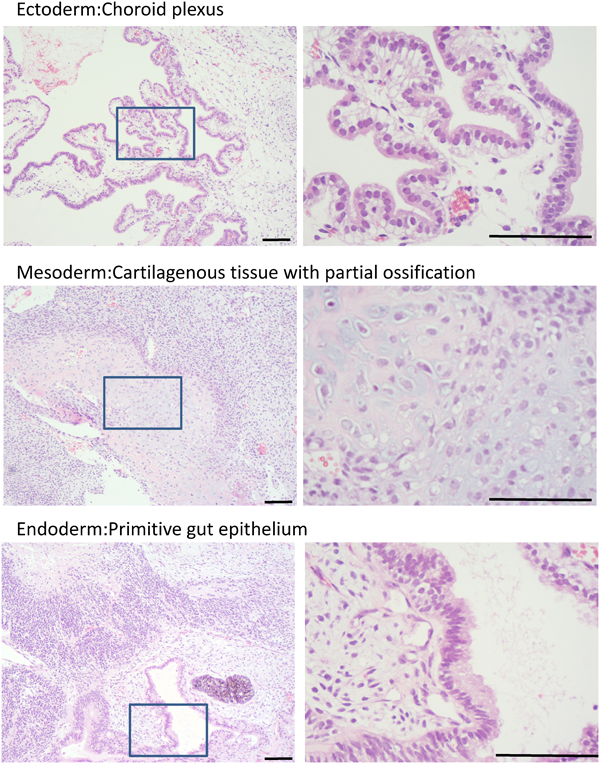
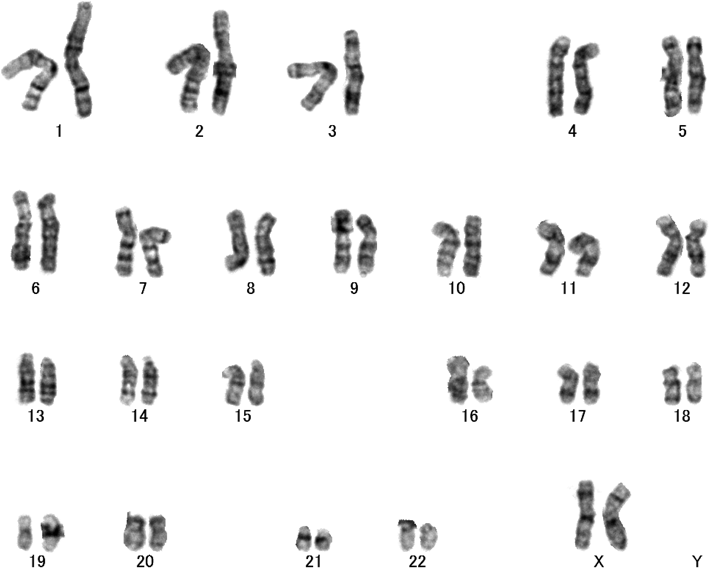
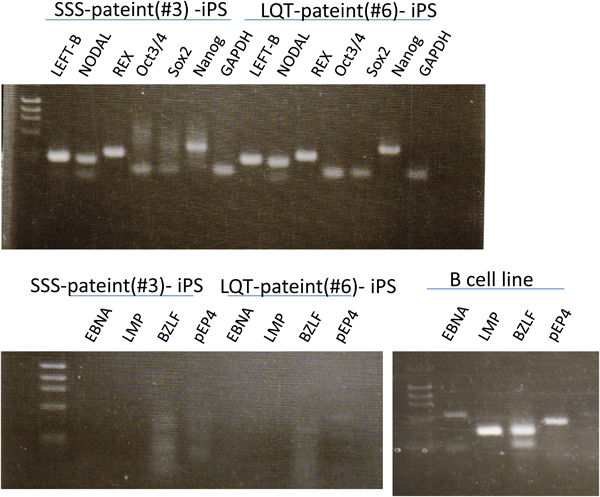
先天性心疾患における不死化B細胞株由来induced pluripotent stem(iPS)細胞の樹立Establishment and Characterization of Induced Pluripotent (iPS) Stem Cells Derived from Immortalized B Cells of Cardiac Channelopathy Patients
1 東京女子医科大学医学部循環器小児科教室Department of Pediatric Cardiology, School of Medicine, Tokyo Women's Medical University ◇ 〒162-8666 東京都新宿区河田町8番1号Kawada-cho 8-1, Shinjuku-ku, Tokyo 162-8666, Japan
2 京都大学iPS細胞研究所初期化機構研究部門Department of Reprogramming Science, Center for iPS Cell Research and Application, Kyoto University ◇ 〒606-8507 京都府京都市左京区聖護院川原町53番地Shogoin Kawahara-cho 53, Sakyo-ku, Kyoto-shi, Kyoto 606-8507, Japan
3 東京女子医科大学医学部病理診断科教室Department of Surgical Pathology, School of Medicine, Tokyo Women's Medical University ◇ 〒162-8666 東京都新宿区河田町8番1号Kawada-cho 8-1, Shinjuku-ku, Tokyo 162-8666, Japan
4 若松河田クリニックWakamatsu-Kawada Clinic ◇ 〒162-0054 東京都新宿区河田町10番7号 グリーンヒルズ河田町2階Green Hills Kawada-cho 2F, Kawada-cho 10-7, Shinjuku-ku, Tokyo 162-0054, Japan