1. National database
2000年4月以降,英国内でのすべての心臓手術症例は,Central Cardiac Audit Database(CCAD)により登録され,その情報の正確さが担保されるよう定期的に委員が各施設を訪問して精査される.このうち,先天性領域の情報と解析結果については,Society for Cardiothoracic Surgery in Great Britain and IrelandとBritish Congenital Cardiac Associationと提携してNational Institute for Cardiovascular Outcomes Research(NICOR)により公表されている.これは,公的機関であるHealthcare Commissionのウェブサイトから見ることができる3).
このうち,PVRが主要術式として登録された症例のデータを集計し,最近の動向を明確にする.
2. 一つの主要施設における概要
2013年の時点でNICORに公表されている先天性心疾患手術を扱う英国・アイルランドの施設のうち,Royal Brompton Hospitalは成人例・小児例ともに扱う主要施設の一つである(Table 1).当施設における2004年1月以降のPVR症例について臨床的要因を集計・解析する.
Table 1 The institutions in the United Kingdom and Ireland that have been registered at the National Database Statistics for Congenital Heart Surgery| Institution | Number of patients |
|---|
| Adolescent/Adult (over 16 years old) | Paediatric |
|---|
| Royal Brompton Hospital | 123 | 416 |
| Leeds General Infirmary | 91 | 380 |
| Bristol Children’s Hospital | 90 | 294 |
| Evelina Children’s Hospital | 80 | 430 |
| Southampton General Hospital | 78 | 300 |
| Freeman Hospital | 71 | 245 |
| Glenfield Hospital | 56 | 236 |
| Royal Victoria Hospital | 22 | 49 |
| Harley Street Clinic | 21 | 168 |
| Great Ormond Street Hospital | 15 | 701 |
| Birmingham Childrens Hospital | 11 | 496 |
| Alder Hey Hospital | 7 | 390 |
| Royal Hospital For Sick Children | 2 | 276 |
| Our Lady’s Hospital For Sick Children | — | 332 |
| Golden Jubilee Hospital | 143 | — |
| Queen Elizabeth Hospital Edgbaston | 127 | — |
| Manchester Royal Infirmary | 99 | — |
| University College Hospital | 82 | — |
| John Radcliffe Hospital | 25 | 1 |
| Liverpool Heart And Chest Hospital | 23 | — |
| Northern General Hospital | 16 | — |
| University Hospital Of Wales | 10 | — |
| St. George’s Hospital | 7 | — |
| King’s College Hospital | 2 | — |
| Hammersmith Hospital | 1 | — |
| The figures indicated the number of patients who underwent congenital heart surgery, either in childhood (under 16 years of age) or adolescence/adulthood in the fiscal year 2013. |
3. 一人のConsultant Surgeonの経験
Royal Brompton Hospitalには,3人の成人先天性心疾患手術を担当するConsultant Surgeonsがいる.上記の2004年1月以降の症例のうち,一人のConsultant Surgeonが経験したPVR症例の実状を提示する.
1. National database
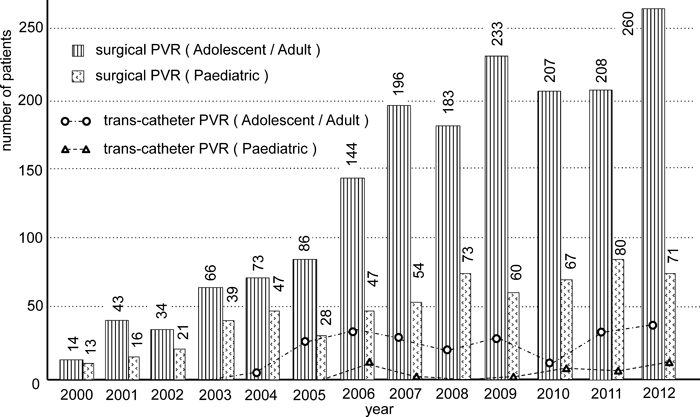
2000年4月から2013年3月までの間に,総計7,028例の成人先天性心疾患手術例(16歳以上)が登録された.このうち,1,747例(25%)がPVRであった.術後30日時点で生存1,725例・死亡18例(不明4例,追跡率99.8%,30日生存率99.0%),術後1年時点で生存1,516例・死亡31例(不明200例,追跡率88.6%,1年生存率98.0%).成人期のPVRの症例数は,過去10年間で著増した(Fig. 1).
同時期の小児期以前のPVRは総計616例で,30日生存率97.7%,1年生存率95.8%であった.症例数の年次増加は,成人例ほど顕著ではない.
経皮経カテーテル的肺動脈弁留置の症例数は,今のところ外科的手技のそれを凌駕していない(Fig. 1).成人期の経カテーテル的PVRは総計220例,術後30日時点で生存218例・死亡1例(不明1例,追跡率99.5%,30日生存率99.5%),術後1年時点で生存174例・死亡4例(不明42例,追跡率80.9%,1年生存率97.8%)であった.小児期での経カテーテル的PVRは総計40例で,これまでのところ1年後時点で死亡例は特定されていないが,追跡率は67.5%とやや低率であった.
2. 一つの主要施設における概要
2004年1月から2014年8月までの間に,1,356例の成人先天性心疾患に対する手術が施行され,そのうちの393例(29%)でPVRを行った.手術時年齢は,16~19歳が54例,20~29歳が133例,30~39歳が101例,40~49歳73例,50~59歳21例,60~69歳10例,70歳以上1例,平均32.2±11.7歳.
うち12例は初回胸骨切開手術で,先天性の肺動脈弁逆流(PR)5例(2例に心室中隔欠損(VSD),1例に心房中隔欠損(ASD)を合併),先天性の肺動脈狭窄(PS)5例,ファロー四徴(ToF)兼肺動脈閉鎖の修復に際したPVRが1例,VSDに関連した細菌性心内膜炎(IE)によるPRが1例であった.このIE症例(34歳)は,組織破壊が極めて高度で,4弁置換を必要とし,心不全のため術後48日目に死亡した.
他の5例は,再胸骨切開による手術であるが肺動脈弁に対する先行処置はなかった症例で,PR4例(ASD修復後,房室中隔欠損(AVSD)修復後,肺動幹形成術後,三尖弁形成術後,各1例),PS1例(VSD術後)であった.死亡例はない.
残りの376例は再胸骨切開による肺動脈弁再処置症例で,ToF(修復術後,242例),PS(78例,弁切開あるいは弁輪拡大術後,ASD合併13例・VSD合併11例を含む)が主要な生来病変であった(Table 2).このうち,6例(ToF修復後5例,肺動脈弁切開術後1例)がPVR術後2~20(平均7)日目に死亡した(手術死亡率1.6%,手術時年齢30~50(40±8)歳).
Table 2 Previous repairs performed in patients who underwent pulmonary valve replacement at the Royal Brompton Hospital between January 2004 and August 2014| Previous repair carried out | Number of patients |
|---|
| ToF | 242 |
| PS isolated | 54 |
| with ASD | 13 |
| with VSD | 11 |
| Ross procedure | 14 |
| Complex heart lesions |
| Rastelli procedure for TGA | 10 |
| ToF+pulmonary atresia | 8 |
| Double outlet right ventricle | 8 |
| Arterial switch for TGA | 6 |
| Absent pulmonary valve syndrome | 3 |
| Atrioventricular septal defect+ToF | 3 |
| Atrioventricular septal defect+PS | 2 |
| Truncus arteriosus | 2 |
| ToF: Tetralogy of Fallot, PS: pulmonary stenosis, ASD: atrial septal defect, VSD: ventricular septal defect, TGA: transposition of the great arteries. |
393例のPVRに使用した肺動脈弁は,生体弁227例,homograftが133例,生体弁付き導管33例であった.
PVRと同時の手術として,大動脈弁手技を行ったのは18例,僧帽弁手技が8例,その両方が2例であった.一方,同時に三尖弁形成術あるいは置換術を行ったのは57例であった.術前・術中抗不整脈手技を施行したのは26例.
3. 上記施設の一人のConsultant Surgeonの経験
2004年5月から2014年8月までの間に,117例の成人期PVRを行った.79例がToF修復術後,27例がPS解除後,2例が両大血管右室起始(DORV)修復後,4例がRoss手術後,5例は肺動脈弁に対する先行処置のない症例であった.このうち7例では,先行手術においてhomograftがRV-PA conduitとして用いられていたが,経カテーテル的PVRの適応としなかった.その理由は,conduitの感染の既往(3例),近傍を走行する冠動脈を圧迫する危険性(2例),そして肺動脈弁以外の心内構造に対する手術手技の必要性(2例)であった.
PVRには,109例で生体弁,5例でhomograft,3例で生体弁付き導管を用いた.三尖弁に対する同時手術は,27例で形成術を,2例で弁置換術を行った.また,右あるいは左肺動起始部の拡大形成術を11例に施行した.右心房内macro-re-entryに対するcryo-ablationを8例に,右室流出路起源の心室性不整脈に対する外科的抗不整脈処置を3例に,その両方を2例に施行した.
PVR手技は,88例において心拍動下に行った(体外循環時間39~244(97±39)分).他の29例では32~158(79±41)分の大動脈遮断・心停止を行った(体外循環時間52~278(138±59)分).大動脈遮断の理由は,7例が左心系の同時手技のため,8例がresidual ASD/VSDに対する閉鎖処置のため,残りの14例では閉鎖処置を必要としないまでもごく小さな心内シャントを経食道エコーのバブルテストにて認めたためである.術後に神経症状等,左心系への気泡混入による症状は皆無であった.
胸骨再切開に際し,8例で大腿動脈カニュレーションを行った.いずれも緊急的ではない計画的施行で,大腿動脈露出後,Gore Tex人工血管を端側吻合して人工血管に送血管を挿入することで,当該側下肢の虚血を回避した.
ペースメーカー植え込みは,すでに術前になされていた症例が5例,術前に洞結節機能不全あるいはII度の房室ブロックを診断されており計画的にPVRと同時に外科的植え込みを行ったのが3例.植え込み型除細動器(ICD)は,すでに術前に手技がなされていた症例が1例(ToF修復術後の18歳症例),PVR術後に設置したのが4例(ToF修復術後32歳,DORV術後22歳,DORV術後・外科的右室アブレーション術後37歳,右室切開のないPS解除術後46歳).
手術後早期死亡をToF修復術後PVRの2例に経験した.42歳女性例は,7年以上の心房細動(Af)歴があり,術前の右房圧が22~24 mmHg,術後集中治療室でも25~30 mmHgと高度の右心不全により術後3日目に死亡.大動脈内バルーンポンピングによる下肢コンパートメントシンドロームが病態悪化に拍車をかけた.50歳男性例も,10年以上の慢性Afで,高度の右室収縮不全であった.術前の右房圧は20~23 mmHg,PVR後閉胸時には10~15 mmHg.術後は比較的順調に経過し,術後1日目に人工呼吸器離脱,術後4日目に一般病棟へ戻ったが,術後6,8日目に一度ずつ5秒程度のself-terminating心室頻脈(VT)short runを認めたため,術後9日目(金曜日)のmulti-disciplinary meetingにて早期のICD植え込み方針(翌週月曜日予定)となった.ところが,その翌日(土曜日)にsustained VTが起こり,蘇生できずに死亡した.
これまでのところ,遠隔死亡はない.再手術を要したのは2例.PVR前からaplastic anaemia治療が行われていた31歳男性例は,生体弁感染が起こり,術後11カ月時にhomograftを用いて再PVRを行った.Ebstein malformationを合併していた58歳女性例は,弁尖硬化による生体弁機能不全が早期に起こり,術後2年8カ月時に機械弁を用いて再PVRを施行した.PVR後のカテーテル治療例はこれまでのところない.
胸部レントゲン写真上,PVR術前の心胸郭比(CTR)は55.2±5.6%で,術後には若干小さくなる傾向(53.2±5.7%,p=0.019)があった.術前のCTRについて,先行修復術において肺動脈弁輪が温存されていたかどうかについてみると,温存されていたグループ(PS解除27例中21例およびファロー修復後76例中10例)では52.6±4.8%に対し,弁輪切開後のグループでは56.3±5.6%(p=0.009)であった.
全117例中,軽度の側弯を16例,中等度を10例に,Harrington rodを要する高度病変を4例に認めた.側開胸による体肺シャント手術あるいは動脈菅閉鎖手術の既往があったのは13例で,そのうち側弯を認めない症例が10例(側弯なし87例中14%),軽度の症例3例(16例中19%)であり,側弯が中等度・高度の14例では側開胸手術の既往はなかったことから,側弯と先行側開胸との関連は明らかでなかった.
上記集計から,成人期PVR後の手術成績自体は,生存率の観点からは比較的良好であると期待できる.術後の機能的改善については,右室パラメーターの改善4)や心機能全体として左室側も含めた改善5)の観点から肯定的な意見がある反面,中長期に渡るPVRの恩恵について,右室機能の観点から懐疑的な意見もあり6),運動負荷心肺機能テストの結果が術後早期に劇的に改善するものでない7)ことも指摘されている.胸部レントゲン写真上の心胸郭比という極めて古典的で概略的な指標の上からも,PVR術後に劇的な改善があるのでないことは,今回の結果からも見て取れる.
PVRのタイミングについては,また意見が分かれるところであり,今後の研究が必要である2,8,9).PVRによる恩恵をより多く引き出すため,あるいはPVRをしても右室が回復しない段階にいつ到達してしまうのかわからない以上,早い時期に良好な肺動脈弁機能を備えるべきという意見がある.英国には,そうした将来の右心室機能保護の観点から16歳未満でのPVRを積極的に推し進めようとする小児循環器医もおり,英国CCADに示されるように2007年度以降50例/年以上のPVR症例数が記録されているのは,そうした背景を写すものと考えられる.手術時年齢が若くなると,再治療の可能性が高くなるであろうことは容易に想像できる10)ので,経カテーテル的再弁置換の定型化など,今後の治療の発展に期待することになる.外科的PVR後でない元来の右室流出路組織の症例に対する経カテーテル的PVRも黎明期にあり11),英国においても,経カテーテル的PVRが現在,年間40件以下程度の状況であるのが,今後,成人期・小児期ともに増加していく潜在性はある.そうした先駆的な治療は,その費用が英国の公的医療保険制度以外から支払われる状況下,例えば海外からの患者さんの要請に応じて遂行される機会がより多くなり,治療後1年での追跡率が80%に達しない理由となっていると推測される.
将来的に,経カテーテル的PVRが標準的手技となってくると,生体弁あるいはhomograftを用いた外科的PVRは,その妥当性を増すことになる.生体弁の機能期間が10年から15年とすると,その後に経カテーテル的PVRを繰り返すことで,再手術介入を20年,30年後,あるいはさらにそれよりも長い時期の後に遅らせることが可能かもしれない.もちろん,機械弁を用いたPVRの良好な中長期予後も報告されている12,13)が,患者さんの生涯を通してその機械弁が耐用するかどうかは症例の背景により様々で,機械弁設置後は人工弁機能不全が起きても経カテーテル治療は度外視となること,特に英国では患者さんからのワーファリン服用に対する抵抗が強いこと,を考え合わせると,生体弁による外科的PVRは適切な選択と言える.生体弁としてhomograftを選択するか,異種生体弁を選択するかは,外科医の洞察力と主義主張にかかっており,確かな科学的背景により決定されるわけではない.上記Royal Brompton Hospitalの症例数からもわかるように,homograftを好んで用いる外科医と生体弁を第一選択としている外科医に分かれる.個人的には,人工物リングによる確かな構造物による右室・肺動脈接合部の保護は,将来的な経カテーテル手技を保証するので,患者さんからの明確な要求や手術手技上の必要性がなければ,homograftを第一選択とすることはない.homograftは,年月が経ち硬く変性すれば,その後の経カテーテル治療に適するが,もし硬化が不完全であると,背側を走行する左冠動脈への圧排が懸念されることがあり,その場合には,現時点では経カテーテル治療の適応外と判断される傾向にある.それ以外に,homograft縫着のために右室心筋への切開,提供者の要因や保存状況によるhomograftの質の不均一性の問題もある.さらに,肺動脈弁のみならず右室流出路から肺動脈幹にかけて血流路壁はhomograft組織となるので,将来の外科的再手術がより大掛かりになる傾向がある.一方で,homograftのメリットは,血行動態的に優れていること(異種生体弁では若干のエネルギー損失を免れない)である.また,先行手術ですでにhomograftが用いられていた場合には,導管の置換という観点で手術がデザインしやすいという利点もある.歴史的にhomograftを多用してきた英国ならではの事情と言えるのかもしれない.
異種生体弁によるPVRに際しては,先行手術で拡大された右室流出路から肺動脈幹へかけて,十分な内径がある場合には,新たな右室心筋に対する切開操作を必要としない.これは機能不全状態にある右室にとってはメリットと考える.すでに先行修復術において,ためらわずに右室切開を大きく取ってある症例も少なくなく,それが旧来の欧米型術式であると実感する.それゆえにPVRの適応となる症例が多いのかもしれない.1980~1990年代頃に日本で頻繁に議論された経右房・経肺動脈的なファロー四徴修復14)の術後とはかなり様相が異なる印象である.近年でもいまだに,あるいは近年になってようやく肺動脈弁輪温存術式を熱烈に提唱する欧米のグループもある15,16)ことが,日本での先見性のある意見を知る者の目には不可思議にすら映る.ところが一方で,先行修復手術において,肺動脈弁輪が明らかに温存されていた症例も,少なからず外科的PVRの適応範囲とされていることがわかった.肺動脈弁逆流が進行して右室容量負荷が有意となるかどうかは,肺動脈弁温存・右室非切開といった手術手技要因のみならず,修復後の肺動脈弁尖の発育,肺血管抵抗,肺動脈壁コンプライアンス17),右室拡張能など,様々な要因に左右されるものと考えるのが妥当であろう.肺動脈弁輪を温存したからといって,将来のPVRを避けることができるとは限らない.胸部レントゲン写真上の心胸郭比で,肺動脈弁輪温存の恩恵がごくわずかに示唆されるのは理不尽ではないが,肺動脈弁輪温存・肺動脈弁形成に熱狂的な将来展望を期待できるほどのものではないと考える.
肺動脈弁に関連した侵襲的抗不整脈治療は,その効果はある程度期待できるであろう18)が,当施設の経験例ではそれほど高頻度ではなかった(393例中26例,6.6%).これには,電気生理心臓内科医が,PVR前後での経カテーテル的アブレーションにどれくらいこだわりを持つかにもよるかもしれない.ICDについては,心室性不整脈による突然死の危険性が厳然とあること18–20),実際に自験例の中にも苦い経験があることから,今後さらにその適応とタイミングを明確にしていく必要があると考える.
PVR手技を,心拍動下に行うかどうかは議論のあるところである.心筋虚血を避ける観点からは好ましいが,万が一,気泡が心内遺残短絡を通して左心系に混入した場合には,神経学的症状等の重篤な合併症を引き起こす可能性があることを肝に命じておかなければならない.経食道エコーと大動脈基部ベントにより,左心系への気泡混入がないことをモニターすることは欠かせず,万が一に備えて,いつでも直ちに大動脈遮断できる準備をしておくことが肝要である.そうした万が一の事態を避ける目的で,常に大動脈遮断・心停止下にPVRを施行するグループがあるのもうなずける.
側弯症の頻度が比較的高いことは,追加的な注意事項である.有意な胸郭変形のある症例では,肺機能に与える影響,ひいては肺血管抵抗に与える影響にも留意する必要がある.外科的には,手術時体位や右室流出路への到達の難易度について配慮する必要も生ずる.
引用文献References
1) Babu-Narayan SV, Diller GP, Gheta RR, et al: Clinical outcomes of surgical pulmonary valve replacement after repair of tetralogy of Fallot and potential prognostic value of preoperative cardiopulmonary exercise testing. Circulation 2014; 129: 18–27
2) O’Byrne ML, Glatz AC, Mercer-Rosa L, et al: Trends in pulmonary valve replacement in children and adults with tetralogy of Fallot. Am J Cardiol 2015; 115: 118–124
3) https://nicor4.nicor.org.uk/CHD/an_paeds.nsf/vwContent/home
4) Piijuan-Domenech A, Pineda V, Castro MA, et al: Pulmonary valve replacement diminishes the presence of restrictive physiology and reduces atrial volumes: a prospective study in tetralogy of Fallot patients. Int J Cardiol 2014; 177: 261–265
5) Ferraz Cavalcanti PE, Sa MP, Santos CA, et al: Pulmonary valve replacement after operative repair of tetralogy of Fallot: meta-analysis and meta-regression of 3118 patients from 48 studies. J Am Coll Cardiol 2013; 62: 2227–2243
6) Hallbergson A, Gauvreau K, Powell AJ, et al: Right ventricular remodeling after pulmonary valve replacement: early gains, late losses. Ann Thorac Surg 2015; 99: 660–666
7) Sterrett LE, Ebenroth ES, Query C, et al: Why exercise capacity does not improve after pulmonary valve replacement. Pediatr Cardiol 2014; 35: 1395–1402
8) Lee C, Jacobs JP, Lee CH, et al: Surgical pulmonary valve insertion: when, how, and why. Cardiol Young 2012; 22: 702–707
9) Lewis MJ, O’Connor DS, Rozenshtien A, et al: Usefulness of magnetic resonance imaging to guide referral for pulmonary valve replacement in repaired tetralogy of Fallot. Am J Cardiol 2014; 114: 1406–1411
10) Sabate Rotes A, Eidem BW, Connolly HM, et al: Long-term follow-up after pulmonary valve replacement in repaired tetralogy of Fallot. Am J Cardiol 2014; 114: 901–908
11) Meadows JJ, Moore PM, Berman DP, et al: Use and performance of the Melody trans-catheter pulmonary valve in native and post-surgical, non-conduit right ventricular outflow tracts. Circ Cardiovasc Interv 2014; 7: 374–380
12) Freling HG, Van Slooten YJ, van Melle JP, et al: Pulmonary valve replacement: twenty-six years of experience with mechanical valvar prostheses. Ann Thorac Surg 2015; 99: 905–910, Epub ahead of print
13) Yang CC, Wei HJ, Hsieh SR, et al: Excellent mid-term durability of the On-X mechanical aortic valve in the pulmonary position with a low international normalized ration. J Heart Valve Dis 2014; 23: 333–337
14) Kawashima Y, Kitamura S, Nakano S, et al: Corrective surgery for tetralogy of Fallot without or with minimal right ventriculotomy and with repair of the pulmonary valve. Circulation 1981; 64: II147–II153
15) Boni L, Garcia E, Galletti L, et al: Current strategies in tetralogy of Fallot repair: pulmonary valve sparing and evolution of right ventricle/left ventricle pressures ratio. Eur J Cardiothorac Surg 2009; 35: 885–889
16) Rao V, Kadletz M, Hornberger LK, et al: Preservation of the pulmonary valve complex in tetralogy of Fallot: how small is too small? Ann Thorac Surg 2000; 69: 176–179, discussion, 179–180
17) Kilner PJ, Balossino R, Dubini G, et al: Pulmonary regurgitation: the effects of varying pulmonary artery compliance, and of increase resistance proximal or distal to the compliance. Int J Cardiol 2009; 133: 157–166
18) Sabate Rotes A, Connolly HM, Warnes CA, et al: Ventricular arrhythmia risk stratification in patients with tetralogy of Fallot at the time of pulmonary valve replacement. Circ Arrhythm Electrophysiol 2014; Epub ahead of print
19) Gatzoulis MA, Balaji S, Webber SA, et al: Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000; 356: 975–981
20) Harrild DM, Berul CI, Cecchin F, et al: Pulmonary valve replacement in tetralogy of Fallot: impact on survival and ventricular tachycardia. Circulation 2009; 119: 445–451