A. PDE5阻害薬(PDE5-I)
1. Sildenafil(小児IIb-C)
1990年代初頭に開発されていたPDE5-Iのprototypeは,勃起不全erectile dysfunction(ED)においては陰茎海綿体だけでなく“肺循環へ好ましい作用がある”,と囁かれていた.その原型となったのは,ZaprinastやDipyridamoleなどの血小板に優位に作用するPDE3阻害薬である.同時にこの頃心筋細胞と血管壁に作用するPDE3阻害inodilatorとしてamrinone,milrinone,eplerenoneが開発されていた.Zaprinastは,NO吸入の効果延長と増強効果という補助的作用があった.臨床の場でsildenafil(シルデナフィル)はEDに対して1999年1月に我が国で承認されたが,PAHにはRevatio(レバチオ)として2008年1月25日に承認された.またtadalafilはAdcirca(アドシルカ)として2009年10月16日に承認された.近年の多剤併用療法では,このPDE5-Iが肺血管選択性に優れ,全体的な有用性,安全性,安定性,薬物相互作用の程度,耐性のなさ,投与中断率等からみても,治療の中心的位置を占める5,6).
1)薬物相互作用Sildenafilは肝臓のP450 CYP3A4で79%,CYP2C9で20%が代謝される.tadalafilはほとんどがCYP3A4で代謝されるため,両者とも多くの薬剤との相互作用に注意して治療継続をしなければいけない.たとえばbosentanとの併用で,sildenafilのAUCは0.4に,Cmaxも0.4に低下する.一方,tadalafilのAUCは0.6,Cmaxは0.7とsildenafilに比し若干影響が少ない.ACE-I,ARB,β遮断薬,サイアザイド,Ca拮抗薬などとの併用では概ね血圧低下が観察されるので,特に冠疾患合併症例,冠血流低下には注意する.その意味ではtadalafilはsildenafilよりもbosentanとの相互作用が若干弱く,用量調節や副作用による心不全増悪が回避できる理論上の可能性はあるが,臨床上の差は報告されていない.1日1回投与が2~3回投与に比し優れた効果を発揮したという確証もない.β遮断薬はCYP-3A4を介して,sildenafilの排泄を低下させ生物学的活性を増加させる7).
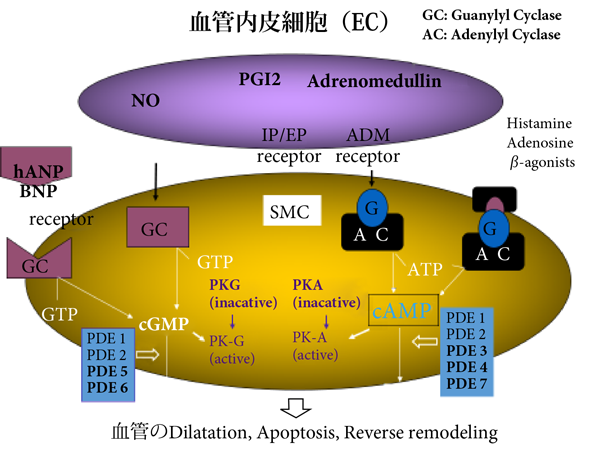
PDEのsubtypeはこれまでに11種類が確認されている.sildenafil,vardenafilとtadalafilはEDに対して承認されているPDE5-Iで,特異的に細胞内cGMPが上昇する.cGMP産生系は細胞内ではcAMP産生系との直接的なcross talkはないが,病的心筋では存在すると報告されている(図1).組織内分布は,肺血管,陰茎海面体のほか,消化管の平滑筋細胞,血管平滑筋や血小板で,PDE6よりはかなり弱いが網膜,噴門括約筋にも分布する.そのため,PDE5-Iの副作用として青色視野や胃食道逆流現象があるが,tadalafilはPDE5の選択性が比較的高い.視野の異常が出現しやすいPDE6には,sildenafil,vardenafilの選択性が低く,青色視野が出ることがある.
2)成人領域の知見成人PAHへの経口sildenafilによるSUPER-1試験(12週間),とその延長試験SUPER-2(平均1,242日)では,NYHA-FCや6分間歩行距離(6MWD)の改善が長期間継続している.この試験では,20 mg×3回/日が有効かつ死亡例が少なかったが,用量設定別の比較試験ではないので,80 mg×3回/日の長期効果は論じられない8).成人PAHでは,bosentan治療にsildenafilを追加すると,16週間後では右室心筋量,BNP,6分間歩行距離(6MWD),心拍出量CIが改善している(SERAPH研究)9).結論として,sildenafilはbosentanやPGI2と併用すると症例によっては更に有効であるとしている10,11).
成人でsildenafilとNO吸入はV/Q mismatchを改善させるが,PGI2はV/Qmismatchを悪化させ,かえって酸素化が悪くなることがある12).成人では,心拡張不全,収縮不全,収縮能が保たれた心不全(preserved systolic function)の治療にも一部で長期効果が認められている13).その他,抗癌剤心筋症(Doxorubicin)の予防・治療,抗癌剤の抗腫瘍効果増強,Duchenne型ジストロフィー合併心筋症でも有効性の報告がある14).
成人ED症例では,1)血圧低下はごく僅かであり,2)運動時間,酸素消費量や冠動脈のflow reserve,左前下行枝のflow velocity,上腕動脈の血流依存性拡張FMDがいずれも増加,3)心不全における最大運動時心拍数,大動脈stiffneff,肺動脈血圧/肺血管抵抗値は低下する15).肥大した右室心筋では,正常では出現していないはずのPDE5活性が増加しており,PDE5-I投与によるcGMPを介するcross talkにより,肥大と収縮様式も改善してくるとされる16).
3)小児領域の知見海外での小児PAHの適応については2011年5月欧州EMA(European Medicines Agency)で承認されているが,米国FDAの承認は得られていない.現在日本で小児期の臨床試験が開始されているが,PAHへの用法・用量は,
- ① 20 kg以下:10 mg×3回/日
- ② 20 kg以上:20 mg×3回/日
で行われている.
小児PAH14例(IPAH; 4例,CHD-PAH; 10例,中間年齢9.8歳)における平均10.8ヶ月観察後のPVRは,15 Wood·Uから12 Wood·Uに低下していたとする結果がある17).
Barstらによるdose ranging study(16週のSTARTS-1,延長試験のSTARTS-2)における用量設定(/回)は,
- ① 8 kg以上~20 kg: 10 mg
- ② 20 kg以上45 kg未満:20 mg
- ③ 45 kg以上:40 mg
であり,各1日3回投与では,中等用量が有効かつ安全で,高用量つまり8 kg以上20 kg; 20 mg,20 kg以上45 kg未満:40 mg,45 kg以上;80 mgの1日3回では死亡率が高いという結果だった18).特に,高用量は長期使用で1~17歳のPAHによる死亡例が多いので“要注意”との勧告がFDAから提出された19).
それに対して米国胸部疾患学会(ATS)は,小児も成人も更なる長期予後の成績と用量の調査が必要ではないかと述べている.すなわち低用量の症例においては,有意に高いriskは見られていないからである20).Peak VO2は中等用量で有意に改善,平均肺動脈血圧mPAPは高用量,肺血管抵抗PVRは中等用量と高用量で低下している.しかし,STARTS-1の延長試験であるSTARTS-2では,3年後にsildenafil単独療法の高用量群の生存率が88%と有意に低く,高用量のHRは3.5倍と高かった.EMAでは低用量は推奨するが高用量を推奨しない形で2011年に承認されているが,FDAでは2012年に1歳から17歳の小児への慢性的使用自体に強い警告が出され,否定的に論じていた21,22).
Sildenafil高用量のRisk最新の米国小児科学会AAPの見解では,禁止はしないが,極めて慎重な低用量の投与cautious useが必須であると警告するように変化してきた23).これに反して,PPHN(Pediatric Pulmonary Hypertension Network)は,cautious useが必須であるとしているが24,25),sildenafilを突然中止することは危険であり,“注意して少量で使用する”と推奨しなおしている.その証拠に,小児期のbosentan単独療法で悪化した症例へのsildenafil追加療法は,増悪を改善できるとの論文もある26).
表3に,体重別の使用量を示す27).
表3 Sildenafilの用量18,25)(中~高用量は推奨されない)| 体重 | 臨床試験START-1での1回投与量(各3回/日投与) |
|---|
| 低用量 | 中等用量 | 高用量 |
|---|
| >8~20 kg | 適用なし | 10 mg | 20 mg |
| >20~45 kg | 10 mg | 20 mg | 40 mg |
| >45 kg | 10 mg | 40 mg | 80 mg |
数少ないCHD術後の使用に関して,使用量0.9±0.3 mg/kg/回の急性負荷1時間後での試験結果では,mPAP/SAP比が低下する症例,SpO2が増加する症例,mPAPが低下する症例の3種類が観察されている28).
また,小児期CHD術後のPAHに対して,0.5 mg/kg,1.0 mg/kg,1.5 mg/kg,2.0 mg/kg/回をそれぞれ4時間毎に胃チューブから注入した研究では,各用量でのdose-effectはなく,PAPが選択的に低下し,4つの投与量では同じ結果であった29).さらに,Fontan術後の27症例(年齢;16歳から32歳),に対する0.7 mg/kg/回投与の1時間後の観察では,peak VO2,peak exercise CO,peak exercise pulmonary blood flow indexが改善している30).二重盲検長期試験でもFontan症例の運動耐容能が改善している31).またFontan術後の蛋白漏出性胃腸症にも効果があるとの報告がある32).
b. 新生児期PH新生児のBPD合併PAHへの投与では,PAPの低下はあるが酸素化の改善はないとの報告がある33).先天性横隔膜ヘルニア合併PPHN(n=7)では,NO吸入不応例においても,生存例5例では呼吸器の設定が顕著に改善し,右心拍出量は増加し,PVR,PAPとも投与後1.5~4時間は低下した34).PPHNとCHD合併PAH,術後PAHに対する静注用sildenafilの臨床試験での有用性も報告されている35).また肺疾患合併乳児のPAHに対しても,88%の症例で効果があり,酸素化の低下はなかったとの報告がある36).ラットの実験的胎児横隔膜ヘルニアへのsildenafil胎内投与試験では,肺血管床の増加,右室肥大改善,肺のeNOS活性が増強した37).
5)副作用小児193例の文献reviewで,0.3~8 mg/kg/日の投与において,低血圧5.9%,勃起2.6%,鼻閉2.3%,頭痛1.6%,眩暈1.2%,頑面紅潮1.2%などが見られている38).
PDE5-Iのclassに共通するblurred vision,light sensitivity,color tinge以外の副作用で重要なのが非動脈炎性虚血性視神経症Non arteritic ischemic optic neuropathy(NAION)である.50歳以上の成人では10万人中5~10例とされているが,小児では報告がない.成人でも糖尿病,高血圧,高脂血症,閉塞性睡眠時無呼吸症候群に圧倒的に多く合併する39).難聴(感音性)は,10万人に2~5人とされているが,sildenafil服用後にも難聴の危険性が報告されている40).
PDE5-Iは血小板中のPDE5に作用してcGMPの増加を介して血小板の活性化を抑制する.つまり出血傾向が生じる.これは,鼻甲介組織が多量にPDE5を含むこと,鼻の粘膜血管拡張,分泌及び粘液線毛クリアランスにNOが関与していることから,PDE5-Iが鼻甲介の血流を増加させる可能性がある.特にwarfarin,PGI2投与下では出血傾向が強くなる.成人では勃起erectionが10%で報告されているが,2~3歳の幼児や若年小児でも時に経験される41).併用も含めた最も多い副作用は,消化管症状(嘔気,逆流等)(22%)で,次いで自然の勃起(22%)である.併用療法では,より副作用が強いとされる42).
2. Tadalafil(小児IIb-C)
1)成人領域の知見成人EDでのpeak plasma concentrationは2時間で到達し,T 1/2は17.5時間と長い43).成人PAH(平均53~54歳)ではPHIRST-1(16週),とPHIRST-2試験(52~68週)が行われ,20 mg/日よりも40 mg/日の投与群が若干NYHA-FCの増悪が少なかったが,概ね両群とも6MWDは52週後でも保たれていた44,45).また13歳から42歳までのEisenmenger症候群(ES)23例では90分後の急性効果(PVR低下;24.8±8.5から19.2±8.2 Wood·U)と,12週後の亜急性効果があったとされている46).
Bosentanの追加add-onによる付加的効果は成人でも証明できなかった44,47).
2)小児領域の知見小児で唯一の臨床試験における設定用量は平均1.0±0.4 mg/kg/minであり,全33例中29例はsildenafil 3.4±1.1 mg/kg/日からの薬剤変更であった.理由の多くはsildenafil 20 mg×1日3回投与と比較して,成人でtadalafil 40 mg/1日1回投与の利便性のみである.mPAP,PVRI,Rp/Rsはtadalafilに移行後少量であるが有意に改善していた.また33例中2例が副作用のため中断されていたが,持続時間が長い分かえって副作用も長くなる傾向がある48).小児に対する錠剤の粉砕に関しては安定性が問題となるが,少なくとも4週間までは温度,湿度,光に対して安定との報告がある49).
最近の小児期の報告では,tadalafil 0.97±0.41 mg/kgの投与は薬理学的に適切な血漿中濃度に達し,年齢(平均3.58歳)やbosentan併用,eGFRに左右されなかったとの結果がある50).
3. Vardenafil(III-C)(PAHに未承認)
肺動脈選択性は低く,PHに対して良好とする報告はない.新しいPDE5 modulatorとしての,udenafil,mirodenafil,avanafilはPAHに対する報告がない51).成人での冠動脈疾患においても,PDE5-I投与による運動時間の低下や増悪はない52).最近では,PAHのみならず,冠動脈疾患,高血圧,糖尿病などで酸化ストレス減少や血栓凝固能抑制,神経疾患の回復にも効果を示すとされている53).PDE5-I製剤の特徴を表4に示す.そして,PDE5-Iの全身臓器に及ぼす作用と副作用を図2に示す.
表4 PDE5-IのPAHへの薬理学的効果の比較54–59) | Sildenafil | Tadalafil | Vardenafil(PAHに適応外) |
|---|
| T1/2半減期 | 3~5時間 | 14~15時間 | 3.9~4.8時間(ED) |
| (健常成人) | 3.7 | 17.5(20 mg),15(40 mg) | 3.3~3.9 |
| 効果発現開始 | 14~20分 | 16分(ED)(20 mg) | 16分 |
| Tmax(時間) | 1(0.5~2) | 3 | 0.66~0.92 |
| 0.83 | | |
| 持続時間ED | 4 | 36 | >4(動物モデル) |
| PAH成人 | | データなし | |
| PDE 5:6の選択性 | 6.8(10) | 780 | 16 |
| 視覚異常 | 2~5% | 0.8% | 0.1~1%未満 |
| 薬物相互作用(AUC/Cmax) |
| Clarithromycin | 2.3/2.4 | データなし(併用禁忌) | データなし |
| Grape fruit Juice | 0.8 to 2.6 | データなし | データなし |
| CYP3 A4 Inducers | | 影響あり | データなし |
| Bosentan | 0.4/0.4 | 0.6/0.7 | |
| 肺選択性 | あり | あり | なし |
| 酸素化改善 | あり | 悪化リスク少 | なし |
| 高脂肪食でのΔCmax(%) | 29%低下 | 変化なし | 18~50%低下 |
| QT延長 | 6 msec(50 mg) | 2.8 msec(100 mg) | 8 msec(10 mg) |
| AEによる治療中断率(EDにて) | 2.5% | ≧2.0% | 1~2% |
| 併用禁忌薬 | 硝酸薬 | 硝酸薬,α遮断薬* | 硝酸薬,α遮断薬,NO供与体 |
| 副作用の特徴 | 頭痛,顔面紅潮,胸焼け,鼻閉,下痢3%,めまい2% | 頭痛,顔面紅潮,浮動性めまい,背部痛4.6%,四肢痛2.8%,筋痛5% | 頭痛,顔面紅潮,胸焼け,CK上昇2%,Flu症状3%,副鼻腔炎3%,めまい2% |
| 食事 | 関連する | 関連しない | 関連しない |
| 便中/尿中排泄(%) | 81/13 | 61/36 | 91~95/2~6 |
| 代謝 | 肝臓(Active) | 肝臓(Inactive) | 肝臓(Active) |
| 頭痛 | 16% | 27.6% | 6.8~22% |
| 顔面紅潮 | 10% | 6.2% | 5~13% |
| 消化不良 | 7% | 4.3% | 0.7~6.7%(嘔気2%) |
| 鼻閉 | 4% | 3.1% | 1~6% |
| 視覚異常 | 3% | 0.6% | ? |
| その他 | 発疹(1%未満),稀に,鼻出血,尿路感染,持続勃起等 | | 副鼻腔炎2.8~17%,Flu症状0.01%,めまい0.11%,CK上昇0.52% |
| * 硝酸塩またはNO供与剤,sGC刺戟薬,CYP3A4を強く阻害するかまたは強く誘導する薬剤. |
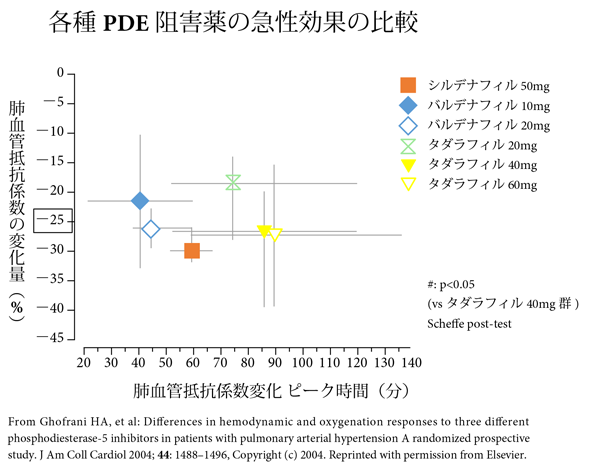
成人PAHにおいて,3種のPDE5-Iの中で最も即効性があるのはvardenafil,肺循環に選択性があるのはsildenafilとtadalafil,最もQTcが延長するのがvardenafil,酸素化が改善されるのはsildenafilのみであった.3種類のPDE5-Iの各用量に対するPVRの変化率を図1に示す59).視力への影響60),聴力への影響61)については,成人ではある程度の結論が出ているが,幼少時期では十分注意して使用すべきと思われる62).肺血管拡張作用については投与後最大作用時間と肺血管拡張能の図3を参照されたい.
1)SildenafilとTadalafilの比較成人PAHのnaïve症例では6MWDにおいてsildenafil; +47 m,tadalafil; +44 mでほとんど差がなかった.sildenafilで効果がない症例はtadalafilに変更するとよいという質の高いエビデンスは全くない62).
小児期の後方視的な比較では,6MWDの前後のSpO2がtadalafilで若干高いとの報告があるが,副作用の頻度なども現時点では基本的にはほぼ同様と考えてよい.
種類は同じであるが若干sildenafilに副作用が多く,視覚異常が有意に多いとの意見もある.腎障害に関しては,tadalafilは便中排泄60%,尿中排泄35%であり,腎不全合併時若干影響を受ける.sildenafilはほとんど(80%)が便中排泄である.tadalafilはambrisentanとの併用ではほとんど血中濃度に変化はないが,bosentanとの併用では血中濃度が40%低下する.一方bosentanの血中濃度は全く変化しない.またsildenafilはbosentanとの併用で血中濃度が63%低下するが,bosentanの血中濃度は50%増加する.
2)QT延長作用心電図上のQTcはPDE5-I使用で4~8 msec程度延長するがtorsade de pointesを生じた報告はない.vardenafil投与で比較的延長し,QT延長症候群やある種の抗不整脈薬(ClassIA; quinidine, procaineamideとClass III; amiodarone, soalol)との併用,fluoroquinolone投与で注意が必要である48).我が国ではsildenafilとvardenafilはQT延長症例には禁忌とされている.
小児のPAHやESにおける有用性と副作用の比較では,服用回数以外の臨床効果は概ね差がないと考えてよい62).最近では,Tandem mass spectrometerによる測定が可能となり,50 µLでbosentan,ambrisentan,sildenafilとtadalafilを同時に5分間で計測できるようになったと報告されている63).3剤の肺血管拡張作用に関する実験では,tadalafilのみが有意に低酸素誘導性PHを軽減し,また血管壁のサイトカイン産生,特にTNF-αとIL-1βの発現を軽減させ抗炎症作用を発揮している64).
4. NO刺激薬Riociguat
成人領域では,soluble guanylate cyclase(sGS)刺激薬であるriociguat(アデムパス)が,有意にPAH(PATENT-1試験,PATENT-2延長試験)とCTEPH(CHEST-1試験)に効果があることが示された.すなわちPVR(p<0.001),NT-proBNP(p<0.001),WHO-FC(p=0.003),増悪までの時間time to clinical worsening(p=0.005)と呼吸困難のBorg dyspnea score(p=0.002)が改善している.Riociguatは急性効果では,NO吸入よりもさらに,mPAP低下,PVR低下,CO増加が強かった.小児領域への臨床試験の開発は未定であるが,強く望まれる65,66).
B. Endothelin(ET)受容体拮抗薬(ERA)
1988年3月31日付Nature誌にYanagisawaらが発表した58)ERAについては,最終的にRoche社のRo-0203(bosentan)だけが安全で高い有効性が認められるとして開発されてきた67).ETAとETB受容体拮抗薬のbosentan(トラクリア)は2005年4月に我が国で満を持して承認された.その後,2010年7月にはETA受容体選択的拮抗薬であるambrisentan(ヴォリブリス)が承認された68).未だにAまたはB受容体阻害薬のどちらがどの疾患のどの重症度に有効かは結論が出ていない69).
1. Bosentan
現時点でERAは,PAHのfirst-lineもしくは,add-onとして広く認められた治療薬である70).その中でもbosentanは,ETA受容体とETB受容体の双方に作用する両受容体拮抗薬dual receptor antagonistである.
投与後の最高血中濃度到達時間Cmax: 3~4時間とされている.半減期(T1/2):は62.5 mg1回投与で4.3時間(3.7~5.0),125 mg1回投与では3.6時間(3.0~4.3)との資料がある(社内資料).またsildenafilとの同時投与では血中濃度が変化する“drug interaction”がある.
1)成人領域の知見成人では既に海外の数ヶ国でPAH治療薬として承認され,現在世界で28,000症例以上に使用されているという.我が国成人例における臨床試験の結果でも有用と評価され,2005年4月に承認されている71).対象となる疾患は特発性PAHと,膠原病(強皮症)性PAH72),CHD合併PAH(ES)73)等のいわゆる二次性PAHである.現時点で小児領域での承認はなく所謂“off-label”であるが,徐々に小児領域での有用性のエビデンスも蓄積されてきた74,75).
ETは,血管内皮細胞,血管平滑筋細胞,線維芽細胞,心筋細胞に作用し,細胞増殖,肥大,血管収縮に作用し,また血管透過性亢進,催炎症作用を持っている76,77).血中では,PAH,強皮症,肺線維症等で上昇しており,PAHでは予後,重症度と密接に関連している.健常状態では,血管内皮細胞上のETB受容体は一酸化窒素,PGI2産生を介して血管平滑筋には弛緩性に作用している.一方ETA受容体は血管収縮,細胞増殖・肥大性に作用し,二つの受容体により血管のtonusが保たれている.PAHではこの,内皮細胞上のETB受容体の濃度が減少し,血管平滑筋細胞のETB受容体が増加して,血管収縮性・細胞増殖性優位に作用している.
CHDではET-1の血中濃度と術前・術後の肺動脈圧が相関し78),Down症候群では有意に術後のET-1濃度がnonDown症例より高い(n=16).そして術後24時間以内に術前まで低下しない症例が多い79).小児腎疾患と慢性非透析症例では著しく血中ET-1濃度が高い80).成人では,bosentanは蛋白尿やET-1の産生を抑制する効果があるとされる報告が多い.CHD-PAHやIPAHでは血中ET-1が高いが,人工心肺装着開心術では,大動脈遮断解除後から有意に肺静脈血で高値となり,術後12時間あたりまで持続する.このET-1の肺からの産生もしくは過剰な遊離が術後の肺合併症・肺再潅流障害reperfusion injuryの一因と考えられている81).
PAH世界シンポジウム(2003年イタリア,ベニス)において,bosentanのPAH治療における有効性のエビデンスのグレードは「A(複数の無作為割付比較試験またはメタアナリシスデータ)」と認められ,NYHA-IIIの患者には第一選択薬として推奨されている.
WHO-III~IVで既存の治療薬に加えた短期(16週)の治療成績でも有意な効果が得られている(The Cochrane Database of Sytematic Reviews. Liu C, Chen J. Endothelin receptor antagonists for pulmonary arterial hypertension. The Cochrane Database of Sytematic Reviews(http://www3.interscience.wiley.com/cochrane, 2004).
また小児ではないが,眼底メラノーマの手術後に血中高ET値を伴うPAHクリーゼを来した症例も経験されている82).ERAにはメラノーマの腫瘍増殖をin vitroで抑制する作用も指摘されている.
2)小児期の知見本邦では2005年4月に成人PAHでNYHA-III,-IVに承認されたが,小児へのbosentan使用の臨床試験はBarst RJらによる2003年が最初である83).
欧州での小児の用量設定は表5に示す量である(BREATHE-3).PAH全19例(内訳はPAH10,CHD-PAH: 9)(WHO-II~III)の,12週後の治療結果では,mPAPは平均−8 mmHg低下,COは0.5 L/min増加,PVRは−300 dyne(SVRも−426 dyne)低下していた.1例に心不全増悪,1例に肝機能上昇が見られた.薬物動態特性は成人とほぼ同様であった.T1/2半減期は,反復投与時5.3~6.0時間で健康成人とほぼ同様であった.Epoprostenol使用によってもbosentanの薬物動態には影響がなかった84).
表5 FUTURE-1試験で使用された小児投与量の目安| 体重(kg) | 初期用量(4週間) | 維持用量(その後) |
|---|
| 10≦~≦20 | 31.25 mg | 1日1回 | 31.25 mg | 1日2回 |
| 20<~≦40 | 31.25 mg | 1日2回 | 62.5 mg | 1日2回 |
| >40 | 62.5 mg | 1日2回 | 125 mg | 1日2回 |
米国では,12歳以上でBW40 kg以下の症例では,初回・維持とも62.5 mg1日2回が望ましいとされている.さらに長期の試験では,全86症例,平均11.5歳,PGI2併用44例,併用なし42例,平均14ヶ月の後方視的観察で,死亡5例(6%),mPAPは−7 mmHg低下,PVRは−5 Wood·U低下,継続投与は68例(79%)であり,一方13例(15%)で使用が中止されていた.WHO-FC改善は46%,不変44%であった75).
さらに欧州での後方視的試験の結果は,平均8.3歳,全40例(内39例はNYHA-III~IV),平均12.7ヶ月の観察で,19例(95%)では病状が安定したが,12例ではPGI2の併用が必要であった85).小児(n=10)と成人(n=20)で,CHD-PAH症例(87%はES)へのbosentanの効果を検討した研究では,短期(4ヶ月)では効果は同様であったが,長期(2.7年)では徐々に効果が減弱していた.特に使用前が重症の小児例では顕著であった86).
また他の報告でCHD-PAHでは,全7例,平均年齢3.8歳で,8.6ヶ月の観察後,右室圧は96±11 mmHgから71±26 mmHgに低下し,NYHA-FCも平均2.6から1.7に低下している87).
安全性に関しては(FUTURE1試験・FUTURE2試験),欧州の市販後調査によれば,2~11歳146例と12歳以上4443例の比較で,有意な肝機能異常は2.7% vs. 7.8%,投与中断率14.4% vs. 28.1%と12歳以上では有害事象が多いと結論している.多くの肝障害は投与開始後4~8週以内に多く見られる88).薬理学的なrisk-benefitから考察すると,体重30 kg未満では,2 m/kg×2回/日を推奨している報告がある(FUTURE1)89).
Bosentan併用による薬物相互作用については,(10例,年齢39~77歳),62.5 mg,1日2回投与の4週後には,sildenafil(100 mg/日)のclearanceが2倍に増え,AUCが55.4%ないし50%減少した.125 mg×2回/日投与ではさらにclearanceが増加し,AUCを低下させた.逆にsildenafilはbosentanのCmaxを42%増加させた90,91).
Tadalafilとの相互作用については,全15例,年齢19~52歳,bosentan 125 mg×2回/日とtadalafil 40 mg/日投与10日後の検討で,tadalafilのAUCは0.59,Cmaxは0.73に低下し,一方bosentanはAUC; 1.13,Cmax: 1.20と増加していた.つまりbosentanはtadalafil血中濃度を41.5%低下させた92).
豪州での全7例の報告ではbosentanにsildenafil(6例),epoprostenol(4例)が加えられているが.3年で100%,5年で75%の生存率であり,増悪を遅延できるとしている93).
欧州での小児40例(IPAH20例,APAH20例),平均8歳の1年間の観察では,IPAHの60%がepoprostenolの併用を必要とした.一方APAHは概ね改善していた94).
2. Ambrisentan
選択的なETA受容体拮抗薬であり,WHO-II,-IIIのPAH(第1群)に有効である.我が国においても2010年9月に成人PAHに承認されている.ETB受容体に比べETA受容体に77倍選択性が高く,90%以上のETA受容体に取り込まれ,ETBには10%以下である.1日1回投与である.
1)成人領域の知見成人においては2004年のATSでPhase-IIIの結果(ARIES-1: 5 mgか10 mg,ARIES-2: 2.5 mgか5 mg)として,6MWD,WHO-FC,Borg Scale,SF-36の改善が報告された結果,5 mgないし10 mgが推奨された95).
成人では,24週間の臨床試験(ARIES-1, -2)で12週後;33.5±43 mと24週後;46.8±52.7 mの6MWDの改善と,BNP低下が長期に持続したと報告された.国内試験では48週後;+59.6 m,84週後;+57.7 mであった96).この結果,国内では開始用量5 mg/日,最大量10 mg/日,となっている.
その後の延長試験ARIES-Eにおいても,2年間の観察で,6MWDが5 mg: +23 m,10 mg: +28 m改善している97).
2012年6月EMAにおいて,成人特発性肺線維症IPF(WHO-PAH分類第3群)の臨床試験(ARTEMIS IPF試験)においては,呼吸機能の増悪を理由にambrisentanの使用が禁止されている.このため暫くは第1群のPAHのみに使用されるべきとされている.Sildenafil,tadalafilやwarfarinとの併用による薬物動態PKへの影響はない.海外試験では肝機能異常(正常上限の3倍以上)は1年間:2%,2年間:3.9%であった.妊婦への使用は禁忌である.末梢浮腫,鼻閉,副鼻腔炎,顔面紅潮などが主な副作用である98)
2)小児期の知見小児では,後方視的な症例検討で,PK,有効性,安全性,忍容性が評価されている.
小児における症例検討では,総症例数38例,bosentanからの切り替え15例,add-on 23例,投与量は;<20 kg: 開始量2.5 mg,維持量5 mg,20~40 kg: 開始量2.5~5 mg,維持量:5~10 mg,>40 kg: 開始量5 mg,維持量5 mg,でいずれも1日1回としている.平均投与量は0.19±0.1 mg/kg/日であった.用量5~10 mg/日の投与では,肝機能上昇例はなく,Cmax,AUCとも成人と同様であった.末梢浮腫は小児では稀であり,最も多いのは鼻閉であった99).現在小児領域では国内で8~17歳のPAH症例(I-PAH,CVD-PAH,CHD根治術後PAH)への臨床試験が行われている.Peak濃度(Cmax)は成人で経口投与1.5時間後で,T1/2は9~15時間である100).BosentanはCYP2C9,CYP3A4,sitaxsentanはCYP2C9で代謝される.一方ambrisentanはCYPによって全く代謝されない.
表6に3種類のERAの特徴を示す101).
表6 ERAのProfile87, 88, 101)(成人) | Bosentan | Ambrisentan | Macitentan |
|---|
| 開発 | Actelion | Myogen, GSK | Actelion |
| 日本における承認 | 2005.4(成人) | 2010.7(成人) | 2015.3(成人) |
| 比較的ETA選択性(ETA>ETB) | 20 : 1 | 77 : 1 | |
| ETA/ETB阻害薬 | ETA選択的阻害薬 | ETA/ETB阻害薬 |
| 選択性×260倍 | |
| 用量・用法 | 62.5 mg×2回/日 | 5または10 mg/日 | 10 mg |
| 1ヶ月後から125 mg,2回/日 | 1回/日 | 1回/日 |
| Peak血漿中濃度 | | 1 hr | |
| Tmax | 3~4 hr(125 mg) | 2 hr(5 mg) | 5 hr(10 mg) |
| T1/2 | 5.4 hr | 13.6 hr(5 mg) | 12.4hr(10 mg) |
| 4.3 hr(62.5 mg), 3.6 hr(125 mg) | | |
| 代謝 | CYP2C9/3A4,胆汁排泄 | 非腎臓性排泄 肝p450(CYP)に関連しない(グルクロン酸抱合) | CYP3A4 |
| Warfarinとの相互作用 | あり | なし | なし |
| Sildenafilとの相互作用 | あり | なし | なし |
| 催奇形性 | あり | あり | あり |
| 精子数減少 | あり | あり | あり |
| 副作用 | | | あり |
| 肝機能障害 | あり | 稀 | 稀 |
| 重篤 | 肝機能障害(1.3%)汎血球・白血球・好中球・血小板の減少・貧血・心不全 | 貧血(4%),体液貯留(12%)心不全,間質性肺炎 | 貧血(4%) |
| その他 | (10%以上):頭痛,筋痛,Hb減少 | (10%以上):血管浮腫,発疹,頭痛,鼻閉,喀血,紅潮 | (5%以上):頭痛 |
| (5%以下):浮動性めまい,鼻閉,浮腫など |
| 臨床試験 | BREATH-1, -2, -3, -4, -5国内試験 | ARIES-1, -2, AMB-220, -222国内試験 | SERAPHIN国内試験 |
3. Sitaxsentan(開発中止)
選択的ETA受容体拮抗薬(ETA>ETB: 6000~6500倍)であるsitaxsentanの検討では,小児・成人を含む20例のIPAH,CHD-PAHで,12週後運動耐容能と血行動態が改善した102).STRIDE-1(100 mgと300 mgの比較試験),STRIDE-2(50 mgと100 mgとの比較試験)やbosentanとの比較試験のSTRIDE-2Xにおいて100 mg/日の投与が治療中断率,臨床的増悪率,肝機能上昇率,1年生存率において有意に良好であることが示されたが,その後開発が中止されている.小児での開発も進められていない103,104).
C. Prostacyclin(PGI2)
我が国で開発された経口PGI2のBeraprost(BPS,Dornar科研,Procylinアステラス)(1992年1月製造承認),同徐放錠(2007年10月承認)に加え,静注のepoprostenol(Flolan, GSK)(1999年1月承認),treprostinil(Treprost)(持続皮下注,持続静注;持田),(海外では吸入,経口もあり),iloprost(吸入;本邦臨床試験中,Bayer)(海外では静注もあり)がある.
1. Epoprostenol(PGI2; Flolan, GSK; Actelion)
1)小児領域の知見我が国の小児26例の初期の検討では,使用後もmPAPと肺体血管抵抗比Rp/Rsは低下が緩やかだが,心拍出量は開始後1年,平均投与量15.7±3.1 ng/kg/minでほぼ正常値に戻ってくる.こういった症例には肺血管選択性の高いPDE5-Iの追加add-on療法が有用である105).
米国のStanfordとDenverからの小児PAH77例(iPAH; 47,CHD-PAH; 24を含む),(平均7.7歳,観察期間4.3年)の治療の結果では,37例がPGI2継続管理,17例がPGI2 off,16例が死亡,5例が心肺移植を受け,K–M生存率は5年で70%であった.使用量は,1年;31 ng/kg/min,2年;34 ng/kg/min,3年;34 ng/kg/min,4年;34 ng/kg/minであり,これは小児でも世界的な平均的使用量と考えられる106).
2)PGI2 Dosing小児での報告は少ないが,1990年代後半のEpoprostenol治療が盛んに開始された頃の研究によれば,米国では成人で平均17ヶ月後は40±15 ng/kg/minで,MacLaughlinとRichはoptimal doseは22~45 ng/kg/minであり,多すぎると臨床的増悪をきたすような高心拍出量状態になると警告している107,108).
欧州の研究では,通常1 ng/kg/minで開始し,12時間ごとに1 ng/kg/min増量し,10 ng/kg/minまで増やしたら退院して臨床症状を観察し,3ヶ月で平均14±4 ng/kg/min,1年目は21±7 ng/kg/minそして平均41±17ヶ月後では32±10 ng/kg/minだったと報告している109).英国からの小児例の報告では平均年齢5.4歳,使用後平均27ヶ月の時点で,IPAH 25例に対する平均使用量は32.5(10~63)ng/kg/minである.またESを含むPAH全体(35例)の使用量も29.6±15.2 ng/kg/min(6~63 ng/kg/min)であった110).
我が国における使用実態調査(1994.4以後の使用開始で2006.3まで,73症例)では,平均使用量は開始時2.0±0.8,6ヶ月後は11.2±6.4 ng/kg/min,12ヶ月後は14.9±4.6 ng/kg/minであった.特にNYHA-IVで開始した症例は1年後9.8±5.8 ng/kg/minと増加が緩やかであった.平均歩行距離は389.7±79.6 mから462. 7±93.5 mと増加している.肺出血は2例と少ない111).別の統計では,開始時は1~2 ng/kg/min,3~4ヶ月後;6.7±2.4,1年後;16.2±3.1; 2年後;26±9.4,3年後30.3±1.7 ng/kg/minであった112).
国立循環器病センター小児科からの報告では,7例(1999.1~2005.8)で,10歳代5名,10歳未満2名で,平均11.4±3歳,PVR12.8~40.7 Wood·U,mPAPは52~87 mmHg,投与開始時使用量;2.0±0.7,1ヶ月目;6.6±1.8,5~12週目;7.5±2.2,25~52週目;10.6±6.3 ng/kg/minであった113).一方,本邦成人での使用量の報告では,開始量;1.6±1.0,1週間後4.0±2.5,1ヶ月後;6.3±3.1,3ヶ月後;12.1±6.2,6ヶ月後;17.7±10.9,1年後24.3±11.4 ng/kg/minであった114).
米国からの報告では,1987~2008年の間に104例のIPAH 89例,FPAH 15例をepoprostenolで治療し,その内14例が経口または吸入製剤に移行できたと報告しており,少量での維持,つまりthe lowest effective doseが基本であろう115).
3)成人領域の知見PGI2が承認され,治療が一般的になった当初の成績では,PGI2の急性効果として,5.5 ng/kg/min投与により,mPAPは18%低下するが,AoPは32%も低下しており,PGI2の血管拡張作用は肺血管よりもより体血管優位であることがわかる116).慢性効果の用量は,1年目17.6±11.2,2年目36.7±21.2,3年目52.9±30.2であったが,これは経口PDE5-IやERAが併用されていない頃の使用量である.PVRは,各々22.1と15.6,3年目には14.6 Wood·Uと低下している117).
PGI2増量の調整法は,2ヶ月で平均1~2 ng/kg/minの速度で増量し,平均330日から700日の期間では,2~62 ng/kg/minの使用量であったとされていることが多い118).また平均16.7±5.2ヶ月観察した27例の1998年のNEJMの論文では,月平均2.4 ng/kg/minの増量速度であった119).
現在の推奨用量recommended doseはepoprostenolが2~40 µg/kg/min(DIV),treprostinil 2~50 µg/kg/min(DIV, SC, Inh),iloprost; 5 µg吸入,6~9回/日120)である.
すなわち,ESC2009とAHA2009の治療guidelineでの推奨用量はESCで,開始量2~4 ng/kg/minで維持量20~40 ng/kg/min121),AHAでは開始量2 ng/kg/minで,維持量25~40 ng/kg/minである122).日本循環器学会のガイドラインでも概ね20~40 ng/kg/minとされている123)(表7).米国でも1990年代後半までに行われていた100~150 ng/kg/minの大量使用は,cost-efficacyやcost-economy,cost-utilityそして喀血,肺出血,動悸などの重篤な副作用の発症から考えても適切ではない124).
表7 エポプロステノールEpoprostenol持続静注の推奨用量設定118–120) | 開始時用量 | 増量 | 最適維持用量 |
|---|
| ESCガイドライン1) | 2~4 ng/kg/min | 副作用(潮紅,頭痛,下痢,脚の痛み)に応じた幅で増量 | 20~40 ng/kg/min |
| AHAガイドライン2) | 2 ng/kg/min | PAHの臨床症状と副作用を確認しながら増量 | 25~40 ng/kg/min |
| 肺高血圧症治療ガイドライン3)(日本循環器学会) | 1~2 ng/kg/min | 副作用と容認性を考慮しつつ,1~2 ng/kg/minづつ徐々に増量 | 20~40 ng/kg/min |
| 1) Galiè N, et al: Eur Heart J 2009; 30: 2493–2537.2) McLaughlin VV, et al: Circulation 2009; 119: 2250–2294.3) 肺高血圧症治療ガイドライン(2012年改定版). |
NYのColumbia大学からの報告では,1987~2008年に104例(IPAH89例FPAH 15例)をepoprostenolで治療し,14例が経口または吸入製剤に移行できたと報告した.そのうち13例は平均7±3.4年(1.2~11.8)使用後であった.epoprostenol使用開始は発症後平均14ヶ月後で,77%はNYHA-II,15%はNYHA-III,mPAP; 58±21mmHg,PVRi; 24±20 Wood·U,CI; 3.9±2.1 L/min/m2,使用量は,併用経口薬が承認される前の症例が多いため,33~137 ng/kg/minであった115).1999年1月の承認後,epoprostenolからの離脱やtreprostinilへの変更が可能な症例もそろそろ見られてきている125).
少数例の報告だが,離脱の適正な時期は,mPAP,PVR,COが正常範囲まで改善したら,吸入PGI2製剤や皮下注製剤,もしくは経口薬を用いた併用療法で安全に離脱できるが,あくまで経験論が主体であり長期の経過観察と用心深い心構えが必要である.いずれにしても経口薬がこれほどまでに開発されてきた現状においては,epoprostenolからの設定維持量に関してlowest effective doseでの管理は基本であろう.
著者らの小児例でも離脱症例が出始めている126).経口bosentanを追加することでepoprostenolからの離脱または減量できた症例も報告されている.小児IPAHで年齢8.5~17.5歳,WHO-FC: 2.3±0.5でepoprostenol使用平均7.6±2.3年の症例に経口bosentanを追加したところ,平均2.0±0.4年で8例中3例において中止が可能であり,5例では86±37 ng/kg/minから29±31 ng/kg/minに減量できている127).静注epoprostenolから,吸入iloprostや吸入treprostinil,およびPDE5-IやERA併用などへの離脱もそろそろ一部の症例で可能になったと思われる.患者の精神的負担の軽減が得られる.
5)副作用a. 甲状腺炎thyroiditisEpoprostenol使用中には破壊性もしくは自己免疫性甲状腺炎を主とする甲状腺疾患を合併することがある.著者らの経験例128)では,小児期~若年発症のIPAH(年齢5~38歳の5例,PAH発症時平均年齢20歳,甲状腺疾患発症時年齢;24.3歳,epoprostenol開始後平均3.0±1.3年,調査対象16例の使用量;23.9±12.0 ng/kg/min)で,使用中の44%に自己免疫性甲状腺炎が報告された.BMPR2変異は0例であり,機能亢進3例(13, 16, 18歳),機能低下2例(33, 40歳)であった.
米国の報告でも,小児78症例中8例(12%)(PAH診断時平均年齢:10.7歳,全例女性,発症年齢;14.1歳)に認められ,全例epoprostenolが使用されていた.使用開始後平均2.4年後(0.5~4.5年).5例は心不全が増悪したが,3例は無症候であった.検査を施行した3例でBMPR2変異が陽性であった.8例中3例は他の自己免疫疾患を合併していた.心不全増悪時には甲状腺機能への十分な注意が必要である129).
b. 血流感染PGI2使用中は血流感染blood stream infection(BSI)の頻度が高くなる.これは皮下ルートを使った持続静注による局所からの侵入に加え,PGI2自体に易感染性を生じる原因がある.ある報告では,123/1146例(11%)の頻度で発症し,treprostinilのほうがepoprostenolより有意に頻度が高く(0.36 vs. 0.12/1000例),多くはグラム陰性桿菌であった130).
また他の報告でも,treprostinil; 0.938 vs. epoprostenol; 0.118/1,000治療期間(p=0.037)131),およびtreprostinil; 1.13 vs. DIV epoprostenol; 0.42/1,000治療期間(p<0.001)と,いずれの報告もややtreprostinil使用に多いとされている132,133).
その予防として,持続静注に際して溶解液の連結管を保護した閉鎖式Hubシステムを使ったり134),pHをアルカリ化することによってBSI合併率を減らすことができる.またepoprostenolの溶解液をtreprostinilの溶解液として使用することで頻度を減らせるとの報告もある135).持続静注施行中のPAHに対するBSIの予防には,Healthcare Infection Control Practices Advisory Committee of the Centers for Disease Control and Prevention(HICPAC/CDC)のガイドラインが有用である136).
c. 肺出血・喀血Epoprostenolに関しては,重篤な肺胞出血・肺出血の危険性がある.成人の検討では,平均33.5歳で,52症例中8件(13.5%)に出血の既往があり,6件は肺胞出血で,うち3例は重篤な呼吸不全があった.平均濃度は,60.0±36 ng/kg/min(使用699日の時点)と現在の推奨用量を超える濃度であった137).
主に成人剖検例の検討では,PGI2治療を受けていた症例は叢状病変plexiform lesionの所見の頻度が有意に高く,また中膜・内膜肥厚の所見の改善は長期治療群においてさえもほとんど見られていない.更に注意すべきは1ヶ月以内の短期治療群で3/10例,平均47ヶ月使用した長期使用群では実に10/12例にびまん性肺出血の所見が認められていた.22例中4例は血小板減少を示していたが,これらはPGI2の長期使用例の特徴と思われる138).
また,剖検例でのplexiform lesionはPGI2未使用例や男性患者ではほとんど見られていない.いずれの報告でも血管周囲にマクロファージやTリンパ球などの炎症性細胞浸潤が認められており,これもPGI2使用の特徴と思われる139)
6)Epo ASとEpo GMの比較従来のepoprostenol GM(Epo GM)(Flolan, GSK)は緩衝剤としてglycine緩衝剤と付形剤としてmannitolを使用していたが,最近新しい製剤epoprostenol sodium AS(Epo AS)(米国;Veletri,Actelion)が承認された.これは緩衝剤としてのarginineと付形剤としてsucroseを用いた製剤である.その特徴は室温で安定で30°C以下では冷却の必要がなく,epoprostenolのように室温で8時間以内,または2~8°Cで24時間との制限がないのが特徴である.
両剤をランダム化比較試験で検討したEPITOME-1試験の結果では,安全性,忍容性,有効性も遜色ないと結論されている140).EPITOME-2試験ではEpo GMからEpo ASに安全に同量投与で移行できた141).
我が国でも安全性と忍容性がEPITOME4試験で検討され,良好な移行が可能であった142).
2. Treprostinil(米国;Remodulin, Treprost)
Treprostinilには,静注,皮下注,吸入製剤がある.Epoprostenolに比べて,静注での排泄半減期T1/2は4.4時間,分布半減期は45分と長い.室温保管で良くまたポンプも小さく,カセット容器製剤であり溶解の調整が不要で交換も楽である.用量設定が増えても足痛以外の副作用は少ない.小児における後方視的研究(3~17歳:平均11歳),では,epoprostenolからの変更は安全で可能であり,副作用が少ない.しかし17例中1例で血流感染BSIを併発していた143).
小児例(IPAH; 27例,CHD-PAH; 52例)において皮下注は末梢血中のCD34+ endothelial progenitor cell(EPC)を増加させる.これはPDE5-I,ERAでは変化が認められなかったので,PGI2の作用と思われる.血中ではendothelial colony forming cells(ECFC)が増加し,高細胞増殖作用と血管新生angiogenesisの増強が期待されると解釈される144).
小児期においても静注から皮下注に移行できた報告がある145).すなわちepoprostenolが使用できない制限があるときはtreprostinilが代替えとなり得る.
皮下注製剤における成人期治療中断率(59%)の約半数は疾患の増悪が理由であり,そして3分の1は注射部位の痛み(92%の症例が感じている)を主にした副作用である146).小児でも静注epoprostenol(27 µg/kg/min)から皮下注treprostinil(目安22 µg/kg/min)へ移行できた症例がある147).また,IPAHに対しても,1~4年の生存率は91~72%で,悪化は14%しかなかった.
Treprostinilの吸入は,小児期でも1日4回(6 µg/呼吸の3~9回/日)で,有効であったとの報告も相次いでおり,吸入による咳は中止する理由にはならなかったと述べられている148).treprostinilの吸入療法は,成人で皮下注が痛みのため継続できない時に使用されている149).皮下注の半減期は1.38時間であり,静脈内投与では0.87時間である150).
既にsildenafilやbosentanを投与されている成人のIPAH難治例に吸入treprostinilを追加するプラセボ対照のTRIUMPH試験の結果でも吸入の有用性が証明されている151).
3. Iloprost(米国;Ventavis)
吸入での半減期T1/2は20~25分であるため,6~9回/日の吸入が必要である152).
全身血管抵抗には影響せず,静注PGI2と違いgas交換や肺内shuntも改善する.
小児ではCHD-PAH(15例)での術後PVRの低下が報告されている.吸入製剤ではiloprostの持続時間30~45分,そしてTrepの60~120分は何れも効果持続時間が短いが,6~9回/日の吸入は煩雑で,有効性の判断も不確実となる153).
その他,CHD術後PAHのcrisis予防としては,0.5 µg/kg/minの吸入で,12例中8例は,mPAPが48±15 mmHgから30±8 mmHgに低下し,動脈血酸素飽和度も,82±17から93±12%に増加している154).小児での吸入iloprostの成績は少ないが,小児でも効果は吸入NOと同じ程度で,時に気管支攣縮が起こりうる.併用によりepoprostenolの必要量が減少し,bosentanやsildenafilの併用にも十分耐容可能であるが,一部では慢性投与で増悪が経験される155).他にも22例の小児で急性効果と慢性効果が観察されている.急性効果では,吸入NOと同じ効果が得られているが,気管支攣縮の影響でFEV1.0が5%低下,MMFが10%低下した.また慢性効果では,NYHAの改善35%,不変50%,増悪15%であった.9人の静注PGI2症例中8例が吸入iloprostに移行できている156).さらに,28試験を分析した小児領域でのsystematic reviewでは,主に術後や新生児PPHN,急性負荷反応におけるPAHが対象であったが,その効果は吸入NOに匹敵するものである.個々の症例での有効量の設定はなされていないが,有効であることは間違いない157).CHD-PAHの小児における吸入iloprostを用いた急性負荷試験では,0.5 µg/kg投与で,18例中13例で効果を示し,PVRは9.3±4.6から4.6±2.7 Wood·Uへ低下,Rp/Rsも0.54±0.37から0.24±0.14へと著明に低下している158).小児では,30~50 ng/kg/min(10分間吸入/2時間毎)の報告もある159).
4. Beraprost(BPS)
臨床的に経口BPSは極めて利便性が高い.ALPHABET研究では12週間の6MWDは改善したが,その後の9ヶ月,12ヶ月後の6MWDは改善せず,心血行動態も改善していなかった.しかし臨床の現場では患者の運動能改善を始め自覚症状の改善が認められる160).半減期は35~40分であり,効果が一時的で持続することが少ない.少数であるが小児例での使用例が報告されている1)が,BPSの持続製剤は小児期での報告がない161).
5. NS-304
新規開発中のNS-304(経口)はPGI2受容体agonistであり,経口でも半減期T1/2は10時間で,MRE-269のプロドラッグである162).このNS-304はberaprostやiloprostがEP3受容体を介して血管拡張するのと異なり,IP受容体を介して特異的かつ持続的に拡張反応を来す163).またberaprostやiloprostの胃の機能や壁運動への影響も見られない164).小児への臨床試験の予定はない.
引用文献References
1) Saji T, Ozawa Y, Ishikita T, et al: Short-term hemodynamic effect of a new oral PGI2 analogue, beraprost, in primary and secondary pulmonary hypertension. Am J Cardiol 1996; 78: 244–247
2) 佐地 勉:肺高血圧・心不全に対するPDE5阻害薬.Annual Review 循環器2007, 山口 徹,ほか編集,中外医学社,2007, pp 218–224
3) 佐地 勉:肺高血圧症治療におけるbosentanの役割.Annual Review 循環器2008, 山口 徹,ほか編集,中外医学社,2008, pp 289–296
4) Rosenzweig EB, Barst RJ: Pulmonary arterial hypertension in children: A medical update. Curr Opin Pediatr 2008; 20: 288–293
5) Archer SL, Michelakis ED: Phosphodiesterase Type 5 inhibitore for pulmonary arterial hypertension. N Engl J Med 2009; 361: 1864–1871
6) Schwartz BG, Kloner RA: Drug interactions with phosphodiesterase-5 inhibitors used for the treatment of erectile dysfunction or pulmonary hypertension. Circulation 2010; 122: 88–95
7) Chaumais M-C, Perrin S, Sitbon O, et al: Pharmacokinetic evaluation of sildenafil as a pulmonary hypertension treatment. Expert Opin Drug Metab Toxicol 2013; 9: 1193–1205
8) Rubin L, Badesch DB, Fleming TR, et al: SUPER-2 Study Group: Long-term treatment with sildenafil citrate in pulmonary arterial hypertension The SUPER-2 Study. Chest 2011; 140: 1274–1283
9) Wilkins MR, Paul GA, Strange JW, et al: Sildenafil verus endothelin receptor antagonist for pulmonary ypertension (SERAPH) study. Am J Respir Crit Care Med 2005; 171: 1292–1297
10) Hoeper MM, Faulenbach C, Golpon H, et al: Combination therapy with bosentan and sildenafil in idiopathic pulmonary arterial hypertension. Eur Respir J 2004; 24: 1007–1010
11) Simonneau G, Rubin LJ, Galie N, et al: PACES Study Group: Addition of sildenafil to long-term intravenous epoprostenol therapy in patients with pulmonary arterial hypertebsion: A randomized trial. Ann Intern Med 2008; 149: 521–530
12) Ghofrani HA, Wiedemann R, Rose F, et al: Sildenafil for treatment of lung fibrosis and pulmonary hypertension: A randomised controlled trial. Lancet 2002; 360: 895–900
13) Andersen MJ, Ersboll M, Axelsson A, et al: Sildenafil and diastolic dysfunction after acute myocardial infarction in patients with preserved ejection fraction (SIDAMI) trial. Circulation 2013; 127: 1200–1208
14) Kukreja RC, Sallum FN, Das A: Cyclic guanosine monophosphate signaling and phosphodiesterase-5 inhibitors in cardioprotection. J Am Coll Cardiol 2012; 59: 1921–1927
15) Hutter AM: Role of the cardiologist: Clinical aspects of managing erectile dysfunction. Clin Cardiol 2003; 27 (Suppl. I): I-3–I-7
16) Nagayama T, Hsu S, Zhang M, et al: Sildenafilb stops progressive chamber, cellular, and molecular remodeling and improves calcium handling and function in hearts with pre-existing advanced hypertrophy caused by pressure overload. J Am Coll Cardiol 2009; 53: 207–215
17) Humpl T, Reyes JT, Holtby H, et al: Beneficial effect of oral sildenafil therapy on childhood pulmonary arterial hypertension. Circulation 2005; 111: 3274–3280
18) Barst RJ, Ivy D, Gaitan G, et al: A randomized, double-blind, placebo-contorolled, dose-ranging study of oral sildenafil citrate in treatment-naïve children with pulmonary arterial hypertension. Circulation 2012; 125: 324–334
19) http://www/fda.gov/Drugs/DrugSafety/ucm317123.htm
20) Abman SH, Kinsella JP, Rosenzweig EB, et al: Pediatric Pulmonary Hypertension Network (PPHNet): Impliations of the U.S. Food and Drug administration warning against the use of sildenafil for the treatment of pediatric pulmonary hypertebsion. Am J Respir Crit Care Med 2013; 187: 572–575
21) Revatio (Sildenafil): Drug Safety Communication-FDA clarifies warning about pediatric use for pulmonary arterial hypertension. (08130/2012) (http://www.fda.gov./Safety/MedWatch/SafetyInformation/SafetyAlertsforHUanMedicalProducts/ucm317743.htm)
22) Drug Safety Communication (/Drugs/DrugSafety/ucm390876.htm)-FDA03/31/2014 (http://www/fda.gov/Drugs/DrugSafety/ucm317123.htm)
23) Advocacy in action. Warning on sildenafil modified to reflect pediatric cardiology expert opinion. AAP News (originally published online July 15, 2014) at Pfizer on September 3, 2014 (http://aapnews.aappublication.org/)
24) McElhinney DB: A new START for Sildenafil in pediatric pulmonary hypertension. Circulation 2014; 129: 1905–1908
25) Barst RJ, Beghetti M, Pulido T, et al: STARTS-2 Investigators: STARTS-2 Long-term survival with oral Sildenafil monotherapy in treatment-naïve pediatric pulmonary arterial hypertension. Circulation 2014; 129: 1914–1923
26) Douwes JM, Roofthooft MT, Van Loon RL, et al: Sildenafil add-on therapy in paediatric pulmonary arterial hypertension, experiences of a national referral center. Heart 2014; 100: 224–230
27) Mourani PM, Sontag MK, Ivy DD, et al: Effects of long-term sildenafil treatment for pulmonary hypertension in infants with chronic lung disease. J Pediatr 2009; 23: 379–384, 384.e1–384.e2
28) Uhm JY, Jhang W-K, Park J-J, et al: Postoperative use of oral sildenafil in pediatric patients with congenital heart disease. Pediatr Cardiol 2010; 31: 515–520
29) Raja SG, Danton MD, MacArthur KJ, et al: Effects of escalating doses of sildenafil on hemodymnamics and gas exchange in children with pulmonary hypertension and congenital cardiac defects. J Cardiothorac Vasc Anesth 2007; 21: 203–207
30) Giardini A, Balducci A, Specchia S, et al: Effect od sildenafil on haemodynamic response to exercise and exercise capacity in Fontan patients. Eur Heart J 2008; 29: 1681–1687
31) Goldberg DJ, French B, McBride MG, et al: Impact of oral sildenafil on exercise performance in children and young adults after the Fontan operation. Circulation 2011; 123: 1185–1193
32) Uzun O, Wong JK, Bhole V, et al: Resolution of protein-losing enteropathy and normalization of mesenteric Doppler flow with sildenafil after Fontan. Ann Thorac Surg 2006; 82: e39–e4
33) Nyp M, Sandritter T, Poppinga N, et al: Sildenafil citrate, bronchopulmonary dysplasia and disordered pulmonary gas exchange: Any benefits? J Perinatol 2012; 32: 64–69
34) Noori S, Friedlich P, Wong P, et al: Cardiovascular effects of sildenafil in neonates and infants with congenital diaphragmatic hernia and pulmonary hypertension. Neonatology 2007; 91: 92–100
35) Fraise A, Butrous G, Taylor MB, et al: Intravenous sildenafil for postoperative pulmonary hypertension in children with congenital heart disease. Intensive Care Med 2011; 37: 502–509
36) Mourani PM, Sontag MK, Ivy DD, et al: Effects of long-term sildenafil treatment for pulmonary hypertension in infants with chronic lung disease. J Pediatr 2009; 154: 379–384, 384.e1–384.e2
37) Luong C, Ray-Perra J, Vadivel A, et al: Antenatal sildenafil treatment attenuates pulmonary hypertension in experimental congenital diaphragmatic hernia. Circulation 2011; 123: 2120–2131
38) Huddleston AJ, Knoderer CA, Morris JL, et al: Sildenafil for the treatment of pulmonary hypertebsion in pediatric patients. Pediatr Cardiol 2009; 30: 871–882
39) Laties AM: Vision disorders and phosphodiesterase type5 inhibitors; a review of the evidence to date. Drug Saf 2009; 32: 1–18
40) Khan AS, Sheikh Z, Khan S, et al: Viagra deafness-sensorineural hearing loss and phosphodiesterase-5 inhibitors. Laryngoscope 2011; 121: 1049–1054
41) Maxeey DM, Ivy DD, Ogawa MT, et al: FDA postmarketing reported side effects and adverse events associatd with pulmonary hypertension therapy in pediatric patients. Pediatr Cardiol 2013; 34: 1628–1636
42) Roldan T, Deiros L, Pomero JA, et al: Safety and tolerability of targeted therapies for pulmonary hypertension in children. Pediatr Cardiol 2014; 35: 490–498
43) Curran MP, Keating GM: Tadalafil. Drugs 2003; 63: 2203–2212, discussion, 2213–2214
44) Oudiz RJ, Brundage BH, Galie N, et al: Tadalafil for the treatment of pulmonary arterial hypertension. J Am Coll Cardiol 2012; 60: 768–774
45) Galie N, Brundage BH, Ghofrani HA, et al: Pulmonary Arterial Hypertension and Response to Tadalafil (PHIRST) Study Group: Tadalafil therapy for pulmonary arterial hypertension. Circulation 2009; 119: 2894–2903
46) Mukhopadhyay S, Sharma M, Ramaklrishnan S, et al: Phosphodiesterase-5 inhibitor in Eisenmenger syndrome. Circulation 2006; 114: 1807–1810
47) Barst RJ, Oudiz RJ, Beardsworth A, et al: Pulmonary Arterial Hypertension and Response to Tadalafil (PHIRST) Study Group: Tadalafil monotherapy and as add-on to background bosentan in patients with pulmonary arterial hypertension. J Heart Lung Transplant 2011; 30: 632–643
48) Takatsuki S, Calderbank M, Ivy DD: Initial experoence with tadalafil in padiatric pulmonary arterial hypertebsion. Pediatr Cardiol 2012; 33: 683–688
49) 下田浩欣,松浦克彦,伊藤善規:タダラフィル錠(アドシルカ状20 mg)粉砕時の安定性に関する試験.日病薬誌 2010; 46: 1374–1376
50) Kohno H, Ichida F, Hirono K, et al: Plasma concentrations of Tadalafil in children with pulmonary arterial hypertension. Ther Drug Monit 2014; 36: 576–583
51) Bell AS, Palmer MJ: Nobel phosphodiestarase type5 modulators: A patent survey (2008–2010). Expert Opin Ther Patents 2011; 21: 1631–1641
52) Thadani U, Smith W, Nash S, et al: The effect of vardenafil, a potent and highly selective phosphodiesterase-5 inhibitor for the treatment of erectile dysfunction, on the cardiovascular response to exercise in patients with coronary artery disease. J Am Coll Cardiol 2002; 40: 2006–2012
53) Vlachopoulos C, Loakeimidis N, Rokkas K, et al: Cardiovascular effects of phosphodiestarase type5 inhibitors. J Sex Med 2009; 6: 658–674
54) Levin YD, White RJ: Nobel therapeutic approaches in pulmonary arterial hypertension: Focus on Tadalafil. Drugs Today (Barc) 2011; 47: 145–156
55) Schwarts BG, Kloner RA: Drug interactions with phosphodiesterase-5 inhibitors used for the treatment of erectile dysfunction or pulmonary hypertension. Circulation 2010; 122: 88–95
56) Wrishko RE, Dingemanse J, Albert Yu, et al: Pharmacokinetic interaction between tadalafil and bosentan in healthy male subject. J Clin Pharmacol 2008; 48: 610–618
57) Kloner RA: Therapy for erectile dysfunction in the cardiac patient. Cardiology special edition 2004; 10: 16–18
58) Seftel AD: Phosphodiesterase type 5 inhibitor differentiation based on selectivity, pharmacokinetic, and efficacy profie. Clin Cardiol 2004; 27 suppl I: I-14–I-19
59) Ghofrani HA, Voswinckel R, Reichenberger F, et al: Differences in hemodynamic and oxygenation response to three different phophodiesterase-5 inhibitors in patients with pulmonary arterial hypertension. J Am Coll Cardiol 2004; 44: 1488–1496
60) Laties AM: Vision disorders and phosphodiesterase type5 inhibitors; a review of the evidence to date. Drug Saf 2009; 32: 1–18
61) Khan AS, Sheikh Z, Khan S, et al: Viagra deafness-sensorineural hearing loss and phosphodiesterase-5 inhibitors. Laryngoscope 2011; 121: 1049–1054
62) Sabri MR, Beheshtian E: Comparison of the therapeutic and side effects of Tadalafil and Sildenafil in children and adlescents with pulmonary arterial hypertension. Pediatr Cardiol 2014; 35: 699–704
63) Yokoyama Y, Tomatsuri M, Hayashi H, et al: Simultaneous microdetermination of bosentan, ambrisentan, sildenafil, an tadalafil in plasma using liquid chromatography/tandem mass spectrometry for pediatric patients with pulmonary arterial hypertension. J Pharm Biomed Anal 2014; 89: 227–232
64) Tsai BM, Turrentine MW, Sheriden BC, et al: Differential effects of phosphidiesterase-5 inhibitors on hypoxic pulmonary vasoconstriction and pulmonary artery cytokine expression. Ann Thorac Surg 2006; 81: 272–278
65) Grimminger F, Weimann G, Frey R, et al: First acute haemodynamic study of soluble guanylate cyclase stimulator riociguat in pulmonary hypertension. Eur Respir J 2009; 33: 717–721
66) Ghofrani HA, Galiè N, Grimminger F, et al: PATENT-1 Study Group: Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med 2013; 369: 330–340
67) 後藤勝年,佐地 勉:エンドセリンの発見—後藤勝年先生に聞く—.心臓 2008; 40: 882–898
68) Frampton JE: Ambrisentan. Am J Cardiovasc Drugs 2011; 11: 215–226
69) Opitz CF, Ewert R: Dual ETA/ETB vs. selective ETA endothelin receptor antagonism in patients with pulmonary hypertension. Eur J Clin Invest 2006; 36 Suppl 3: 1–9
70) Galie N, Seeger W, Naeije R, et al: Comparative analysis of clinical trials and evidence-based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43 Suppl S: S81–S88
71) Sasayama S, Kunieda T, Tomoike H, et al: Effects of the endothelin receptor antagonist Bosentan on hemodynamics, symptoms and functional capacity in Japanese patients with severe pulmonary hypertension. Circ J 2005; 69: 131–137
72) Ramirez A, Varga J: Pulmonary arterial hypertension in systemic screlosis. Treat Respir Med 2004; 3: 339–352
73) Christensen DD, McConnell ME, Book WM, et al: Initial experience with Bosentan therapy in patients with Eisenmenger’s syndrome. Am J Cardiol 2004; 94: 261–263
74) Barst RJ, Ivy D, Dingemanse J, et al: Pharmacokinetics, safety, and efficacy of bosentan in pediatric patients with pulmonary arterial hypertension. Clin Pharmacol Ther 2003; 73: 372–382
75) Rosenzweig EB, Ivy DD, Widlitz A, et al: Effects of long-term Bosentan in childeren with pulmonary arterial hypertension. J Am Coll Cardiol 2005; 46: 697–704
76) Levin ER: Endothelins. N Engl J Med 1995; 333: 356–363
77) Lucher TF, Barton M: Endothelin and endothelin receptor antagonist. Circulation 2000; 102: 2434–2440
78) Ishikawa S, Miyauchi T, Sakai S, et al: Elevated levels of plasma endothelin-1 in young patients with pulmonary hypertension caused by congenital heart disease are decreased after successful surgical repair. J Thorac Cardiovasc Surg 1995; 110: 271–273
79) Kageyama K, Hashimoto S, Nakajima Y, et al: The change of plasma endothelin-1 levels before and after surgery with or without Down syndrome. Paediatr Anaesth 2007; 17: 1071–1077
80) Blazy I, Dechaux M, Charbit M, et al: Endothelin-1 in children with chronic renal failure. Pediatr Nephrol 1994; 8: 40–44
81) 川崎宗泰,小山信弥,吉原克則,ほか:体外循環による血中エンドセリンと顆粒球エラスターゼの変動.東邦医学会雑誌 1997; 44: 56–59
82) Sato K, Saji T, Kaneko T, et al: Unexpected pulmonary hypertensive crisis after surgery for ocular malignant melanoma. Life Sci 2014; 118: 420–423
83) Barst RJ, Ivy D, Dingemanse J, et al: Pharmacokinetics, safety, and efficacy of bosentan in pediatric patients with pulmonary arterial hypertension. Clin Pharmacol Ther 2003; 73: 372–382
84) Carter NJ, Keating GM: Bosentan: In pediatric patients with pulmonary arterial hypertension. Paediatr Drugs 2010; 12: 63–73
85) Maiya S, Hislop AA, Flynn Y, et al: Response to bosentan in children with pulmonary hypertension. Heart 2006; 92: 664–670
86) Van Loon RL, Hoendermis ES, Duffles MG, et al: Long-term effect of bosentan in adults versus children with pulmonary arterial hypertension associated with systemic-to-pulmonary shunt: Does the beneficial effect persist? Am Heart J 2007; 154: 776–782
87) Gilbert N, Luther Y-C, Miera O, et al: Initial experience with bosentan (Tracleer) as treatment for pulmonary arterial hypertension (PAH) due to congenital heart disease in infants and young children. Z Kardiol 2005; 94: 570–574
88) Beghetti M, Hawworth SG, Bonnet D, et al: Pharmacokinetics and clinical profile of a novel formulation of bosentan in children with pulmonary arterial hypertension: The FUTURE-1 study. Br J Clin Pharmacol 2009; 2009: 948–955
89) Beghetti M, Hoepaer M, Kiery DG, et al: Safety experience with bosentan in 146 children 2–11 years old with pulmonary arterial hypertension: Results from the European Postmarketing Surveillance program. Pediatr Res 2008; 64: 200–204
90) Paul GA, Gibbs SR, Boobis A, et al: Bosentan decreased the plasma concentration of sildenafil when coprescribed in pulmonary hypertension. Br J Pharmacol 2005; 60: 107–112
91) Burgess G, Hoogkamer H, Collings L, et al: Mutual pharmacokinetics interactions between steady-state bosentan and sildenafil. Eur J Clin Pharmacol 2008; 64: 43–50
92) Wrishko RE, Dingemanse J, Yu A, et al: Pharmacokinetic interaction between tadalafil and bosentan in healthy male subjects. J Clin Pharmacol 2008; 48: 610–618
93) Simpson CM, Penny DJ, Cochrane AD, et al: Preliminary experience with Bosentan as initial therapy in childhood idiopathic pulmonary arterial hypertension. J Heart Lung Transplant 2006; 25: 469–473
94) Maiya S, Hislop AA, Flynn Y, et al: Resonse to bosentan in children with pulmonary hypertension. Heart 2006; 92: 664–670
95) Galie N, Badesch D, Pudiz R, et al: Ambrisentan therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2005; 46: 529–535
96) Galie N, Olschewski H, Oudiz RJ, et al: Ambrisentan in Pulmonary Arterial Hypertension, Randomized, Double-Blind, Placebo-Controlled, Multicenter, Efficacy Studies (ARIES) Group: Ambrisentan for the treatment of pulmonary arterial hypertension. Circulation 2008; 117: 3010–3019
97) Oudiz R, Galie N, Olschewski H, et al: ARIES Study Group: Long-term ambrisentan therapy for the treatment of pulmonary arterial hypertenbsion. J Am Coll Cardiol 2009; 54: 1971–1981
98) Frampton JE: Ambrisentan. Am J Cardiovasc Drugs 2011; 11: 215–226
99) Takatsuki S, Rosenzweig EB, Zuckerman W, et al: Clinical safety, pharmacokinetics, and efficacy of ambrisentan therapy in children with pulmonary arterial hypertension. Pediatr Cardiol 2013; 48: 27–34
100) Rubin LJ, Dufton C, Gerber MJ: Ambrientan for pulmonary arterial hypertension. Future Cardil 2005; 1: 425–432
101) Abman SH: Role of endothelin receptor antagonists in the treatment of pulmonary arterial hypertension. Annu Rev Med 2009; 60: 13–23
102) Barst RJ, Rich S, Widlitz A, et al: Clinical efficacy of sitaxsentan,an endothelin A receptor antagonist, in patients with pulmonary arterial hypertension; open label pilot study. Chest 2002; 121: 1860–1868
103) Langleben D, Cacoub P, et al: ARreview of STRIDE-2 and STRIDE-2X: The case for selective endothelin receptor blockade. Eur J Clin Invest 2009; 39 Suppl 2: 27–31
104) Barst RJ, Langleben D, Badesch D, et al: STRIDE-2 Study Group: Treatment of pulmonary arterial hypertension with the selective endothelin—A receptor antagonist Sitaxsentan. J Am Coll Cardiol 2006; 47: 2049–2056
105) Nakayama T, Shimada H, Takatsuki S, et al: Efficacy and limitations of continuous intravenous epoprostenol therapy for idiopathic pulmonary arterial hypertension in Japanese children. Circ J 2007; 71: 1785–1790
106) Siehr S, Ivy DD, Miller-Reed K, et al: Children with pulmonary arterial hypertension and prostanoid therapy: Long-term hemodynamics. J Heart Lung Transplant 2013; 32: 546–552
107) Maclaughlin VV, Genthner DE, Panella MM, et al: Reduction in pulmonary vescular resistance with long-term epoprostenol (Prostacyclin) therapy in primary pulmonary hypertension. N Engl J Med 1998; 338: 273–277
108) MacLaughlin VV, Shillington A, Rich S: Survival in primary pulmonary hypertension: The impact of epoprostenol therapy. Circulation 2002; 106: 1477–1482
109) Sitbon O, Humbert M, Simonneau G, et al: Primary pulmonary hypertension: Current therapy. Prog Cardiovasc Dis 2002; 44: 115–128
110) Lammers AE, Hislop AA, Flynn Y, et al: Epoprostenol treatment in children with severe pulmonary hypertension. Heart 2007; 93: 739–743
111) 佐地 勉,山田 修,中山智孝,ほか:小児期肺動脈性肺高血圧症症例におけるエポプロステノール治療の有効性と安全性の長期検討.心臓 2008; 40: 34–43
112) 中山智孝,嶋田博光,高月晋一,ほか:総説:小児肺動脈性肺高血圧症におけるフローラン投与開始後の治療の現状.Prog Med 2005; 25: 325–329
113) 岡田 博,高田充隆,森下秀樹,ほか:小児におけるエポプロステノール(PGI2)持続静注療法時の投与量の検討.Jpn J Pharm Health Care Sci 2006; 32: 805–812
114) 佐藤 徹,京谷晋吾,二藤部丈司,ほか:フローランの増量法,導入後の投与量設定についてProg Med 2005; 25: 306–310
115) Melnick L, Barst RJ, Rowan CA, et al: Effectiveness of ransition from intravenous epoprostenol to oral/inhaled targeted pulmonary hypertension therapy in pediatric idiopathic and familial pulmonary arterial hypertednsion. Am J Cardiol 2010; 105: 1485–1489
116) Jones DK, Higenbottam TW, Wallwork J, et al: Treatment of primary hypertension with intravenous epoprostenol (Prostacyclin). Br Heart J 1987; 57: 270–278
117) Barst RJ, Rubin LJ, McGoon D, et al: Survival in priomary pulmonary hypertension with long-term continuous intravenous prostacyclin. Ann Intern Med 1994; 124: 409–415
118) Shapiro SM, Oudiz RJ, Cao T, et al: Primary pulmonary hypertension: Improved long-term effects and survival with continuous intravenous epoprostenol infusion. J Am Coll Cardiol 1997; 30: 343–349
119) McLaughlin VV, Genthner DE, Panella MM, et al: Reduction in pulmonary vascular resistance with long-term epoprostenol (Prostacyclin) therapy in primary pulmonary hypertension. N Engl J Med 1998; 338: 273–277
120) Saggar R, Khanna D: Identifing and managing pulmonary hypertgension. J Musculoskel Med 2009; 26: 417–422
121) Galie N, Hoeper MM, Humbert M, et al: ESC Committee for Practice Guidelines (CPG): Guideline for the diagnosis and treatment of pulmonary hypertension: The task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009; 30: 2493–2537
122) McLaughlin VV, Archer SL, Badesch DB, et al: ACCF/AHA: ACCF/AHA 2009 expert consensus document on pulmonary hypertension: A report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association: Developed in collaboration with the American College of Chest Physicians, American Thoracic Society, Inc., and the Pulmonary Hypertension Association. Circulation 2009; 119: 2250–2294
123) 日本循環器学会「循環器病の診断と診療に関するガイドライン(2012年度合同研究班報告.肺高血圧症治療ガイドライン(2012年後版)(班長中西宣文)www.j-circ.or.jp/guideline/pdf/JCS2012
124) Roman A, Barberà JA, Escribano P, et al: Cost effectiveness of prostacyclins in pulmonary arterial hypertension. Appl Health Econ Health Policy 2012; 10: 175–188
125) Melnick L, Barst RJ, Rowan CA, et al: Effectiveness of ransition from intravenous epoprostenol to oral/inhaled targeted pulmonary hypertension therapy in pediatric idiopathic and familial pulmonary arterial hypertednsion. Am J Cardiol 2010; 105: 1485–1489
126) 重光幸栄,中山智孝,直井和之,ほか:エポプロステノール持続静注療法から離脱に成功した肺動脈性肺高血圧症2例の臨床経過.日小循誌 2012; 28: 325
127) Ivy DD, Doran A, Claussen L, et al: Weaning and discontinuation of epoprostenol in children with idiopathic pulmonary arterial hypertension receiving concomitant bosentan. Am J Cardiol 2004; 93: 943–946
128) Sato M, Aso K, Nakayama T, et al: Autoimmune thyroid disease in children and adlescents with idiopathic pulmonary arterial hypertension. Circ J 2010; 74: 371–374
129) Trapp CM, Elder RW, Garken AT, et al: Pediatric pulmonary arterial hypertension and hyperthyroidism: A potentially fatal combination. J Clin Endocrinol Metab 2012; 97: 2217–2222
130) Kitterman N, Poms A, Miller DP, et al: Bloodstream infections in patients with pulmonary arterial hypertension treated with intravenous prostanoids: Insight from the REVEAL REGISTRY. Mayo Clin Proc 2012; 87: 825–834
131) Lopez-Medrano F, Fernandez-Ruiz M, Ruiz-Cano MJ, et al: High incidence of blood stream infection due to gram-negative bacilli in patients with pulmonary hypertgension receiving intravenous treprostinil. Arch Bronconeumol 2012; 48: 443–447
132) Kallen AJ, Ledeman E, Balaji A, et al: Bloodstream infections in patients given treatment with intravenous prostanoids. Infect Control Hosp Epidemiol 2008; 29: 342–349
133) Centers for Disease Control and Preention (CDC): Bloodstream Infections among patients treated with intravenous epoprostenol or intravenous treprostinil for pulmonary arterial hypertension—Seven sites, United States, 2003–2006. MMWR Morb Mortal Wkly Rep 2007; 56: 170–172
134) Ivy DD, Calderbank M, Wagner BD, et al: Closed-hub systems with protected connections and the reduction of risk of catheter-related bloodstream infection in pediatric patietns receiving intravenous prostanoid therapy for pulmonary hypertension. Infect Control Hosp Epidemiol 2009; 30: 823–829
135) Rich JD, Glassner C, Wade M, et al: The effect of diluent pH on bloodstream infection rates in patients receiving IV treprostinil for pulmonary arterial hypertension. Chest 2012; 141: 36–42
136) O’Grady NP, Alexander M, Dellinger EP, et al: Guidelines for the prevention of intravascular catheter-related infections. The hospital infection control and prevention, U.S. Pediatrics 2002; 110: e5
137) Ogawa A, Matsubara H, Sakuma M, et al: Risk of alveolar hemorrhage in patients with primary hypertension: Anticoagulation and Epoprostenol therapy. Circ J 2005; 69: 216–220
138) Pogoriler JE, Rich S, Archer SL, et al: Persistence of complex vascular lesions despite prolonged prostacyclin therapy of pulmonary arterial hypertension. Histopathology 2012; 61: 597–609
139) Stacher E, Graham BB, Hunt JM, et al: Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med 2012; 186: 261–272
140) Chin KM, Badesch DB, Robbins IM, et al: Two formulations of epoprostenol sodium in the treatment of pulmonary arterial hypertension: EPITOME-1 (epoprostenol for injection in pulmonary arterial hypertension), a phase IV, open-label, randomized study. Am Heart J 2014; 167: 218–225
141) Sitbon O, Delcroix M, Bergot E, et al: EPITOME-2: An open-label study assessing the transition to a new formulation of intravenous epoprostenol in patients with pulmonary arterial hypertension. Am Heart J 2014; 167: 210–217
142) Tamura Y, Ono T, Fukuda K, et al: Evaluation of a new formulation of Epoprostenol sodium in Japanese patients with pulmonary arterial hypertension (EPITOME4). Adv Ther 2013; 30: 459–471
143) Ivy DD, Claussen L, Doran A: Transition of stable pediatric patients with pulmonary arterial hypertension from intravenous epoprostenol to intravenous treprostinil. Am J Cardiol 2007; 99: 696–698
144) Smadia DM, Mauge L, Gaussem P, et al: Treprostinil increases the number and angiogenic potential of endothelial progenitor cells in children with pulmonary hypertension. Angiogenesis 2011; 14: 17–27
145) Levy M, Celermajer DS, Bourges-Petit E, et al: Add-on therapy with subcutaneous treprostinil for refractory pediatric pulmonary hypertension. J Pediatr 2011; 158: 584–588
146) Barst RJ, Galie N, Naeije R, et al: Long-term outcome in pulmonary arterial hypertension patients treated with subcutaneous treprostinil. Eur Respir J 2006; 28: 1195–1203
147) Vachiery J-L, Hill N, Zwicke D, et al: Transitioning from IV Epoprostenol to subcutaneous Treprostinil in primary arterial hypertension. Chest 2002; 121: 1561–1565
148) Krishnan U, Takatsuki S, Ivy DD, et al: Effectiveness and safety of inhaled treprostinil for the treatment of pulmonary arterial hypertension in children. Am J Cardiol 2012; 110: 1704–1709
149) Channick RN, Olschewski H, Seeger W, et al: Safety and efficacy of inhaled treprostinil as add-on therapy to bosetan in pulmonary arterial hypertension. J Am Coll Cardiol 2006; 48: 1433–1437
150) Wade M, Baker FJ, Roscigno R, et al: Absolute bioavailability and pharmacokinetics oftreprostinil sodium administered by acute subcutaneous infusion. J Clin Pharmacol 2004; 44: 83–88
151) McLaughlin VV, Benza RL, Rubin LJ, et al: Addition of inhaled Treprostinil to oral therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2010; 55: 1915–1922
152) Olschewski H, Simonneau G, Galie N, et al: Aerolized iloprost randmozed study group. Inhaled iloprost forsevere pulmonary hypertension. N Engl J Med 2002; 347: 322–329
153) Hallioglu O, Dilber E, Celiker A: Comparison of acute hemodynamic effects of aerolized and intravenous iloprost in secondary pulmonary hypertension in children with congenital heart disease. Am J Cardiol 2003; 92: 1007–1009
154) Limsuwan A, Wanitkul S, Khosithset A, et al: Aerolized iloprost for postoperative pulmonary hypertensive crisis in children with congenital heart disease. Int J Cardiol 2008; 129: 333–338
155) Tissot C, Beghetti M: Review of inhaled iloprost for the control of pulmonary artery hypertension in children. Vasc Health Risk Manag 2009; 5: 325–331
156) Ivy DD, Doran AK, Smith KJ, et al: Short- and long-term effects of inhaled iloprost therapy in children with pulmonary arterial hypertension. J Am Coll Cardiol 2008; 51: 161–169
157) Mulligan C, Beghetti M: Inhaled iloprost for the control of acute pulmonary hypertension in children: A systematic review. Pediatr Crit Care Med 2012; 13: 472–480
158) Limsuwan A, Khosithseth A, Wanichkul S, et al: Aerolized iloprost for pulmonary vasoreactivity testing in children with long-standing pulmonary hypertension related to congenital heart disease. Catheter Cardiovasc Interv 2009; 73: 98–104
159) Xu ZL, Zhu L, Liu X, et al: Iloprost for children with pulmonary hypertension after surgery to correct congenital heart disease. Pediatr Pulmonol 2015; 50: 588–595
160) Barst RJ, McGoon M, McLaughlin V, et al: Beraprost Study Group: Beraprost therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2003; 41: 2119–2125
161) 車谷 元:経口べラプロストナトリウム徐放性製剤(ケアロードLA錠60 µg, ベラサスLA錠60 µg)の特徴および臨床試験成績.日薬理誌 2009; 133: 101–110
162) Kuwano K, Hashino A, Asaki T, et al: 2 {4-[(5,6-diphenylpyrazin]butoxy)-N-(methylsulfonyl9acetamide(NS-304),an orally available and long-acting prostacyclin receptor agonist prodrug. J Pharmacol Exp Ther 2007; 322: 1181–1188
163) Kuwano K, Hashino A, Noda K, et al: A long-acting and highly selective prostacyclin receptor agonist prodrugg, 2-{4-[(5,6-Diphenylpyrazin-2-yl)(isopropyl)amino]butoxy}-N-(methylsuifonyl)acetamide (NS-304), ameriolates rat pulmonary hypertension with unique relaxant responses of its active form, {4-[5,6-Diphenylpyrazin-2-yl](isopropyl)amino}butoxy}acetic acid (MRE-269), on rat pulmonary artery. J Pharmacol Exp Ther 2008; 326: 691–699
164) Morrison K, Ernst R, Hess P, et al: Selexipag: A selective prostacyclin receptor agonist that does not affect rat gastric function. J Pharmacol Exp Ther 2010; 335: 249–255
165) 佐地 勉:原発性肺高血圧の治療の変遷と最新の考え方.小児医診療 1997; 1: 35–45
166) Barst RJ, Agnoletti G, Fraisse A, et al: NO Diagnostic Study Group: Vasodilater testing with nitric oxide and/or oxygen in padiatric pulmonary hypertension. Pediatr Cardiol 2010; 31: 598–606
167) 佐地 勉,小澤安文,橋口玲子,ほか:総説;プロスタサイクリン(PGI2)と肺高血圧.小児科診療 1993; 56: 1845–1854
168) Badesch DB, Abman SH, Aheam GS, et al: Medical therapy for pulmonary arterial hypertension. ACCP evidenced-based clinical practice guideline. Chest 2004; 126 Suppl: S35–S62
169) Sitbon O, Humbert M, Jagot JL, et al: Inhaled nitric oxide as screening agent for safety identifying responders to oral calcium-channel blockers in primary pulmonary hypertension. Eur Respir J 1998; 12: 265–270
170) Hoeper MM, Olschewski H, Ghofrani HA, et al: Inhaled nitric oxide as a screening vasodilator agent in primary pulmonary hypertension: A dose-response study and comparison with pprostacyclin. Am J Respir Crit Care Med 1995; 151: 384–389
171) Fujita H, Fukumoto Y, Saji K, et al: Acute vasodilator effects of inhaled fasudil, a specific Rho-kinase inhibitor, in patients woth pulmonary arterial hypertension. Heart Vessels 2010; 25: 144–149
172) Apitz C, Reyes JT, Holtby H, et al: Pharmacokinetic and hemodynamic responses to oral sildenafil during invasive testing in children with pulmonary hypertension. L Am Coll Cardiol 2010; 55: 1456–1462
173) Tapson VF, Jing Z-C, Xu K-F, et al: FREEDOM-C2 Study Team: Oral treprostinil for the treatment of pulmonary arterial hypertension in patients receiving background endothelin receptor antagonist and phosphodiesterase type5 inhibitor therapy (The FREEDOM-C2 study): A randomized controlled trial. Chest 2013; 144: 952–958
174) Brittain EL, Pugh ME, Wheeler LA, et al: Proatanoids but not oral therapies improve right ventricular finction in pulmonary arterial hypertension. Am J Coll Cardiol HF 2013; 1: 300–307
175) Van de Veerdonk MC, Kind T, Marcus JT, et al: Progeressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. L Am Coll Cardiol 2011; 58: 2511–2519
176) Chida A, Shintani M, Yagi H, et al: Outcomes of childhood pulmonary arterial hypertension in BMPR2 and Alk1 mutation carries. Am J Cardiol 2012; 110: 586–593
177) Fox BD, Shimony A, Langleben D: Meta-analysis of monotherapy versus combination therapy for pulmonary arterial hypertension. Am J Cardiol 2011; 108: 1177–1182
178) Macchia A, Marchioli R, Tognoni G, et al: Systematic review of trials using vasodilators in pulmonary arterial hypertension: Why a new approach is needed. Am Heart J 2010; 159: 245–257
179) Dorris SL, Peebles S Jr: PGI2 is a regulator of inflammatory diseases. Mediation of Inflammation 2012; Article ID 926968, 9 pages, Hindawi Publishing Corporation
180) McLaughlin VV, Gaine SP, Howard LS, et al: Treatment goals of pulmonary hypertension. J Am Coll Cardiol 2013; 62 Suppl: D73–D81
181) Voelkel NF, Quaife RA, Leinwand LA, et al: National Heart, Lung, and Blood Institute Working Group on Cellular and Molecular Mechanisms of Right Heart Failure: Right ventricular function and failure: Report of a national heart, Lung, and Blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation 2006; 114: 1883–1891
182) Barst RJ, Gibbs JS, Ghofrani HA, et al: Updated evidence-based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2009; 54 Suppl: S78–S74
183) Chida A, Shintani M, Matsushita Y, et al: Mutations of NOTCH3 in childhood pulmonary arterial hypertension. Mol Genet Genomic Med 2014; 2: 229–239
184) Ma L, Chung WK: Chung WK: The genetic basis of pulmonary arterial hypertension. Hum Genet 2014; 133: 471–479
185) Willemijin MH, Zijlstra BSC, Johannes M, et al: Survival differences in pediatric pulmonary arterial hypertension. J Am Coll Cardiol 2014; 63: 2159–2169
186) Coeytaux RR, Schmit KM, Kraft BD, et al: Comparative effectiveness and safety of drug therapy for pulmonary arterial hypertension. Chest 2014; 145: 1055–1063
187) Roberts DH, Lepore JJ, Maroo A, et al: Oxygen therapy improves cardiac index and pulmonary vascular resistance in patients with pulmonary hypertension. Chest 2001; 120: 1547–1555
188) Connelly MS, et al: Canadian Consensus Conference on adult congenital heart disease. 1996, Section XIII-Eisenmenger syndrome and pulmonary vascular obstructive disease. Can J Cardiol 1998; 14: 426–428
189) Therrien J, et al: Canadian Cardiovascular Society Consensus Conference 2001 update: Recommendations for the management of adults with congenital heart disease, Part III, Section XV Eisenmenger syndrome. Can J Cardiol 2001; 17: 1149–1152
190) Haworth SG, Hislop AA: Treatment and survival in children with pulmonary arterial hypertension: The UK pulmonary hypertension service for children 2001~2006. Heart 2009; 95: 312–317
191) Takatsuki S, Wagner BD, Ivy DD: B-type natriuretic peptide and amino-terminal pro-B-type natriuretic peptide in pediatric patients with pulmonary arterial hypertension. Congenit Heart Dis 2012; 7: 259–267
192) Takatsuki S, Nakayama T, Jone PN, et al: Tissue Doppler imaging predicts adverse outcome in children with idiopathic pulmonary arterial hypertension. J Pediatr 2012; 161: 1126–1131
193) Wagner BD, Takatsuki S, Accurso FJ, et al: Evaluation of circulating proteins and hemodynamics towards predicting mortality in children with pulmonary arterial hypertension. PLoS ONE 2013; 8: e80235
194) 田崎 孝:小児の原発性肺高血圧症—発症と治療—.日児誌 1988; 92: 1474–1477
195) 門間和夫,岩崎順弥,中沢 誠,ほか:小児の原発性肺高血圧症.日小循誌 1988; 14: 494–499
196) 佐地 勉,門間和夫,柴田利満,ほか:小児期原発性肺高血圧症の全国調査結果—肺移植適応患者の実態調査(第1報).日小循誌 2000; 16: 230–237
197) Haworth SG, Hislop AA: Treatment and survival in cjildren with pulmonary arterial hypertension: The UK pulmonary hypertension service for children 2001–2006. Heart 2009; 95: 312–317
198) Lammers AE, Burch M, Benden C, et al: Lung transplantation in children with idiopathic pulmonary arterial hypertension. Pediatr Pulmonol 2010; 45: 263–269
199) Raposo-Sonnenfeld I, Otero-Gonzalez I, Blanco-Apalicio M, et al: Treatment with sildenafil, bosentan, or both in children and young people with idiopathic pulmonary arterial hypertension and Eisenmenger’s syndrome. Rev Esp Cardiol 2007; 60: 366–372
200) Rosenzweig EB, Kerstein D, Barst RJ, et al: Long-term prostacyclin for pulmonary hypertension with associated congenital heart defects. Circulation 1999; 99: 1858–1865
201) Duffels MGJ, Vis JC, Loon RLE, et al: Effect of bosentan on exercise capacity and quality of life in adults with pulmonary arterial hypertension associated with congenital heart disease with and without Down’s syndrome. Am J Cardiol 2009; 103: 1309–1315
202) Schlutz-Neick I, Hartenstein P, Li J, et al: Intravenous sildenafil is a potent pulmonary vasodilator in children with congenital heart disease. Circulation 2003; 108 Suppl 1: II167–II173
203) Uzun O, Wong JK, Bhole V, et al: Resolution of protein-losing enteropathy and normalization of mesenteric Doppler flow with sildenafil after Fontan. Ann Thorac Surg 2006; 82: e39–e40
204) Haseyama K, Satomi G, Yasukochi S, et al: Pulmonary vasodilatation therapy with sildenafil citrate in a patient with plastic bronchitis after the Fontan procedure for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2006; 132: 1232–1233
205) Goldberg DJ, French B, McBride MG, et al: Impact of oral sildenafil on exercise performance in children and young adults after the Fontan operation: A randomized, double-blind, placebo-controlled, cross over trial. Circulation 2011; 123: 1185–1193
206) Ovaert C, Thijs D, Dewolf D, et al: The effect of bosentan in patients with a failing Fontan circulation. Cardiol Young 2009; 19: 331–339
207) Hirono K, Yoshimura N, Taguchi M, et al: Bosentan induces clinical and hemodynamic improvement in candidates for right-sided heart bypass surgery. J Thorac Cardiovasc Surg 2010; 140: 346–351
208) Schuuring MJ, Vis JC, van Dijk AP, et al: Impact of bosentan on exercise capacity in adults after the Fontan procedure: A randomized controlled trial. Eur J Heart Fail 2013; 15: 690–698
209) Ishida H, Kogaki S, Ichimori H, et al: Overexpression of endothelin-1 and endothelin receptors in the pulmonary arteries of failed Fontan patients. Int J Cardiol 2012; 159: 34–39
210) Stearman RS, Cornelius AR, Lu Xiao, et al: Functional Prostacyclin synthase promotor polymorphism. Am J Respir Crit Care Med 2014; 189: 1110–1120