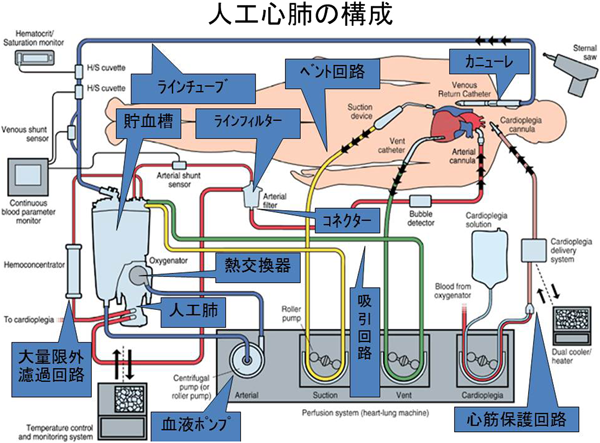
1. 体肺動脈短絡術
Taussig(小児科医)が考案し,Blalock(外科医)が実行した体肺動脈短絡手術12)は彼らの頭文字をとってBTシャントと言われる.原型は鎖骨下動脈を直接肺動脈に吻合するもの(original shunt)であるが,deLevalらによりゴアテックス人工血管を用いたmodified shuntが報告され,現在はこれが一般的である13).チアノーゼ軽減と肺動脈発育促進を目的とする姑息術でアプローチは胸骨正中切開と側開胸がある.最近は正中アプローチが増加傾向にあるが術者の好みにもより議論が分かれる.
手術手技
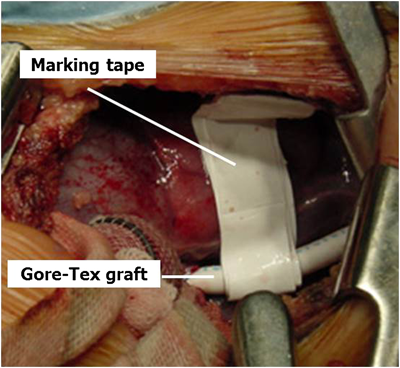
以下,側開胸手技に関して述べる.通常,第4肋間開胸にてアプローチする.皮膚切開はanterolateral,posterolateral,axillary incisionがある.鎖骨下動脈と肺動脈の剥離を行いtapingを行う.通常,右シャントの場合は奇静脈を結紮切離する.ヘパリン全身投与下に3.5~5 mmのゴアテックス人工血管を用いて,鎖骨下動脈,肺動脈の順に#7-0プロリン®連続縫合にて端側吻合を行う.正中アプローチのシャントでは側開胸アプローチと比べてワンサイズ小さい人工血管の使用を考慮する.側開胸アプローチの場合は幅10 mmの0.1 mmゴアテックステープを人工血管に巻き,先端にLサイズクリップを付け胸腺付近に固定する(marking tape).これにより根治術時のシャント剥離が容易になる(Fig. 4).
注意点
通常,側開胸での右シャントの場合は右鎖骨下動脈の根元に反回神経が接近していることがあるのでその取扱いには十分注意する.シャント吻合後に人工血管を一時的に鑷子でつまんで血圧上昇があればその程度でシャント開存の程度がわかる.しかしながら対側シャントや動脈管が存在する場合には人工血管を閉鎖しても血圧変化がほとんどなく,この確認手技は有効ではないことが多い.シャントはそのデザイン,人工血管径,術者の縫合手技,アプローチ等が微妙に影響する手術手技であり,術後は低酸素血症の改善の度合いや肺血流増加による心不全に注意する.遠隔期には屈曲,吻合部狭窄,血栓閉塞,肺動脈の変形などにも注意する.
2. 肺動脈絞扼術(PAB)
高肺血流疾患に対して行われる姑息術で1952年にMullerとDammannにより初めて施行,報告された14).アプローチとしては胸骨正中切開と側開胸がある.これもBTシャントと同じく,最近は正中アプローチが増加傾向にあるが術者の好みにもより議論が分かれる.
手術手技
主肺動脈周囲を剥離しバンディングテープをかけ,絞扼方法は#5-0プロリン®を用いてU字縫合結紮にて行う.テープの種類としてはテフロンテープ,ゴアテックスなどがあり,通常は幅3 mm, 主肺動脈が短い症例では2 mmのものを用いる.Truslerの基準(周径=体重(kg)+21 mm)で絞扼を行い,適切な絞扼の程度はエコーで判断することが多く,絞扼部の最大流速が2心室修復例では3~3.5 m/sec,単心室例では3.5~4 m/secを目標とする.近年,左心低形成症候群などで多く行われるようになった両側肺動脈絞扼術の場合は胸骨正中切開でアプローチする.剥離は最小限にとどめ,まず左右肺動脈にシリコンテープを通す.筆者の場合は絞扼テープは幅2 mmのテフロンテープを用いている.左肺動脈,右肺動脈の順番に絞扼する.体重3 kg未満の症例では周径9 mm,3 kg以上の症例では10 mmを目標に絞扼する.左肺動脈絞扼を基準通りに絞扼した後に右肺動脈絞扼にて調節する.
注意点
術後合併症として絞扼テープのmigrationがあげられる.これは絞扼テープが遠位側にずれることによるが,右肺動脈が左肺動脈よりも先に分岐することに関連して右肺動脈狭窄+左肺動脈圧上昇の状態に陥る.手術の際に肺動脈周囲を過剰に剥離すると生じやすいと言われている.テープを肺動脈外膜に2~3か所で固定して予防を図る.
3. 動脈管開存症手術
手術手技
左第3–4肋間開胸でアプローチする.動脈管周囲を慎重に剥離し#1-0絹糸にて結紮する.体重500 g以下の低体重児では肺圧迫自体が危険なので最短時間で終了させるためにクリッピングを行うことが多い.また近年,胸腔鏡(内視鏡)を使用した動脈管閉鎖術も行われている.
注意点
未熟低体重児の動脈管開存症に対してはインドメタシンが有効なことがあるが1クール(3クールまで行う施設も多い)行っても効果がない場合は外科的閉鎖を考慮する.状態が悪化してからでは様々な合併症を併発する可能性が高くなる.手術時の大きな合併症は出血で細心の注意を払う必要がある.続いて大きな合併症は左反回神経麻痺である.また稀ではあるが乳び胸や左肺動脈狭窄,未熟児では大動脈狭窄がある.
1. 心房中隔欠損症(ASD)
手術手技
アプローチとしては胸骨正中切開によるものと右第4肋間開胸によるものがある15).側開胸例では右肺を圧排し心膜に逆T字切開を加え視野を展開する.上行大動脈,上大静脈,下大静脈にカニュレーションを行い体外循環を開始し,大動脈遮断・心停止下に右房を切開する(人為的細動器による電気的心室細動下に行うことも可能である).心房中隔欠損孔をよく確認し欠損孔下縁からの縫合糸で上縁に向かって連続縫合にて閉鎖する.再開通を防止する目的で閉鎖ラインの中央に一針補強の追加針を置く.下縁欠損型の場合は下縁形成後に上記の操作を行う.欠損孔が大きい場合には自己心膜を用いたパッチ閉鎖を行うこともある.大動脈基部から充分な空気抜きを施行した後,大動脈遮断を解除する.最後に心拍動下に右心房を連続縫合にて閉鎖し,体外循環から離脱する(Fig. 5, 6).
注意点
側開胸アプローチによる手術時に最も問題となるのは上行大動脈への送血管が挿入困難な場合である.無理な力で挿入を試みると大動脈解離の危険があるので充分な注意が必要である16).場合により右大腿動脈からの送血を考慮する.術後に注意すべき合併症としては遅発性心タンポナーデがある.また比較的稀ではあるが右横隔神経麻痺があげられる.
2. 心室中隔欠損症(VSD)
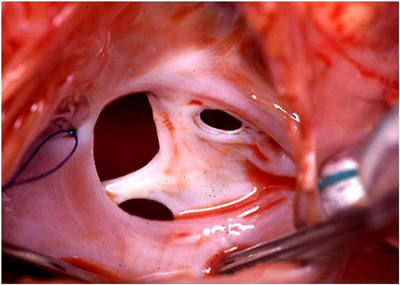
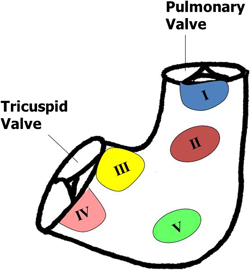
心室中隔欠損症は先天性心疾患の中で最も頻度の高いものであり,また様々な複雑心奇形に合併する.したがってその閉鎖法は小児心臓外科の基本中の基本であるとも言える.解剖学的分類としてはSoto-Anderson分類,van Praagh分類など様々なものが提唱されているが,筆者は東京女子医大心研分類17)を用いている(Fig. 7).本分類法は外科手技的見地からの分類でI型からV型に分類され,かつ欠損孔の位置と大きさによってはⅠ+Ⅱ型やⅡ+Ⅲ型といった表現法が可能であり,臨床上極めて有用である.
手術手技
胸骨正中切開にて到達する.上行大動脈送血,上下大静脈直接脱血にて体外循環を開始する.心停止下に欠損孔閉鎖を行う.肺動脈に縦切開をおくⅠ,Ⅱ型では主肺動脈に2本の支持糸を縫着する.以後,比較的多いⅠ型とⅢ型に関して病型ごとに述べる.
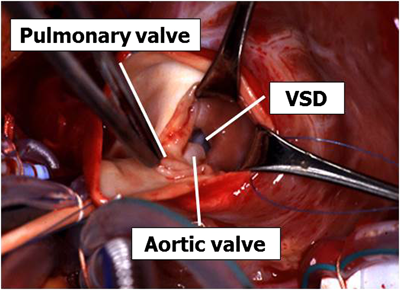
(Ⅰ型の場合(Fig. 8)) あらかじめ主肺動脈に縫着しておいた支持糸の間の主肺動脈を縦切開する.肺動脈弁輪ぎりぎりまで肺動脈弁交連部を避けて切開をすすめる.切開口から右室内に向かって筋鈎を挿入すると肺動脈弁下に大動脈弁尖逸脱を伴った欠損孔が見える.
プレジェット付き#5-0エムレーン®を用いてU字縫合を欠損孔の周囲に置く.肺動脈弁と接する部位では肺動脈弁輪越しにU字縫合を置く.パッチは0.4 mmゴアテックスパッチを用い,結節縫合にて縫着する.左心室から空気抜きをした後,上行大動脈ベントを併用しつつ大動脈遮断を解除する.主肺動脈,右房をそれぞれ#5-0プロリン®連続縫合にて閉鎖する.
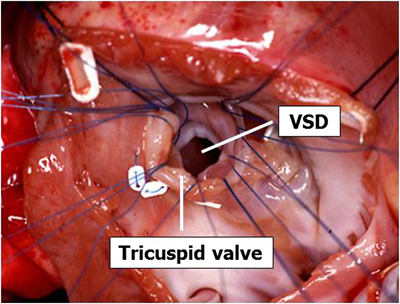
(Ⅲ型の場合(Fig. 9)) 経右房/経三尖弁的にアプローチする.2つの心内鈎を三尖弁輪に掛けて視野を展開する.欠損孔の位置,三尖弁との関係,内側乳頭筋(三尖弁前中隔交連を支持する小乳頭筋.VSDの伸展方向の確認に有用)との関係などを確認する.Outlet typeでは多くの場合,いわゆるmembranous flapが存在するが,この場合はこれを利用することができる.第一針目としてプレジェット付き#6-0エムレーン®を用いて,これをmembranous flapにかける.続いて反時計回りに2針目はプレジェット付き#6-0エムレーン®,3針目以降はプレジェット付き#5-0エムレーン®を用いてU字縫合を欠損孔の周囲に置く.0.4 mmゴアテックスパッチを用いて欠損孔を閉鎖する.明確なmembranous flapがない場合は三尖弁中隔尖を用いて後下縁から数mm離れるようにする.高度肺高血圧症の残存が懸念される場合には肺動脈圧モニターラインを主肺動脈から追加挿入して体外循環からの離脱を図る.また最近は#5-0プロリン®の連続縫合によるVSD閉鎖を行う外科医が増えてきた.筆者は症例により両方を使い分けている.
注意点
手術後の合併症としては①完全房室ブロック,②肺高血圧発作(PHクライシス),③術後心不全などがあげられる.①Ⅲ型の心室中隔欠損症では特に,刺激伝導系が欠損孔周辺を通過するため,閉鎖後の完全房室ブロックが懸念される.また肺高血圧発作は術前肺血管抵抗が高く肺血管抵抗の反応性の大きい症例,Down症候群などで起こりやすい.高肺血流症例の大きな欠損孔を閉鎖した場合は,相対的に過大なパッチ,急激な前負荷の減少,後負荷の増大のため左心室の動きが悪くなることがあるので,その場合はPDE阻害剤等を用いる.
3. ファロー四徴症(TOF)
チアノーゼ性心疾患の代表的疾患であり,根治手術は乳児期早期から積極的に行う施設と,シャント手術により肺動脈や左室の発育を促してから1~2歳で施行する施設がある.前者は早期にチアノーゼが消失するという利点がある一方,後述のtransannular patchの頻度が高く,遠隔期肺動脈弁逆流が危惧されたり残存狭窄に対する再手術の頻度が増加したり,左肺動脈が低形成な症例では術後末梢肺動脈狭窄を合併する可能性がある.一方,後者はチアノーゼ状態が長く続く,複数回の手術が必要という点が不利で,未だ議論がある.
手術手技
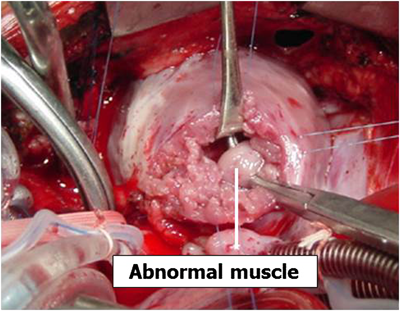
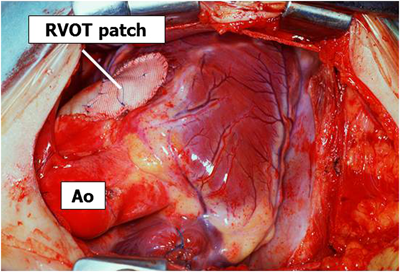
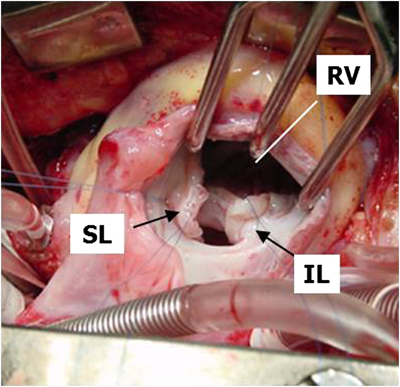
胸骨正中切開でアプローチする.シャント手術が施行されている症例では体外循環開始とともにシャントを結紮・切離する.体外循環を確立し大動脈遮断後,右心房を開け三尖弁越しに右室流出路の異常肥厚筋肉を可及的に切除する.VSDを確認したらこれをパッチで閉鎖する.続いて主肺動脈を縦切開し肺動脈弁(多くは二尖弁)を交連切開する.肺動脈弁輪温存可能例では右心房と肺動脈両方からの筋切除で右室流出路の拡大を行う.温存不可能例では主肺動脈から右室に切開をすすめてから流出路の異常筋肉をさらに切除する(Fig. 10).卵円孔(PFO)あるいはASDを閉鎖し大動脈遮断を解除する.自己心拍下に右室流出路にゴアテックスによる一弁付きパッチ(transannular patch)を縫着する(Fig. 11).右室流出路への切込みが5 mm以下と小さいものでは弁なし自己心膜パッチを用いることがある.術後に右室圧を計測して右室圧が充分に低下していることを確認する.右室流出路形成に関しては各施設で方法が異なり議論があるが,わが国では欧米と比べて右室切開を小さくしようという取り組みが早くからなされてきた18–20).左室低形成を示す例では左房圧持続モニタリングを行うこともある.
注意点
体外循環開始前に無酸素発作が起こることがある.麻酔科による対応に難渋する場合は可及的早くに体外循環を確立する.術後に注意すべき合併症としては完全房室ブロック,VSD遺残(筋切除した部位の近傍の他,心尖部に第二のVSDが存在する例もある),残存肺動脈狭窄がある.特に完全房室ブロックとなった場合はペースメーカーの挿入が必要となる.肺血流減少に伴う左室低形成などでは術後容量負荷の増大に伴う心不全が見られ,強心カテコラミン,血管拡張薬などの適切な使用が重要である.また,遠隔期に肺動脈弁逆流が進行すると肺動脈弁置換を要する場合がある.
4. 心内膜床欠損症(ECD)
共通房室弁口(CAVC),房室中隔欠損症(AVSD)とも言われる.VSDと比較して肺血管病変の進行が早い.不完全型,完全型,時に中間型に分類される.完全型は共通前尖の形態によりRastelli分類A,B,Cの3型に分類される.一期的修復か肺動脈絞扼術を介しての二期的修復かは施設間で議論が分かれるがDown症候群合併例では早期(生後3~4ヶ月)一期的修復が行われることが多い.
手術手技
完全型の根治手術方法(two-patch method)に関して述べる.大動脈遮断後に右心房を切開し心内をよく観察し,逆流テストを施行し共通房室弁を僧帽弁と三尖弁に分割する場所を決定する(Fig. 12).まず,舟型に切ったゴアテックスパッチを用いて湾曲のある方を心室中隔にプレジェット付き糸にて縫着する.心室中隔後半部では長いHis束,左脚右脚分岐部が頂上を走行するため右室側に縫合線をつくる.続いて#5-0もしくは#6-0プロリン®をVSDパッチ(右心室側),房室弁弁尖(僧帽弁と三尖弁を分けることになる),自己心膜パッチの順にU字に通しそれぞれを結紮する(通常7~8針).次に僧帽弁裂隙(cleft)を#6-0プロリン®を用いて,弁尖が脆弱な場合は自己心膜のストリップで補強しながら結節縫合にて閉鎖する.続いて一次口を先の自己心膜パッチで連続縫合にて閉鎖する.後方に偏位した房室結節の損傷を避けるために,房室結節,冠状静脈洞開口部周辺の縫合線の作製に注意し,それぞれを右房側,左房側に残す方法があり,筆者の場合は左房側に残す方法を多く用いている.空気抜きを充分に行ってから大動脈遮断を解除し,心拍動下に右心房を縫合閉鎖する.体外循環からの離脱に際しては必要に応じて肺動脈圧,左心房圧をモニターする.経食道エコーで有意な遺残病変がないことを確認する.また最近は心室間交通の浅い症例を中心に共通前尖・後尖を心室中隔頂上に固定し,心房間交通のみとしてパッチ閉鎖を行うmodified single patch法を用いる外科医が増えてきている21).
注意点
術後僧帽弁逆流が著明な場合は再度僧帽弁形成術を施行する必要があるが,それでも逆流がコントロールできない場合には人工弁置換を考慮しなければならない.房室ブロックの発生に注意する.また術後に注意すべき合併症としては肺高血圧発作(PHクライシス)がある.覚醒時に発生することが多く,Down症候群では特に注意が必要である.対処としては肺動脈圧モニターを指標とし,充分な鎮静,100%酸素加圧,肺血管拡張剤の投与を行う.術後数日経過すると発生は稀となる.遠隔期の僧房弁逆流は弁口中央部から生じる例が多い(裂隙縫合閉鎖の残存部).稀に術後左室流出路狭窄を生じる例がA型,不完全型などで見られる.
5. 総肺静脈還流異常症(TAPVC)
正常心では肺静脈はすべて左心房に還流しているが,本疾患ではすべての肺静脈が右心系に還流している.還流部位によりI型からIV型に分類される.ASDもしくはPFOが合併しないと生存不可能である.末梢性の肺静脈閉塞(PVO)を合併した症例や術前ショック例,Heterotaxy syndromeに合併した例では手術成績は依然不良であるが改善傾向にある22).全例手術適応がある.但し,共通肺静脈幹がないかあるいはあっても極めて細く,左心房と外科的に吻合することが不可能な症例は手術適応がない.手術方法はsuperior approach,right-sided lateral approach,posterior approach,cut-back法などがある.心臓超音波検査による診断が重要で,Ⅰ型,Ⅲ型では診断が確定したら直ちに手術を行う.術前に心臓カテーテル検査は施行しない.冠状静脈洞,右心房に還流しているⅡ型はPVOを発症する可能性が少ないため,緊急手術になることは少なく待機的に手術を行う.
手術手技
posterior approachに関して述べる.本法はI型,Ⅲ型の多くのタイプに有効である.体外循環を開始しPDAを閉鎖する.心尖部をガーゼ付きスパーテルにて挙上して視野を確保し共通肺静脈・垂直静脈を剥離する.大動脈を遮断し心停止を得るが,同時に右心房を切開し心臓の過進展を避ける.その後Ⅲ型の場合は垂直静脈を横隔膜を貫通する高さで切断し尾側断端を縫合閉鎖する.垂直静脈の中枢断端は左右上肺静脈の合流点まで縦切開し両尾側縁に#6-0プロリン®の支持糸をかけて尾側に牽引支持する.続いて左心耳に#6-0プロリン®の支持糸をかけて牽引しながら左心房に切開を加える.可及的に大きな無理のない吻合形態を念頭において#7-0プロリン®連続縫合にて頭側縁から共通肺静脈・左房吻合を行う.その後ASDを直接閉鎖して充分な空気抜きを行ってから大動脈遮断を解除し,心拍動下に右心房を縫合閉鎖する.通常,左房圧,肺動脈圧ラインを留置して体外循環を離脱する.胸骨閉鎖により循環動態が不安定になる例では,数日間の胸骨解放管理後,二期的胸骨閉鎖を行う.
注意点
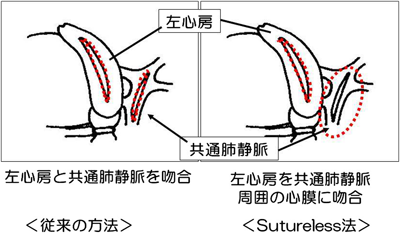
体外循環からの離脱時,術後早期の管理中は低心拍出量症候群,PHクライシスの発生に充分注意する.また,術後に注意すべき合併症の一つに吻合部閉塞PVOがあげられる.これは術後2~3ヶ月以内に生じることが多く,吻合部での組織増生や吻合のねじれが原因とされているが詳細な原因は不明である.無脾症候群症例に多い.再手術の際はsutureless法23)が有効である.最近は初回手術であってもsutureless法を用いる施設が増えている24,25).これにより発生頻度が減少するとの報告があるが長期成績はまだ不明である(Fig. 13).
6. 完全大血管転位症(complete TGA):動脈スイッチ手術
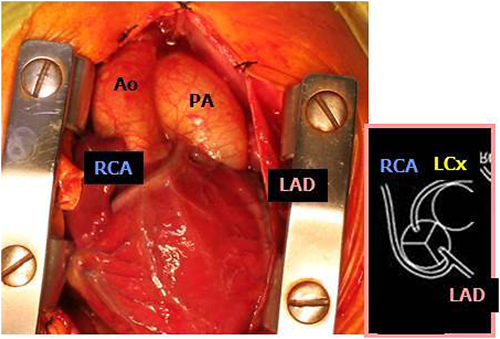
完全大血管転位症(TGA)は心室中隔欠損,肺動脈狭窄の有無により,Ⅰ~Ⅳ型に分類される.本稿ではⅠ,Ⅱ型に適応のある動脈スイッチ手術(Jatene手術)に関して述べる.様々な冠動脈パターンがあり,有名なものとしてはShaher分類26),Planche分類27)等がある(Fig. 14).生後しばらくすると肺血管抵抗の低下とともに左室圧が低下してくるため,Ⅰ型では比較的早期(通常生後2~3週以内)に手術を行う必要がある.また動脈スイッチ手術は肺動脈弁下型VSDを伴う両大血管右室起始症(DORV)に対しても行われる.
手術手技
体外循環を開始する前に大動脈と肺動脈を充分に剥離しておく.体外循環開始後に動脈管を切離する.大動脈遮断,心停止下に心室中隔欠損孔を合併している場合は最初に閉鎖を行う.上行大動脈を起始部より10 mmの位置で横切する.続いて冠動脈ボタンを切離し,肺動脈を大動脈と同じ高さで横切する.通常は冠動脈ボタンを移植する位置をJ型に縦切開し冠動脈に緊張がかからないように吻合移植する(Trapdoor法28)).縫合糸は#7-0プロリン®を用いることが多い.冠動脈移植が終了したら遠位肺動脈を上行大動脈の前方に移動させ(Lecompte手技29)),新大動脈再建を行う.新肺動脈基部は冠動脈ボタンをくり抜いた部分が欠損しているため,自己心膜パッチを用いて補填する.心房中隔欠損を閉鎖し,大動脈遮断解除を行う.この時点で冠動脈の膨らみ,心筋の色調,心室の動き,不整脈の有無を確認する.問題がなければ心拍動下に新肺動脈吻合を行い,最後に右心房を閉鎖する.通常,左房圧ラインを留置して体外循環を離脱する.胸骨閉鎖により循環動態が不安定になる例では,数日間の胸骨解放管理後,二期的胸骨閉鎖を行う.
注意点
動脈スイッチ手術の最大のポイントは冠動脈の移植である.緊張がかかったりねじれが生じたりすると心機能の著しい低下をもたらすだけでなく,重症不整脈の原因となったり手術死亡につながる.遠隔期の合併症としては肺動脈狭窄,新大動脈基部拡大,大動脈弁閉鎖不全,冠動脈閉塞などがある.肺動脈狭窄は再手術を要することも多い.軽微な大動脈弁逆流は進行することは稀である.
7. 左心低形成症候群(HLHS):Norwood手術
左心低形成症候群(HLHS)およびその類縁疾患(variant)に対するNorwood手術の成績は胎児診断をはじめとする術前診断管理の進歩,両側肺動脈絞扼術の導入,下行大動脈送血等の体外循環システムの発展などにより向上してきている.実際に日本胸部外科学会の学術統計によると2009年に新生児期39例(33.3%),乳児期78例(30.8%),1歳以上30例(6.7%)施行の成績30)が2011年には新生児期43例(25.6%),乳児期77例(19.5%),1歳以上7例(0%)となり,年々その成績は向上傾向にある(括弧内は在院死亡率)31).Norwood手術手技のポイントは①大動脈弓再建方法,②肺血流路の作製,③冠血流の確保などであると考えられる.②肺血流路の作製・選択に関してはBTシャント,右室肺動脈導管ともにそれぞれのadvantage/disadvantageがあり,更なる検討が必要であるとされている32).右室–肺動脈導管は歴史的にはNorwood自身による報告33)の後は1991年にImaiらが大動脈弓低形成を伴った三尖弁閉鎖症に施行したことを報告している34).1993年にKishimotoらがこの術式のHLHSへの応用を報告し35),2000年代にSanoらによって広く世界中に広められた経緯がある36,37).
手術手技
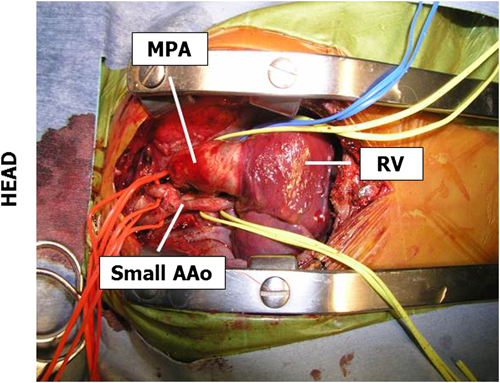
胸骨正中切開にてアプローチする.充分な剥離を行い,neck vessel 3本,上行大動脈,主肺動脈,左右肺動脈,下行大動脈をtapingする.この時,特にneck vesselを充分に遠位側まで剥離しておくことが重要である(Fig. 15).腕頭動脈に3.5 mmのePTFE graftを#7-0プロリン®にて端側吻合する.これを利用して上半身の送血路とし,下行大動脈送血(PDAから下行,あるいは横隔膜直上からの送血)を併用した脳分離体外循環を使用する.両側肺動脈絞扼術後のことが多いが,その際はまず左右肺動脈のbanding tapeを慎重に除去する.時間が経っているものでは容易に肺動脈の損傷・断裂等を来すことがある.その後,動脈管を#1-0絹糸で2重結紮し,その間で切離する.肺動脈側は#6-0プロリン®にて追加縫合する.動脈管を切断すると下行大動脈の視野展開が良くなる.続いて大動脈遮断,心筋保護液注入を行う.右心房を縦切開し,心房中隔欠損孔の拡大を行う.この後,主肺動脈を分岐部で切断する.この時,左右肺動脈入口部と肺動脈弁をよく確認することが重要である.左右肺動脈には4~5 mmのHegar拡張器(計測器)が入れば充分であり,無理をするとbanding siteの損傷を来すので要注意である.BTシャント例では末梢肺動脈側を直接閉鎖あるいは自己心膜を用いてパッチ閉鎖するが,右室–肺動脈導管例では人工血管を縫着する.大動脈縮窄部位を挿入する動脈管組織と共に切除し,後壁部分を端々吻合する.その後大動脈弓部から下行大動脈にかけて狭窄を残さないように主肺動脈の直接吻合を行い,新大動脈弓再建を行うが,充分な吻合口がとれない場合にはパッチ補填形成を追加する.上行大動脈が太い例ではSwing-back法38–40)を行うこともある.最後にBTシャントの肺動脈側吻合あるいは右室–肺動脈心外導管の右室流出路への吻合を行う.充分な補助循環を行い血行動態が安定したら体外循環からの離脱を行うが,通常は胸骨ブリッジを施し,皮膚をGore-Tex sheetで被包して開胸のまま手術を終了する.
注意点
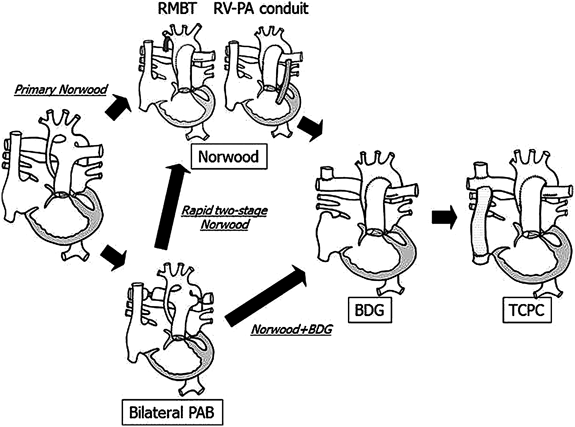
Norwood手術は術後管理が最も難しい手術のひとつである.新生児に長時間の体外循環という負荷をかけている点と術後刻々と変化する肺血管抵抗がその原因である.両側肺動脈絞扼術はこうした新生児期のリスクを回避するのみならず,新生児期体外循環の遠隔期中枢神経に及ぼす影響の点からも最近多くの施設で採用されている.また一時期,両側肺動脈絞扼術後生後4ヶ月まで待機してNorwood手術とGlenn手術を同時に行うstrategy(Norwood+BDG)が流行したが,遠隔期の肺動脈狭窄等のmorbidityを考慮して,最近は両側肺動脈絞扼術後1~2ヶ月でNorwood手術を行う(Rapid two-stage Norwood)施設が増加しつつある(Fig. 16)41).
- ①術後高肺血流および体循環不全による心不全 最も注意すべき合併症のひとつ.高肺血流による心不全の兆候としてはマイナスに傾くB.E.,高い乳酸値があげられ頻回の動脈血ガス分析検査が必要である.PaO2: 40 mmHg以上,PaCO2: 30 mmHg以下は要注意と考え,人工呼吸器条件の変更でPaO2,PaCO2をコントロールする.FiO2を21%にしてもPaO2を40 mmHg以下にコントロールできない場合は窒素ガス(N2)の混入を考慮し,場合によっては再開胸してシャントや心外導管のクリッピングを行わねばならない場合もある.SpO2は70~80%がひとつの目安であるが,個々の患児の心機能とのバランスで決定される.
- ②高肺血管抵抗による低酸素血症 上記とは逆に術後急性期には高肺血管抵抗による低酸素血症を認めることがある.FiO2を100%にしてもPaO2が25 mmHgを維持できない場合には一酸化窒素ガス(NO)の使用やECMOの導入を考慮する.
- ③大動脈縮窄残存 大動脈縮窄残存reCoAは重要な術後合併症であり上下肢血圧差15~20 mmHg以上は急性期を乗り切ることが困難である.また急性期を乗り越えたとしても遠隔期の心機能低下等が懸念されるため,積極的な解除が必要であるとされている42).
8. 両方向性Glenn手術(BDG),Fontan/TCPC型手術
フォンタン型手術は1971年,フランスのFontanが初めて報告した右心バイパス手術であり43),体静脈からの血流が定常流として肺循環に灌流することを特徴とする.最初は三尖弁閉鎖症に用いられたが,その後適応が拡大され現在では二心室修復術が不可能なすべての疾患に適応がある.様々な術式の変遷があり,現在ではTCPC型手術として,側方トンネル法と心外導管法44)が広く施行されている.また最近では両方向性グレン手術を先行させる段階的フォンタン手術が多くの施設で施行され,フォンタン型手術のリスクを分散させ急性期術後経過を改善させると考えられている45).しかしながら,通常の二心室修復術と比較してフォンタン循環は少ない心拍出量,高い中心静脈圧など多くの問題を含んでいて,長期遠隔成績に関してはまだ未知の部分が多い.1977年に発表されたChoussatの基準(10項目)46)が有名であるが現在これを用いている施設はない.手術リスクとして一般的に考えられているのは年齢(2歳以下),肺血管抵抗(3単位以上),平均肺動脈圧(15 mmHg以上),肺動脈のサイズ(PA index47)150 mm2/m2以下),肺動脈の変形,心機能低下,中等度以上の房室弁逆流,TAPVCなどの合併病変などであるが,最も重要なのは肺血管抵抗と心室機能である.両方向性グレン手術を先行させている場合は肺動脈圧が14~15 mmHgが限界とされている.近年,フォンタン型手術の低年齢化が顕著である.我が国でも10ヶ月での報告がある48).平均では3~4歳くらいであるが,施設によっては積極的に低年齢で施行しており,1歳代の症例も多い.一方,段階的フォンタン手術を選択する場合は,両方向性グレン手術を施行した後2年以上の期間をおいた場合に肺動静脈瘻が生じる可能性が高いため,6ヶ月から1年以内にフォンタン型手術に進む必要があるとされている.
手術手技
最も多く施行されている心外導管法に関して述べる.上行大動脈送血,上下大静脈脱血にて体外循環を確立した後,一期的フォンタン手術の場合はグレン吻合をまず行う.完全体外循環,心拍動下に上大静脈をボタロー鉗子を用いて右肺動脈下端の高さで遮断・切断し心臓側を#5-0プロリン®にて2重縫合閉鎖する.続いて右肺動脈に切開を入れ上大静脈と#6-0プロリン®連続吻合にてグレン吻合を完成する.この際肺動脈形成が必要な症例では併せて施行する.段階的フォンタン手術症例ではここまでが前回に施行されていることになる.続いて心拍動下に下大静脈と右心房の接合部をボタロー鉗子を用いて遮断し,下大静脈を切断する.心臓側は#4-0プロリン®にて2重縫合閉鎖する.心内操作が必要な症例(ASD拡大,房室室弁修復など)では心停止下に施行し,上記の操作も併せて行う.続いてグラフトの吻合に移る(ゴアテックス人工血管:径16~18 mm).#5-0プロリン®を用いて連続吻合でグラフトと下大静脈を吻合する.次に肺動脈下面に大きめの切開を入れグラフトの他端と#6-0プロリン®にて連続吻合する.術後に高いCVPが予想されたり,低心機能を呈する症例ではあらかじめfenestrationを作製することもある(fenestrated TCPC).Gore-Tex人工血管と心房の間に細い人工血管を留置する方法や直接吻合する方法(kissing anastomosis)49)などがある.体外循環から離脱したら止血を充分に行い,左右胸腔と胸骨下にドレーン(計3本)を挿入し閉胸する.
注意点
- ①手術時の異変への対処 体外循環からの離脱に際して中心静脈圧(CVP)が18 mmHg以上の症例ではfenestrationをおく.
- ②術後合併症 ドレーン排液の性状に充分注意する.CVPが高めの症例では時に乳び胸を合併するので,その際には低脂肪食あるいは絶食を考慮する.また横隔神経麻痺はフォンタン循環を阻害する要因であるため,血行動態が不安定(ドレーン排液量が多い)であったり,長期間改善が認められない場合は積極的な縫縮術を考慮する.
- ③遠隔期の合併症で問題となるのは肝機能障害,不整脈,タンパク漏出性胃腸症50,51)などである.
引用文献References
1) 今井康晴:複雑心奇形の手術.メジカルビュー社,東京,2001
2) Jonas RA: Comprehensive surgical management of congenital heart disease. New York, Arnold, 2004
3) Gibbon JH Jr: Application of mechanical heart and lung apparatus to cardiac surgery. Minn Med 1954; 37: 171–185
4) Hessel EA 2nd: A brief history of cardiopulmonary bypass. Semin Cardiothorac Vasc Anesth 2014; 18: 87–100
5) Miura T, Sakamoto T, Kobayashi M, et al: Hemodilutional anemia impairs neurologic outcome after cardiopulmonary bypass in a piglet model. J Thorac Cardiovasc Surg 2007; 133: 29–36
6) 坂本貴彦,青木 満,新岡俊治,ほか:小児体外循環におけるpH strategy—その理論と実際—.日小循会誌,2007; 23: 28–32
7) 小林真理子,田ノ上禎久,江藤政尚,ほか:日本の小児心筋保護液使用状況—アンケート調査結果—.日小循会誌,2007; 23: 533–543
8) Fujiwara T, Heinle J, Britton L, et al: Myocardial preservation in neonatal lambs: Comparison of hypothermia with crystalloid and blood cardioplegia. J Thorac Cardiovasc Surg 1991; 101: 703–712
9) Soul JS, Robertson RL, Wypij D, et al: Subtle hemorrhagic brain injury is associated with neurodevelopmental impairment in infants with repaired congenital heart disease. J Thorac Cardiovasc Surg 2009; 138: 374–381
10) Kussman BD, Wypij D, Laussen PC, et al: Relationship of intraoperative cerebral oxygen saturation to neurodevelopmental outcome and brain magnetic resonance imaging at 1 year of age in infants undergoing biventricular repair. Circulation 2010; 122: 245–254
11) Hirsch JC, Jacobs ML, Andropoulos D, et al: Protecting the infant brain during cardiac surgery: A systematic review. Ann Thorac Surg 2012; 94: 1365–1373
12) Blalock A, Taussig HB: The surgical treatment of malformations of the heart in which there is pulmonary stenosis or pulmonary atresia. JAMA 1945; 128: 189–202
13) de Leval MR, McKay R, Jones M, et al: Modified Blalock-Taussig shunt: Use of subclavian artery orifice as flow regulator in prosthetic systemic-pulmonary artery shunts. J Thorac Cardiovasc Surg 1981; 81: 112–119
14) Muller WH, Dammann JF: The treatment of certain congenital malformations of the heart by the creation of pulmonary stenosis to reduce pulmonary hypertension and excessive pulmonary blood flow: A preliminary report. Surg Gynecol Obstet 1952; 95: 213–219
15) 青木 満,原 真理子,佐々木 章:小切開右開胸アプローチによる心房中隔欠損症手術と体外循環法.心臓手術の実際.東京,秀潤社,2013, pp 150–159
16) Hibino N, Harada Y, Hiramatsu T, et al: Intraoperative aortic dissection in pediatric heart surgery. Asian Cardiovasc Thorac Ann 2006; 14: e55–e57
17) 龍野勝彦,今野草二:心室中隔欠損症の外科解剖.心臓,1970; 2: 775
18) Kurosawa H, Imai Y, Nakazawa M, et al: Standardized patch infundibuloplasty for tetralogy of Fallot. J Thorac Cardiovasc Surg 1986; 92: 396–401
19) Kurosawa H, Imai Y, Nakazawa M, et al: Conotruncal repair of tetralogy of Fallot. Ann Thorac Surg 1988; 45: 661–666
20) Kurosawa H, Morita K, Yamagishi M, et al: Conotruncal repair for tetralogy of Fallot: Midterm results. J Thorac Cardiovasc Surg 1998; 115: 351–360
21) Jonas RA, Mora B: Individualized approach to repair of complete atrioventricular canal: Selective use of the traditional single-patch technique versus the Australian technique. World J Pediatr Congenit Heart Surg 2010; 1: 78–86
22) Ota N, Fujimoto Y, Murata M, et al: Improving outcomes of the surgical management of right atrial isomerism. Ann Thorac Surg 2012; 93: 832–838
23) Lacour-Gayet F, Zoghbi J, Serraf AE, et al: Surgical management of progressive pulmonary venous obstruction after repair of total anomalous pulmonary venous connection. J Thorac Cardiovasc Surg 1999; 117: 679–687
24) Oshima Y, Yoshida M, Maruo A, et al: Modified primary sutureless repair of total anomalous pulmonary venous connection in heterotaxy. Ann Thorac Surg 2009; 88: 1348–1350
25) Yoshimura N, Oshima Y, Henaine R, et al: Sutureless pericardial repair of total anomalous pulmonary venous connection in patients with right atrial isomerism. Interact Cardiovasc Thorac Surg 2010; 10: 675–678
26) Shaher RM, Puddu GC: Coronary arterial anatomy in complete transposition of the great vessels. Am J Cardiol 1966; 17: 355–361
27) Planché C, Bruniaux J, Lacour-Gayet F, et al: Switch operation for transposition of the great arteries in neonates. A study of 120 patients. J Thorac Cardiovasc Surg 1988; 96: 354–363
28) Brawn WJ, Mee RB: Early results for anatomic correction of transposition of the great arteries and for double-outlet right ventricle with subpulmonary ventricular septal defect. J Thorac Cardiovasc Surg 1988; 95: 230–238
29) Lecompte Y, Zannini L, Hazan E, et al: Anatomic correction of transposition of the great arteries. J Thorac Cardiovasc Surg 1981; 82: 629–631
30) Sakata R, Fujii Y, Kuwano H; Committee for Scientific Affairs: Thoracic and cardiovascular surgery in Japan during 2009: Annual report by the Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg 2011; 59: 636–667
31) Amano J, Kuwano H, Yokomise H: Thoracic and cardiovascular surgery in Japan during 2011: Annual report by The Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg 2013; 61: 578–607
32) Ohye RG, Sleeper LA, Mahony L, et al: Pediatric Heart Network Investigators: Comparison of shunt types in the Norwood procedure for single-ventricle lesions. N Engl J Med 2010; 362: 1980–1992
33) Norwood WI, Lang P, Castaneda AR, et al: Experience with operations for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 1981; 82: 511–519
34) Imai Y, Kurosawa H, Fujiwara T, et al: Palliative repair of aortic atresia associated with tricuspid atresia and transposition of the great arteries. Ann Thorac Surg 1991; 51: 646–648
35) Kishimoto H, Iio M, Kume Y, et al: The Norwood operation for hypoplastic left heart syndrome using a valved pericardial roll between the right ventricle and pulmonary artery [abstract]. Cardiol Young 1993; 3: 162
36) Sano S, Ishino K, Kawada M, et al: Right ventricle-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2003; 126: 504–509
37) Sano S, Ishino K, Kado H, et al: Outcome of right ventricle-to-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome: A multi-institutional study. Ann Thorac Surg 2004; 78: 1951–1957
38) Liddicoat JR, Reddy VM, Hanley FL: New approach to great-vessel reconstruction in transposition complexes with interrupted aortic arch. Ann Thorac Surg 1994; 58: 1146–1150
39) Naito Y, Harada Y, Uchita S, et al: A novel aortic arch reconstruction method for double-inlet left ventricle with interrupted aortic arch and restrictive bulboventricular foramen. J Thorac Cardiovasc Surg 2006; 131: 475–477
40) Kosaka Y, Sakamoto T, Suetsugu F, et al: Outcomes of swing-back aortic arch repair in arterial switch and Norwood operations. Eur J Cardiothorac Surg 2013; 43: 1244–1246
41) Sakamoto T, Harada Y, Kosaka Y, et al: Second-stage palliation after bilateral pulmonary artery bands for HLHS and its Variants—Which is Better, Modified Norwood or Norwood Plus Bidirectional Glenn? World J Pediatr Congenit Heart Surg 2011; 2: 558–565
42) Larrazabal LA, Selamet Tierney ES, Brown DW, et al: Ventricular function deteriorates with recurrent coarctation in hypoplastic left heart syndrome. Ann Thorac Surg 2008; 86: 869–874
43) Fontan F, Baudet E: Surgical repair of tricuspid atresia. Thorax 1971; 26: 240–248
44) Marcelletti C, Corno A, Giannico S, et al: Inferior vena cava-pulmonary artery extracardiac conduit. A new form of right heart bypass. J Thorac Cardiovasc Surg 1990; 100: 228–232
45) Bridges ND, Jonas RA, Mayer JE, et al: Bidirectional cavopulmonary anastomosis as interim palliation for high-risk Fontan candidates. Early results. Circulation 1990; 82 (5 Suppl): IV170–IV176
46) Choussat A, Fontan F, Besse P, et al: Selection criteria for Fontan’s procedure, in Anderson RH, Shinebourne EA (eds): Pediatric Cardiology 1977; pp 559–566, Edinburgh, Churchill Livingstone, 1978
47) Nakata S, Imai Y, Takanashi Y, et al: A new method for the quantitative standardization of cross-sectional areas of the pulmonary arteries in congenital heart diseases with decreased pulmonary blood flow. J Thorac Cardiovasc Surg 1984; 88: 610–619
48) 坂本喜三郎,横田通夫,曲 人伸,ほか:10ヶ月の純型肺動脈閉鎖症に対するFontan手術成功例,心臓,1992; 24: 417–422
49) Kreutzer C, Schlichter AJ, Simon JL, et al: A new method for reliable fenestration in extracardiac conduit Fontan operations. Ann Thorac Surg 2003; 75: 1657–1659
50) Feldt RH, Driscoll DJ, Offord KP, et al: Protein-losing enteropathy after the Fontan operation. J Thorac Cardiovasc Surg 1996; 112: 672–680
51) Mertens L, Hagler DJ, Sauer U, et al: Protein-losing enteropathy after the Fontan operation: An international multicenter study. PLE study group. J Thorac Cardiovasc Surg 1998; 115: 1063–1073