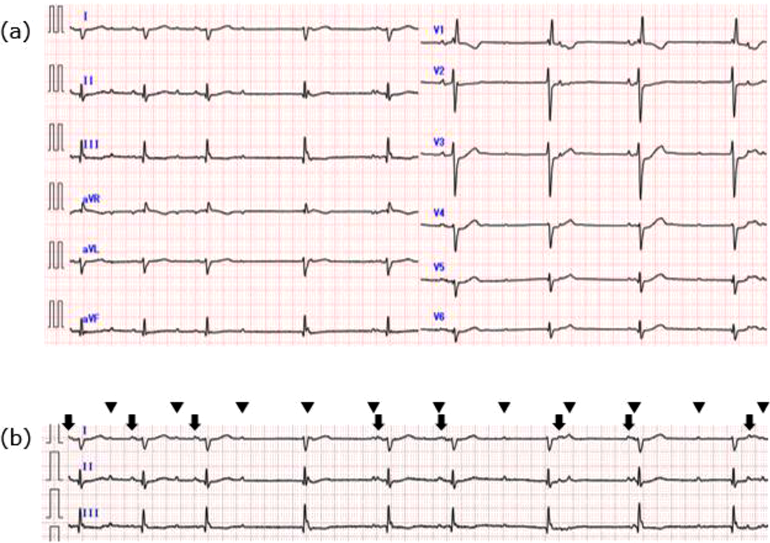
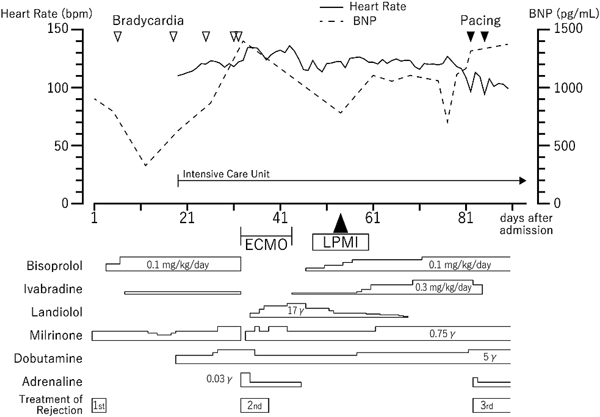
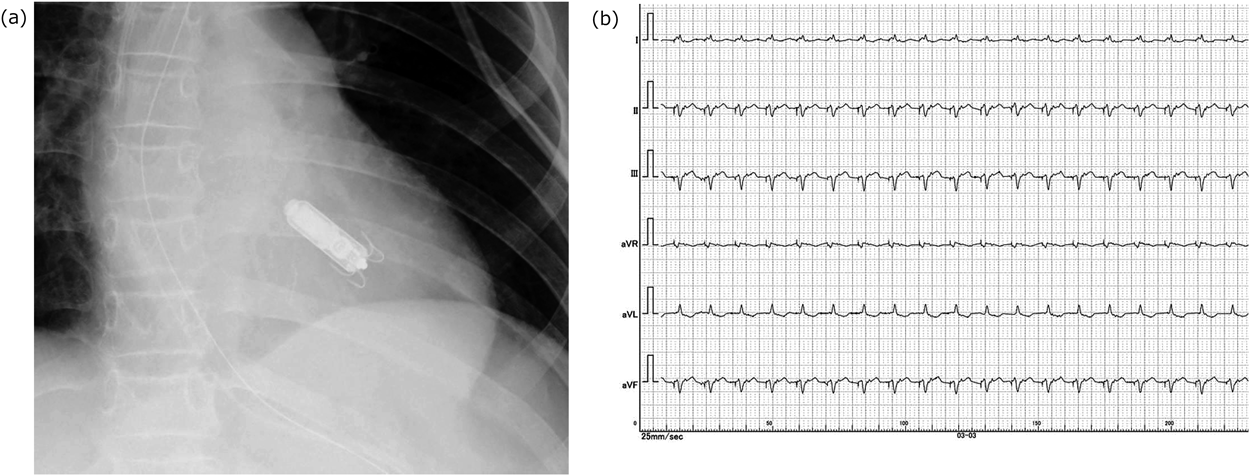
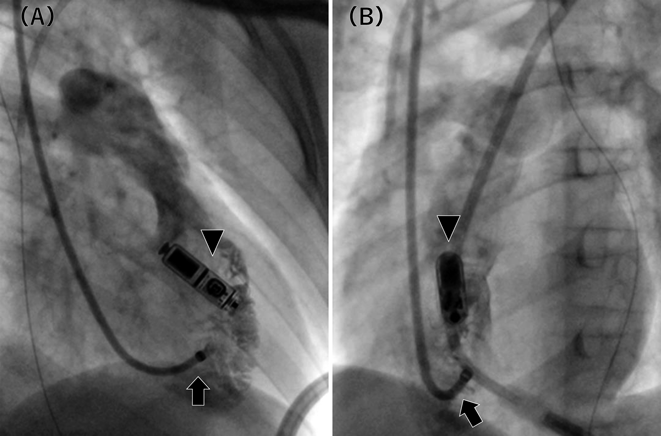
リードレスペースメーカ植込み術を施行した小児の1例A Pediatric Case of Leadless Pacemaker Implantation
佐藤 要1,小島 敏弥2,大森 紹玄1,小川 陽介1,田中 優1,白神 一博1,益田 瞳1,浦田 晋1,松井 彦郎1,柴田 深雪3,平田 康隆3,小野 稔3,加藤 元博1,犬塚 亮1Kaname Satoh1, Toshiya Kojima2, Akiharu Omori1, Yosuke Ogawa1, Yu Tanaka1, Kazuhiro Shiraga1, Hitomi Masuda1, Susumu Urata1, Hikoro Matsui1, Miyuki Shibata3, Yasutaka Hirata3, Minoru Ono3, Motohiro Kato1, Ryo Inuzuka1
1 東京大学医学部附属病院小児科Department of Pediatrics, The University of Tokyo Hospital ◇ Tokyo, Japan
2 東京大学医学部附属病院循環器内科Department of Cardiovascular Medicine, The University of Tokyo Hospital ◇ Tokyo, Japan
3 東京大学医学部附属病院心臓外科Department of Cardiothoracic Surgery, The University of Tokyo Hospital ◇ Tokyo, Japan
受付日:2021年12月8日Received: December 8, 2021
受理日:2022年2月10日Accepted: February 10, 2022
発行日:2022年2月1日Published: February 1, 2022