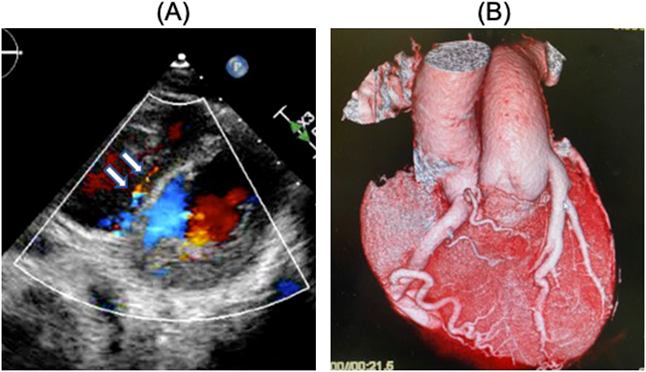
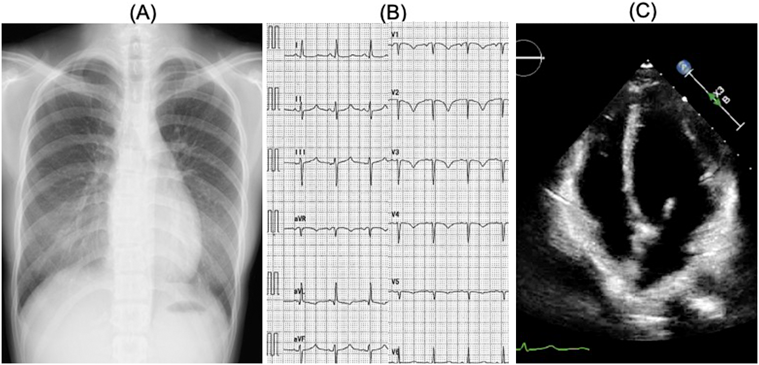
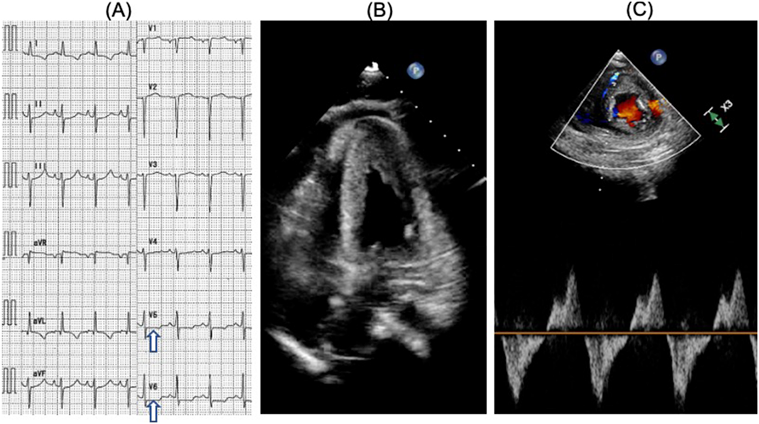
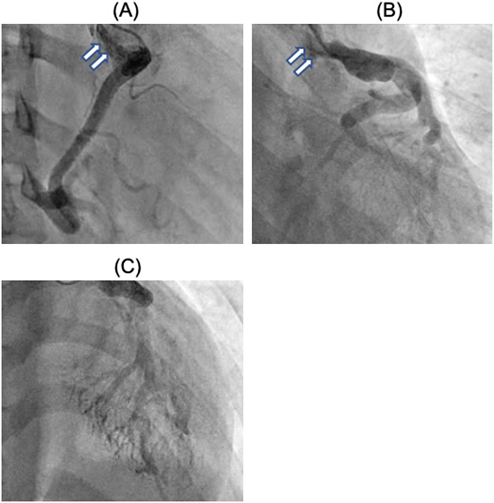
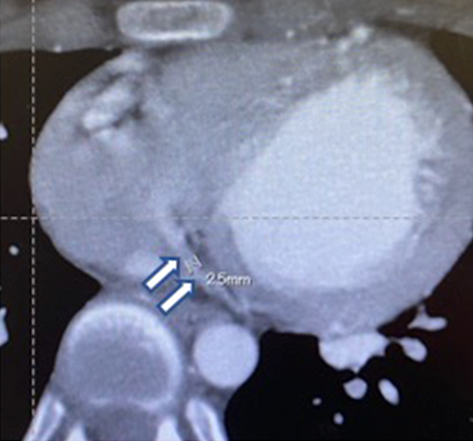
成人型ALCAPA患者の術後心不全を認めた1例:その原因についてPostoperative Heart Failure in a Teen with Anomalous Origin of the Left Coronary Artery from the Pulmonary Artery: A Case Report Regarding Mechanisms
1 JCHO中京病院中京こどもハートセンター小児循環器科Department of Pediatric Cardiology, Chukyo Children Heart Center, Japan Community Health Care Organization Chukyo Hospital ◇ Aichi, Japan
2 JCHO中京病院中京こどもハートセンター心臓血管外科Department of Cardiovascular Surgery, Chukyo Children Heart Center, Japan Community Health Care Organization Chukyo Hospital ◇ Aichi, Japan