人工血管を用いたmodified Blalock–Taussig(mBT)シャント術はチアノーゼ性先天性心疾患の患者に対し,肺血流確保のために施行される姑息術である.
mBTシャント術後の稀な合併症として感染性動脈瘤の報告が散見される1, 2).mBTシャント術後感染性動脈瘤はシャント閉塞により低酸素血症や,動脈瘤破裂といった致死的な経過をたどる可能性があるため,迅速な診断と治療が重要となる2–4).過去の報告では瘤からの出血予防,安全な瘤の切除,新たな肺動脈への血行路再建に対し,さまざまな方法が用いられており,画一した治療方法はない1, 5).
今回,ファロー四徴症に対し施行したmBTシャント術後に感染性動脈瘤を発症し,カテーテル治療とのハイブリッド手技を行い救命できた症例を経験したので報告する.
症例
生後5か月,男児
診断
ファロー四徴症,右側大動脈弓,左鎖骨下動脈起始異常,22q11.2欠失症候群,左mBTシャント造設術後
主訴
低酸素血症
周産期歴
在胎40週1日,体重2,784 g Apgar score 8(1分値)/8点(5分値)
既往歴
出生後に低酸素血症が遷延し,前医入院となり心臓超音波検査でファロー四徴症が疑われた.精査加療目的に日齢0に当院新生児集中治療室(NICU)へ搬送入院となり,ファロー四徴症,右側大動脈弓,左鎖骨下動脈起始異常症の診断となった.当院入院時エコーでは動脈管はすでに閉鎖していた.肺動脈弁下狭窄による酸素化低下が進行し,日齢11にプロプラノロール導入を行ったが,その後も低酸素血症の進行を認めた.日齢13に酸素投与,日齢29にフェノバルビタール内服を開始し,日齢94に正中切開アプローチでmBTシャント造設(左総頸動脈から主肺動脈分岐部3.5 mm人工血管)を施行された.術後経過は良好で,術後6日目に抜管,術後9日目に中心静脈ラインを抜去した.その後,炎症反応の陰性化までは確認しなかったが改善傾向であり,発熱などの明らかな感染症状は認めなかったため日齢136に新生児科から退院となった.退院時SpO2は80~90%(室内気)であった.
現病歴
生後5か月(新生児科退院1か月後)の外来受診時に安静時SpO2 70%と酸素化低下を認めた.胸部聴診で広範囲にLevine II/VI度の連続性雑音を聴取し,経胸壁心臓超音波検査では,体動と術後によるエコーウィンドウの狭さのため十分な評価が行えなかったが,mBTシャントの近傍に肺動脈方向への血流も認めた.そのため,その時点ではシャント閉塞は疑われず,在宅酸素導入と水分量増量にて経過観察となったが,酸素化の改善は認めなかった.外来受診の3日後,啼泣時にSpO2 60%(酸素1.5 L/分)まで低下を認めたため精査加療目的に緊急入院となった.
入院時現症
身長61.5 cm,体重6.63 kg,体温37.1°C,呼吸数38回/分,脈拍186回/分,収縮期血圧96 mmHg,SpO2 70%(酸素1.5 L/分)
口唇チアノーゼあり.心音は整・第2肋間胸骨左縁にLevineII/VI度の連続性雑音を聴取した.腹部・四肢に特記事項なし.
【血液検査】WBC 20360/µL, Hb 13.8 g/dL, AST 29 U/L, ALT 18 U/L, BUN 8 mg/dL, Cre 0.23 mg/dL, CRP 3.51 mg/dL, PT-INR 1.08 APTT 40.8秒
【尿検査】定性・沈渣ともに正常
【血液培養検査】Staphylococcus capitis(+)(3セット中2セットから検出)
【胸部単純X線検査】CTR 58%,明らかな肺炎像や胸水は認めなかった.
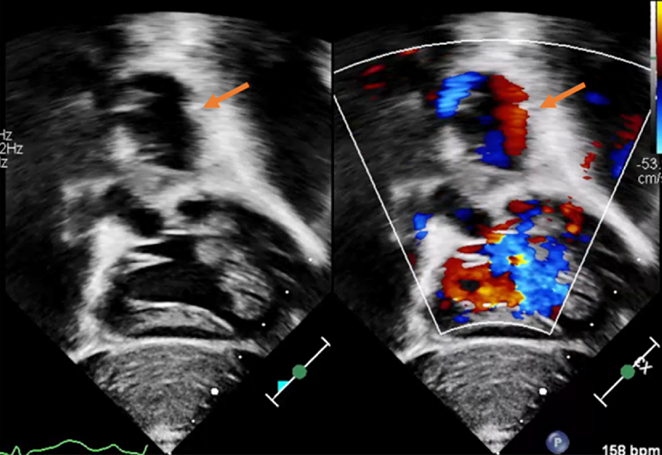
【心臓超音波検査】mBTシャント周囲に退院前エコーでは認めなかった血液の流入を伴う管腔構造を認めた(Fig. 1).
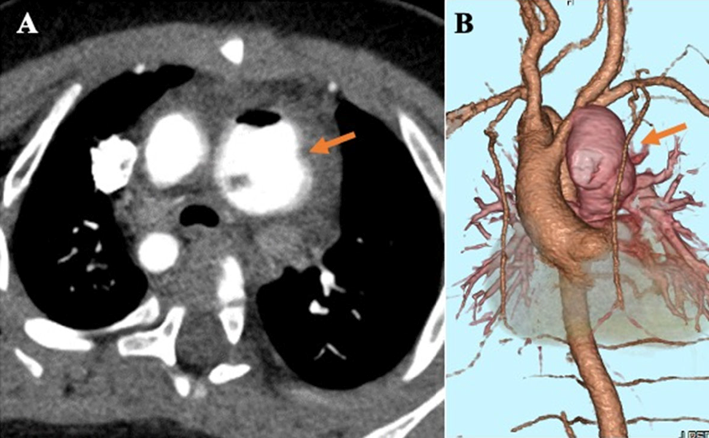
【胸部造影CT検査】mBTシャント部位に一致した動脈瘤を認めた(Fig. 2A, B).
入院後経過
新生児科退院から今回の入院の経過中に明らかな発熱は認めなかったが,血液検査での炎症反応上昇,エコー所見,造影CT検査,血液培養検査結果から,Staphylococcus capitis(S. capitis)によるmBTシャント術後の感染性動脈瘤及びシャント不全に伴う低酸素血症を疑った.動脈瘤の摘出と新たな肺血流確保のための手術が必要と考えられたが,感染のコントロールをつけてから手術を行う方針となり,入院日よりセフェピム(CFPM),バンコマイシン(VCM)投与を開始した.薬剤感受性結果をもとに入院4日目からCFPMは中止した.入院翌日には血液培養検査は陰性化したが,その後も炎症反応の陰性化は認めなかった.感染巣である動脈瘤の摘出が必要と考えられ,手術を行う方針となった.造影CT(Fig. 2 A)では,動脈瘤位置が胸骨直下に存在しており,胸骨正中切開の際に破裂や出血のリスクが高いと考えられた.そのため,手術時にカテーテルによる動脈瘤への流入血流の調節を併用するハイブリッド手技を行う方針とした.過去の冠動脈用カバードステントで動脈瘤の流入部を閉塞した報告3, 4)を参照に,末梢血管用カバードステントやバルーンカテーテルにより瘤の開口部を一時的に閉塞し,瘤除去後にステントを抜去することを検討したが,瘤切除後にステントを外科的に抜去することは困難と考えられた.感染制御ができていない状況下で人工物を体内に残すことは好ましくないため,総頸動脈からバルーンカテーテルを留置し,血流を遮断する方法を選択した.また,同じ理由から,新たにmBTシャントを造設することはシャント感染のリスクが高いと考えられたため,肺血流確保のために自己心膜による右室流出路拡大術と肺動脈弁下狭窄解除術を行う方針とした.
手術経過
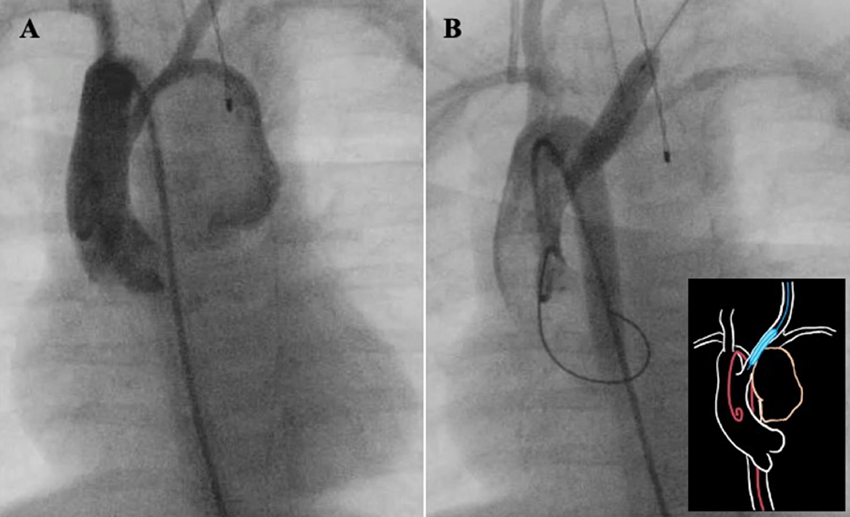
入院10日目に手術を行った.右大腿動脈に4 Frシースを留置し,ピッグテールカテーテルを用いて大動脈造影を行い,動脈瘤の形態と流入血管の開口部位置を確認した.(Fig. 3A)次にカットダウン法により,左総頸動脈に4 Frシースを留置し,Sterling™ Balloon Dilatation Catheter 6/20 mm(Boston Scientific Japan)を挿入し動脈瘤の開口部にバルーンインフレーションを行った.バルーンを留置したまま,再度ピッグテールカテーテルで大動脈造影を行い,動脈瘤が描出されないことが確認できた.(Fig. 3B)バルーン留置によるSpO2の低下や脳組織酸素飽和度(rSO2)の低下などのバイタル変化も認めず,引き続き,胸骨正中切開を行った.動脈瘤を損傷することなく開胸を行うことができ,続いて上行大動脈送血,上下大静脈脱血で体外循環を確立したうえで動脈瘤切除を行った.動脈瘤を切開し内腔を確認したが,明らかな壁の損傷は認めず,内腔から中枢側を確認すると適正な位置に拡張したバルーンを確認できた.シャント血管は瘤内に確認され,総頸動脈吻合側,肺動脈吻合側ともに全周性に縫合破綻し閉塞していた.動脈瘤を形成した総頸動脈の中枢側と末梢側を十分に剥離した後にバルーンを抜去し,ただちに血流遮断を行った.瘤切除後の総頸動脈は直接閉鎖を行った.その後,心停止下で右室流出路形成を行った.手術時の肺動脈弁輪径は4.7 mm(zスコア−4.62)で,開放制限も認めており,将来的にも肺動脈弁の温存は困難と考えられた.また,主肺動脈径は術前の造影CTで5.3 mm(zスコア−4.04)と低形成であったため,肺動脈をBTシャント吻合部から肺動脈弁輪を越えて右室流出路まで切開し,右室流出路から見える範囲内で弁下狭窄の解除を行い,右室流出路前面の拡大を行った.感染のコントロールがついていない状態での手術であり,人工物の使用を避けるため,右室流出路の拡大にはグルタルアルデヒド処理した自己心膜を用いた.手術中に提出したシャント血管の培養検査でもS. capitisが検出され,同菌による感染性仮性動脈瘤と診断した.
抗生剤加療期間は,術後から計6週間の抗生剤加療を行い全身状態良好に経過し,術後も明らかな運動神経麻痺などの後遺症もなかったため術後56日目で退院となった.
mBTシャント術はチアノーゼ性先天性心疾患において一般的に行われている姑息術である.
mBTシャント術後の一般的な合併症として術後早期のシャント閉塞や狭窄,肺血流の増加があり,晩期の稀な合併症として仮性動脈瘤形成が挙げられる1, 6, 7).
本症例ではmBTシャント術後,約2か月時の外来受診時に低酸素血症を認めたが,聴診で連続性雑音が聴取されたことと,心臓超音波検査でmBTシャント近傍の血流が確認されたため,その時点ではシャント閉塞は積極的に疑われず在宅酸素を導入し経過観察となった.結果として,エコー所見は左総頸動脈から動脈瘤への流入血流を見ており,それに伴う心雑音であったと考えられる.胸腺低形成とmBTシャント術後であり,経胸壁エコーでは十分な評価が行えなかったが,入院後に鎮静下で行った肋骨弓下からのエコー評価により動脈瘤を疑うことができた.mBTシャント後の低酸素血症の進行を認めた場合,速やかな画像検査が肝要であるが,本症例のように22q11.2欠失症候群が基礎疾患にあり,かつ,正中切開によるmBTシャント術後では,経胸壁エコーでの十分な評価が困難なことがあるため,肋骨弓下からの評価や造影CT検査も躊躇なく行う必要があると考える.
mBTシャント術後の仮性動脈瘤形成の治療戦略
mBTシャント術後の仮性動脈瘤形成には感染,血管の変性,血管や人工血管の脆弱性,不十分な結紮による縫合糸の離開などが関与していると考えられている7).本症例では入院時には発熱を認めなかったものの,入院時の血液検査で炎症反応が上昇しており,血液培養からS. capitisが検出されたため,同菌による感染性仮性動脈瘤形成が疑われた.mBTシャント術後の感染性動脈瘤の治療は①感染のコントロール,すなわち抗菌薬治療と人工血管除去及び動脈瘤切除,②動脈瘤破裂の予防,そして③新規肺血流確保が基本となる1, 3).抗菌薬加療を速やかに開始することに異論はないと考えられるが,抗菌薬治療中も動脈瘤破裂や低酸素血症による急変のリスクに常に晒される事には変わりはなく,どのタイミングで外科的治療介入を行うかの判断は難しい.本症例では抗菌薬治療のみでは感染のコントロールがつかず,外科的な感染巣除去と同時に新規肺血流確保を行う方針となった.手術に際しては,動脈瘤が胸骨直下に存在しており胸骨正中切開の際に破裂や出血のリスクが高いと判断し,開胸前にカテーテル手技によって,動脈瘤への血流を遮断する方針とした.われわれは,人工物を体内に残さず術中の動脈瘤からの出血リスクを最小限に抑える方法として,バルーンカテーテル留置による血流遮断を選択した.アクセス方法としては,事前に施行した造影CTから左総頸動脈がストレートラインで容易にアクセスできると考えられたため,同部位を選択した.大動脈造影により動脈瘤の位置,径を正確に計測することでバルーンサイズの選択と留置の位置決定を行うことができた.Baspinarらは動脈瘤のコイル塞栓では血流コントロールができず,冠動脈用のカバードステントで動脈瘤の開口部をカバーすることで動脈瘤の血流コントロールを安全に行えると報告している6).本症例でも,これらの報告を参考にし,末梢血管用のカバードステントを総頸動脈に留置し動脈瘤の血流をコントロールすることも検討したが,動脈瘤切除後のステント抜去は血管損傷につながる可能性があるため困難であると考えられ,ステントの使用は断念した.Okadaらは胸骨直下に生じたmBTシャント術後の感染性仮性動脈瘤の症例において,今回われわれが行った手技と同様に左頸部からのアプローチで総頸動脈にバルーンカテーテルを留置することで,動脈瘤への血流をコントロールしたうえで切除を行い,ハイブリッド治療は切迫破裂が疑われる仮性動脈瘤の治療に有用であると報告している5).感染のコントロールがつかず,切迫破裂の可能性が高い動脈瘤や人工物を血管内に残すことによる反復性感染のリスクが高い症例においては,バルーンカテーテルによる動脈瘤の血流コントロールは安全に動脈瘤を切除するための有用な補助治療と考えられる.
新規肺血流確保に関しては,人工物使用により反復性感染を来すことがあるため,original BTシャントや両方向性グレン手術などによる再建など,さまざまな報告がされている1, 8).本症例では,感染の非コントロール下での手術介入となったため,人工物の利用による術後再感染のリスクが高いと考え,自己心膜を用いて右室流出路形成術を行った.
Staphylococcus capitisによる感染性動脈瘤
仮性動脈瘤の診断前に発熱などのエピソードがあり,動脈瘤の形成に感染が関与している可能性が高い場合でも必ずしも血液培養で菌が検出されるわけではなく,逆に本症例のように感染を疑う所見がなくても菌が検出されることもある.感染性動脈瘤では迅速な抗菌薬投与が予後を改善する可能性があるため,mBTシャント術後で急激なチアノーゼの進行を認めた場合,感染兆候を認めなかったとしても血液培養検査を行うことが迅速な診断につながる可能性があると考える.本症例では入院時の血液培養と,術中に提出したシャント培養からS. capitisが検出され,同菌による感染性仮性動脈瘤と診断した.過去にmBTシャント術後の感染性仮性動脈瘤の起因菌として肺炎球菌8, 9),B群溶連菌10),セラチア,メチシリン耐性コアグラーゼ陰性ブドウ球菌(MR-CNS)1, 11)などが報告されているがS. capitisの報告はない.
S. capitisはCNSの一種で,人の頭皮や前額に見られる常在菌である.CNSはバイオフィルムを形成することもあり,血管カテーテル感染に起因する人工弁置換術後早期の感染性心内膜炎の最も多い起因菌とも報告される12).しかし,S. capitisはほかのCNSと比較し付着力が弱く,成人領域ではS. capitisによる人工弁置換術後早期の感染性心内膜炎を起因することは稀と考えられている13).一方,近年,海外からの報告ではNICU入院患者における遅発性敗血症やカテーテル関連感染の原因菌としてS. capitisの頻度が増えていると報告されている14).本症例においてS. capitisの感染経路は明らかでないが,NICUに長期入院中に感染が成立していた可能性は否定できない.NICU退院前には感染症を疑う臨床症状は認めなかったため血液検査で炎症反応の陰性化を確認していなかったが,22q11.2欠失症候群の基礎疾患や人工物を使用した術後という患者背景を加味し積極的に血液培養を施行すべきであったかもしれない.
著者の役割
玉木愛乃:診療(術前後の検査,周術期管理),論文原稿作成,データ収集
藤岡泰生:診療(術前後の検査,周術期管理),論文指導,校閲
國方歩:診療(術前後の検査,周術期管理)
杉山隆朗:診療(術前後の検査,周術期管理)
稲毛章郎:診療(術前後の検査,周術期管理)
小林城太郎:診療(手術,周術期管理),論文指導,校閲
大石芳久:診療(術前後の検査,周術期管理),論文指導,校閲