総動脈幹遺残(TA)は円錐から動脈幹にかけての中隔形成不全1)で発生し,新生児期に手術が必要なので早期胎児診断2, 3)が必要である.染色体22q11.2欠失症候群はFallot四徴症などの先天性心疾患を約80%に合併4)し,欠失部位に心臓発生初期に円錐動脈幹中隔形成に関与する遺伝子TBX14)が含まれ,本症候群の胎児の31%が総動脈幹遺残を合併すると報告4)されている.催奇形薬bis-diamineを妊娠ラットに大量投与するとその胎仔に胸腺低形成と心臓大血管疾患(conotruncal anomaly),即ちFallot四徴症,総動脈幹遺残(TA),心室中隔欠損,共通房室弁口,大動脈弓離斷,血管輪を生じる5–8).即ち330匹の胎仔に認められた心疾患とその発生率を括弧内に示すと,各種のFallot四徴症(合計68%,即ち,通常型16%,肺動脈弁欠損型9)14%,肺動脈弁閉鎖型38%),総動脈幹遺残17%(van Praagh分類1, 2) type 1: 9%, type 2: 8%),大動脈弓離断2%,心室中隔欠損3%,共通房室弁口2%などであり,更に血管輪,胸腺の低形成性(100%),横隔膜ヘルニア10)(10%)の合併があった.Bis-diamineでラットに生じる病変は染色体22q11.2欠失症候群4, 11, 12)の病像に酷似している.私は最近2年間にbis-diamineによりラット胎仔に生じた先天性心疾患の連続断面カラー写真を図譜9, 13)として本学会雑誌に発表した.ここに含まれる先天性心疾患中で総動脈幹遺残は特に早期診断,胎児診断が重要2, 3)である.ここには前図譜13)に紙面の都合で掲載できなかった各種総動脈幹遺残の横断面像を図示する.これらのカラー図譜は総動脈幹遺残の胎児エコー診断2, 3)の一助となる可能性がある.
Wistarラット30匹にbis-diamine 200 mgを妊娠9日と10日に胃内注入し,全身急速凍結法により次のようにラット胎仔の胸部断面を作製した.ラットの満期妊娠期間21.5日の直前にあたる妊娠21日目に親ラットを頸椎脱臼法で安楽死させ,ただちに帝王切開で取り出した胎仔を胎盤つきのままドライアイス–アセトン(−76°C)に投入して瞬時に凍結した.凍結した胸部を90%は横断面(transverse),残り10%は矢状面(sagittal)または前額面(frontal)で薄切し,断面を0.25または0.5 mm毎に実体顕微鏡(Wild 400 Photomacroscope, Wild Heerbrugg Ltd., Heerbrugg, Switzerland)で撮影した.
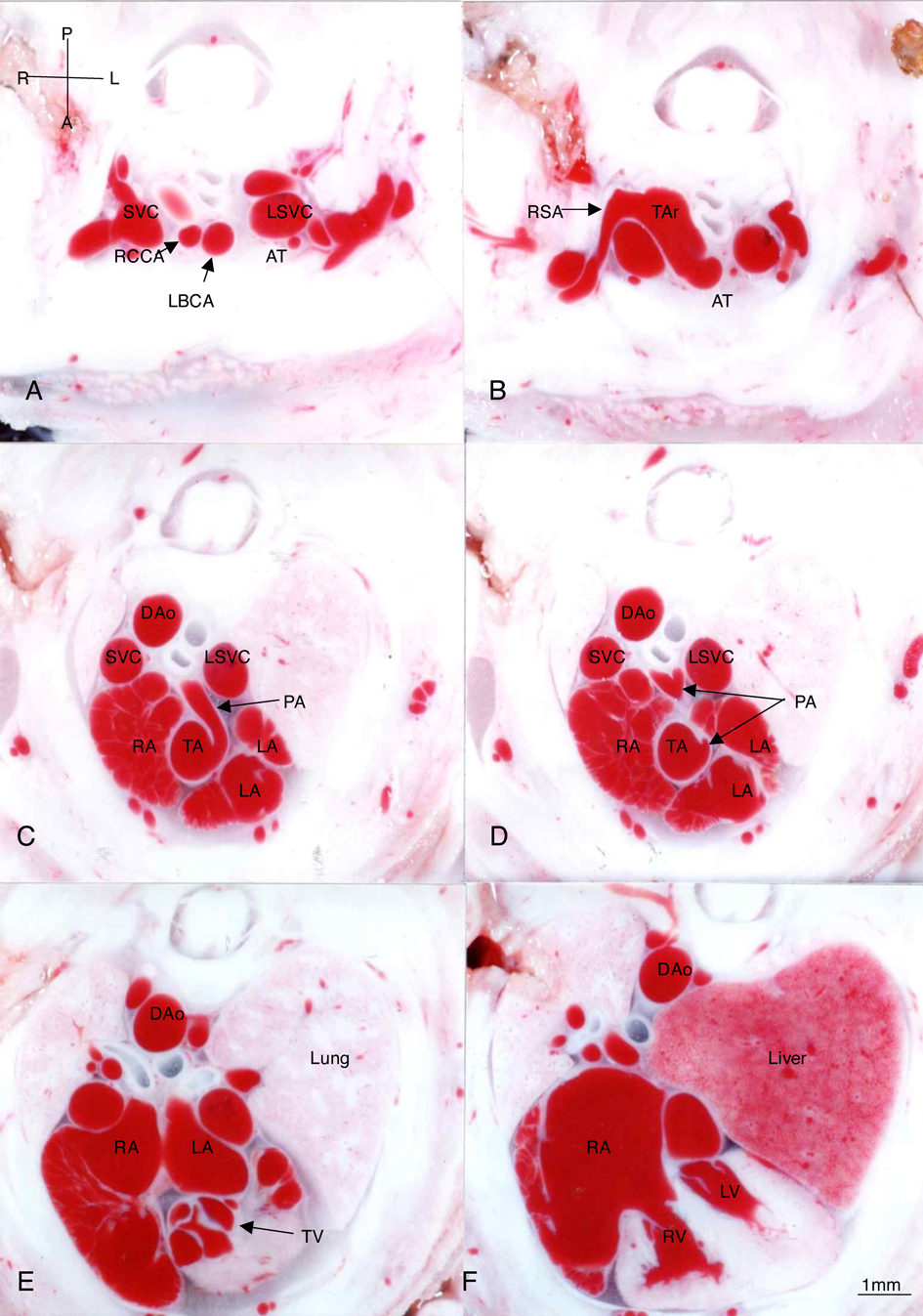
Bis-diamine投与により既に報告した心血管異常にくわえて,右側大動脈弓,鎖骨下動脈起始異常,血管輪,胸腺低形成(100%)も合併していた.
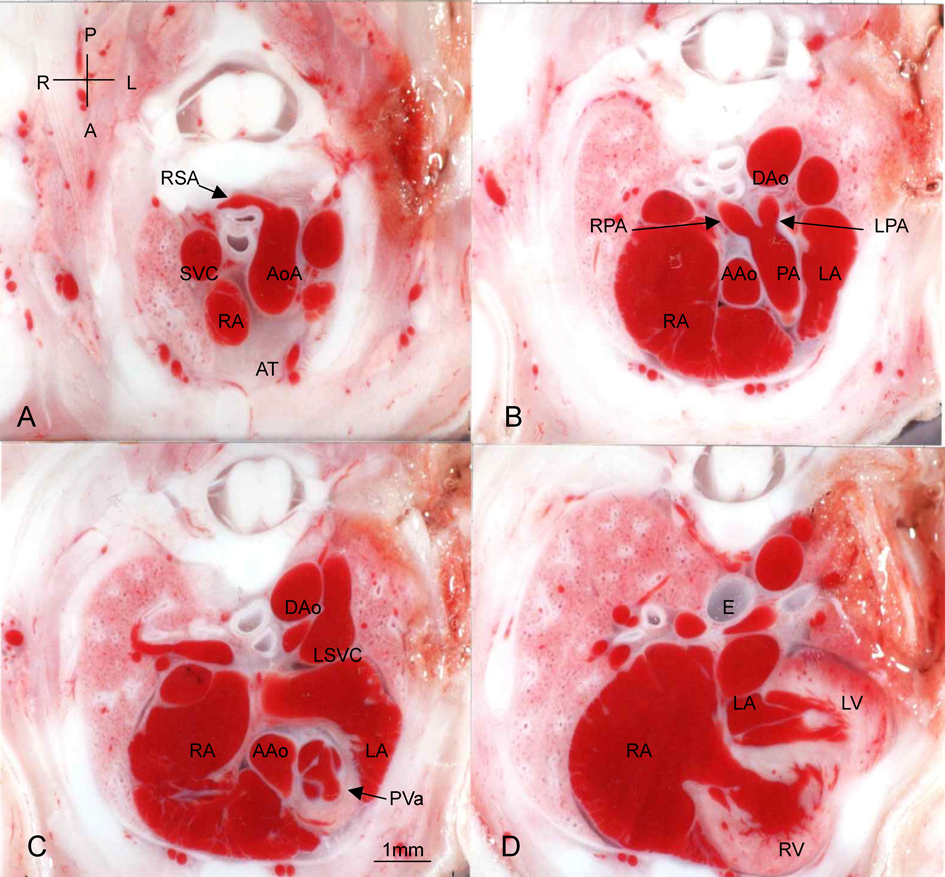
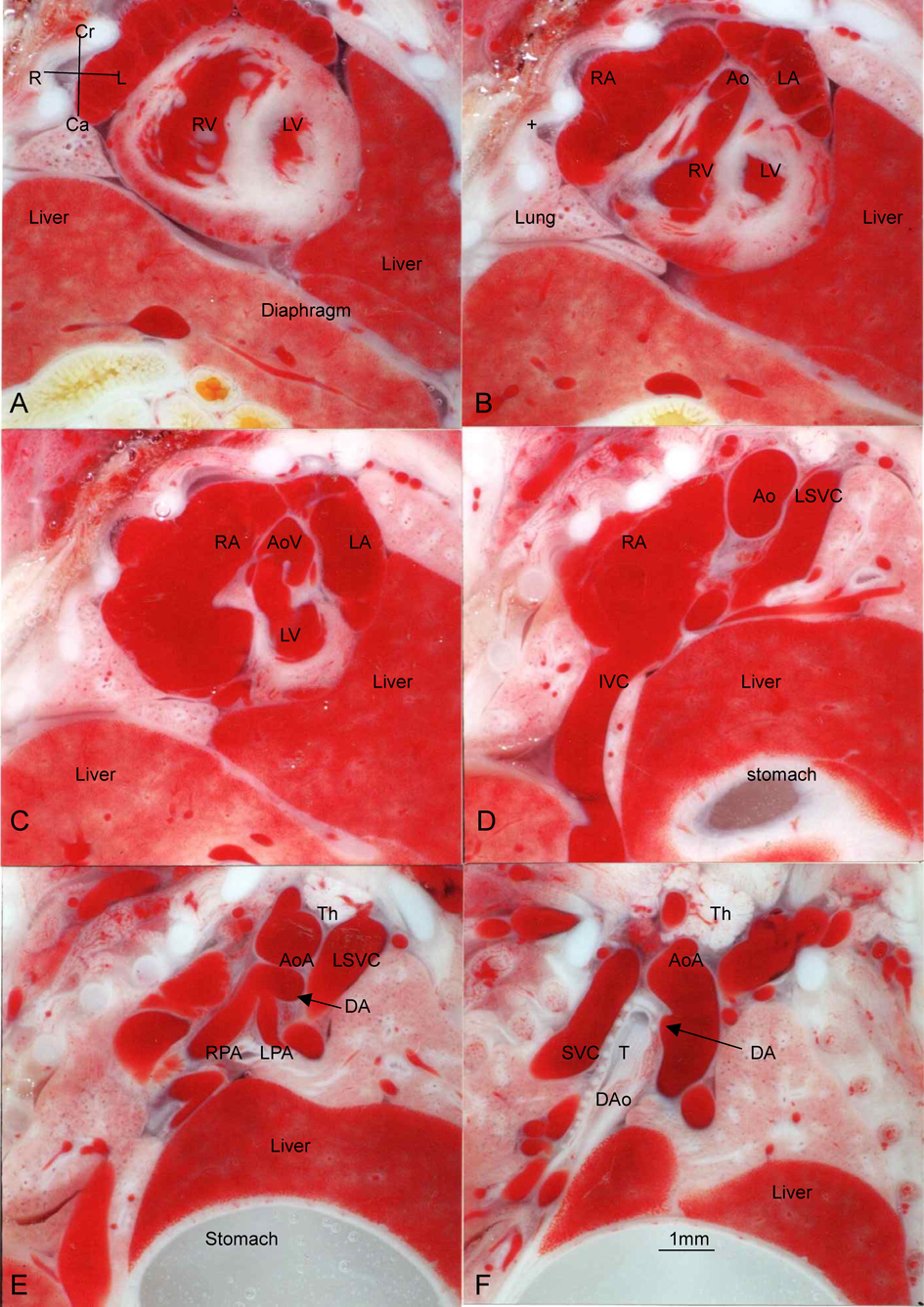
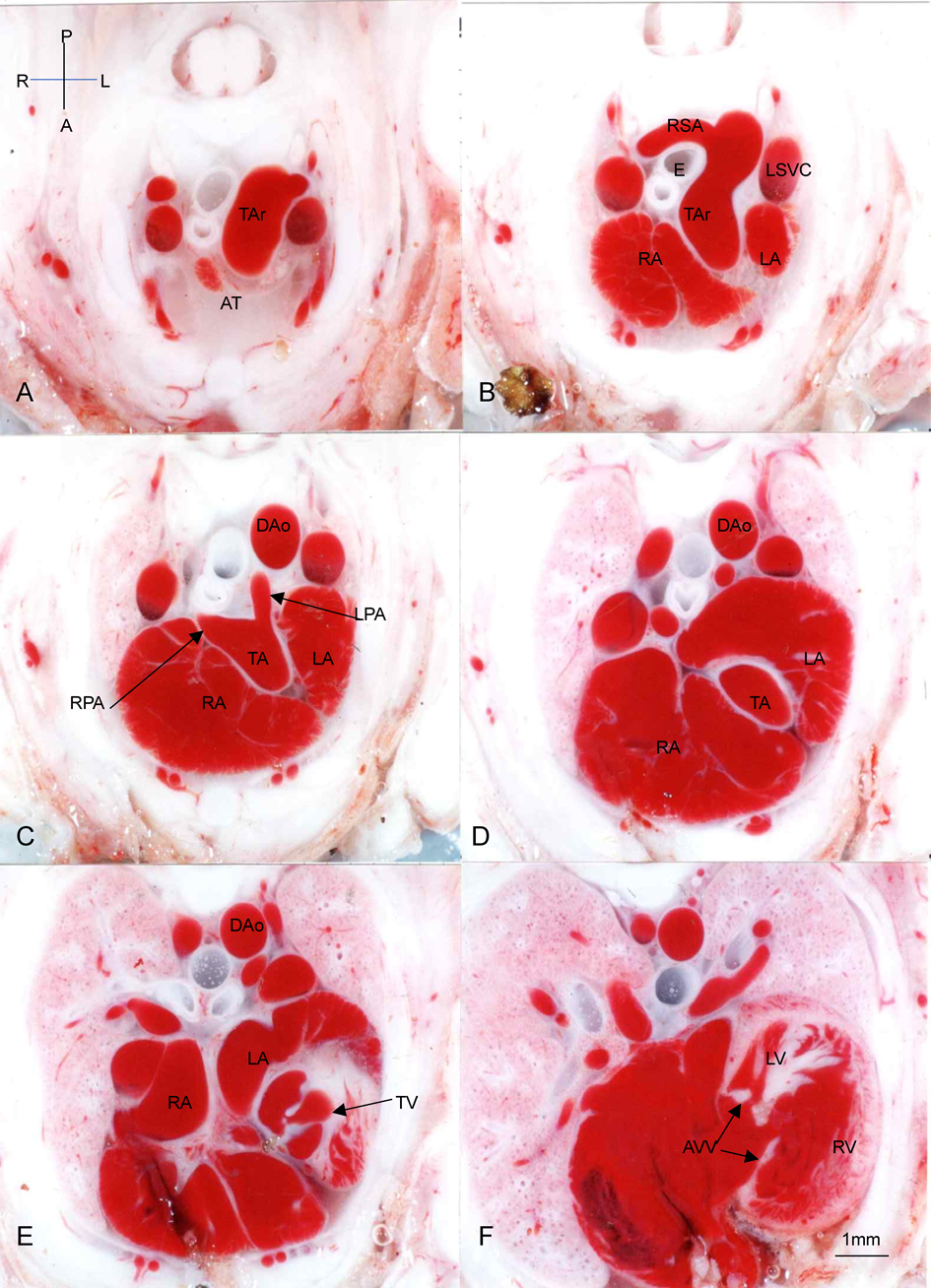
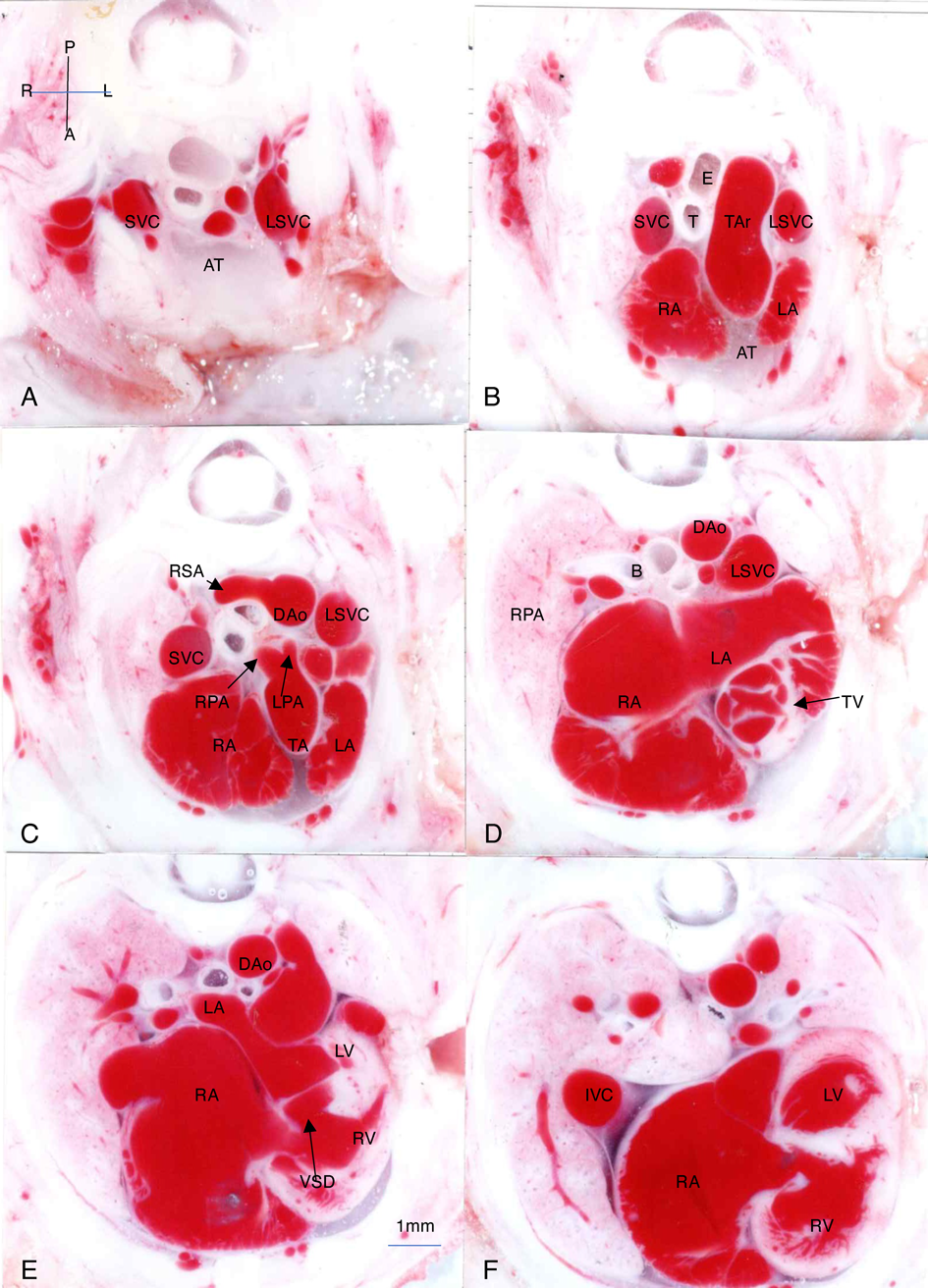
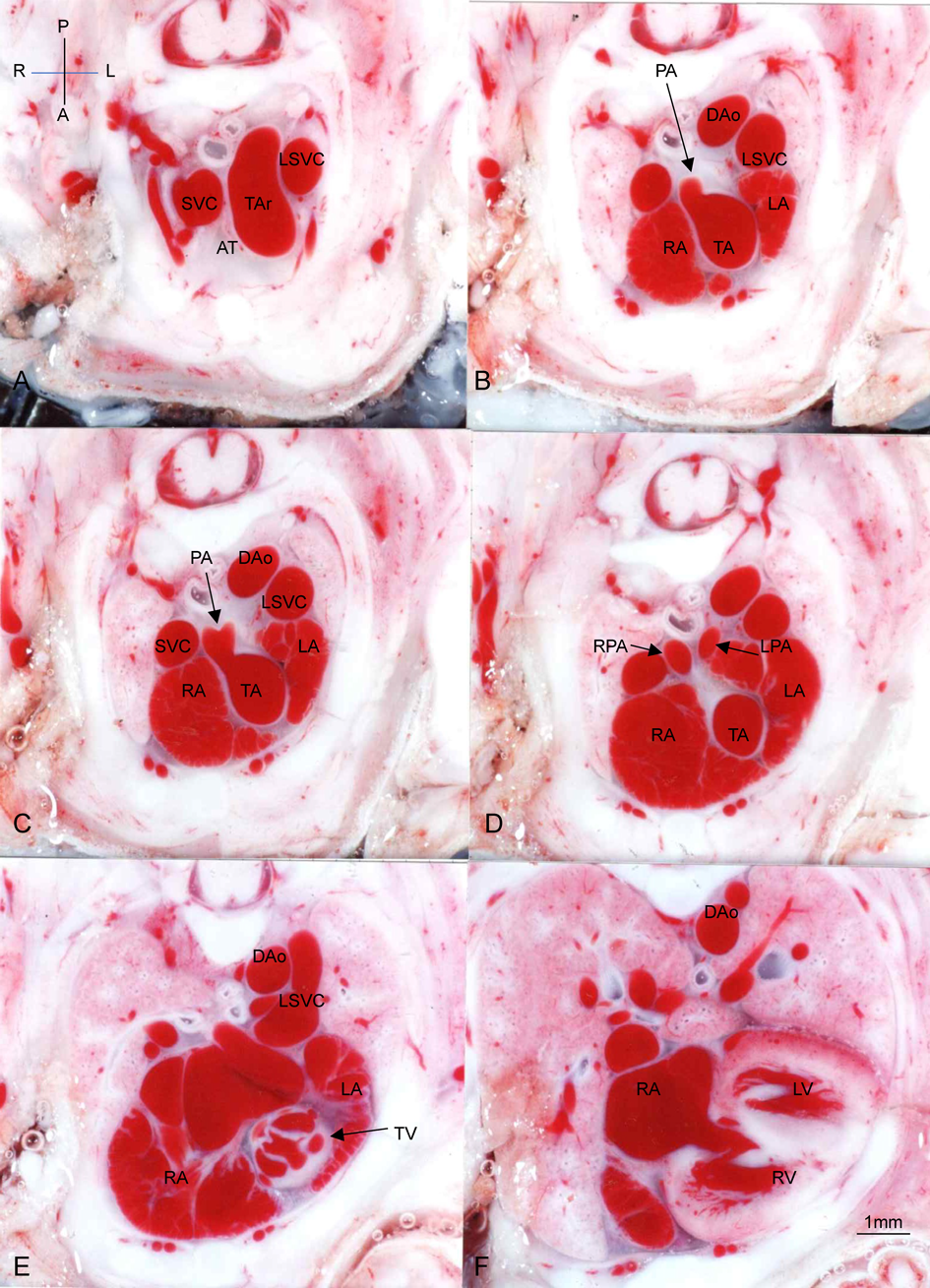
Bis-diamine投与後の正常心臓例(Fig. 1),心室中隔欠損兼肺動脈閉鎖例(Fig. 2),総動脈幹遺残例(Figs. 3~6)の胸部横断面(Fig. 2のみ前額面断面)を示す.
Fig. 1では先天性心疾患なく,右鎖骨下動脈起始異常,胸腺欠損が認められる.
Fig. 2例は心室中隔欠損兼肺動脈閉鎖であり,形態がTA type 32)に似ているので参考に示す.横隔膜ヘルニアがあり,肝臓と胃が左胸腔に入り,心臓を頭側に押し上げている.心室中隔欠損と主肺動脈欠損がある.大動脈は,両心室から起始し,大動脈弁尖の肥厚はなく,大動脈弓の下行大動脈移行部前壁から起始する動脈管から左右肺動脈が起始している.小さい胸腺がある.
Fig. 3例はTA type 22)で左右肺動脈が総動脈幹の背壁から起始し,総動脈幹弁異形成,房室中隔欠損,右鎖骨下動脈起始異常,胸腺欠損がある.
Fig. 4例はTA type 2で左右肺動脈が総動脈幹の背壁から起始し,総動脈幹弁異形成,心室中隔欠損,胸腺欠損がある.
Fig. 5例はTA type 12)で異形成性4弁性の総動脈幹弁,短い主肺動脈の総動脈幹の右背壁からの起始,胸腺欠損が認められる.
Fig. 6例はTA type 1で異形成性の総動脈幹弁,長い主肺動脈の総動脈幹左側壁からの起始,右側総動脈幹(大動脈)弓,横隔膜ヘルニアが認められる.
総動脈幹遺残は先天性心疾患の約1%を占める比較的まれな疾患1, 2)であるが,新生児期に手術が必要で,早期診断,特に胎児診断2, 3)が重要である.手術は1968年以後Rastelli法とその変法1)が用いられ,手術成績の悪化要因は総動脈幹弁の逆流または狭窄,大動脈弓離断,末梢肺動脈低形成の合併14)である.本症の約20~30%には有意な総動脈幹弁逆流が合併14, 15)する.1990年以降,総動脈幹弁逆流のない場合は新生児期の手術でも90%生存の良い成績14, 15)になってきた.
まず,胎児期に総動脈幹遺残を診断する際に,胎児心エコーにて画像を判断するときに,参考となる所見がFigs. 3~6の画像に含まれることに着目したい.心内構造としては,右室から総動脈幹への断面で右室流出路が認められないことや,総動脈幹弁の形態が観察できる.血管構造としては,種々のタイプによる左右肺動脈の分岐形態のほか,大動脈弓の形態や右鎖骨下動脈の起始異常による走行が明確に描出されている.
心室から総動脈幹への連続横断面をFigs. 3~6でみると,Fallot四徴症のような右室流出路が描出されないことがわかる.右室の前方に右室流出路や流出路中隔などの構造形態が全く認められない.この所見は,肺動脈閉鎖と胎児期に鑑別が難しいこともある胎児期の診断において,参考となる所見であろう.
総動脈幹遺残では肺動脈が直接総動脈幹から分岐していることも特徴的である.Figs. 3~6には様々な分岐様式,あるいは総動脈幹からの分岐角度が認められる本疾患の特徴が認められる.Type 1であっても,Fig. 5Cのように,総動脈幹の背面右側から起始したり,Fig. 6Cのように総動脈幹の左側から起始して長く背側へ走行する血管を認めることもある.他方type 2のときにも,Fig. 3Cのように左右の肺動脈が総動脈幹からそれぞれ明確に別の部分から起始する例やFig. 4Cのようにtype 1に近いようなほぼ同一部位から起始する例もある.
次に手術成績に大きく影響する総動脈幹弁に着目する.総動脈幹弁は正常の大動脈弁と異なる異形成を示す.まず弁尖の数は3弁の例が69%, 4弁が22%, 2弁が9%などと報告1)されているが,弁尖の大きさが大小不揃いである.弁尖の粒状肥厚がある.長期生存例の弁置換手術例全例で弁尖の肥厚があった.また弁の変形,逸脱を示す例がある.総動脈幹弁の逆流の始まる時期は通常胎児期であるが,新生児期手術例で手術後にそれまでなかった逆流が出てくる例がある.ヒトではまだ総動脈幹弁の逆流についての長期観察がないが,催奇型剤bis-diamineで生じた総動脈幹遺残を有するラット胎仔には様々な程度の総動脈幹弁の逆流があり,その程度が高度な例では胎生期に心不全を生じる7).この論文は1991年にCirculation7)に掲載されている.この動物実験でも総動脈幹弁は正常の大動脈弁の1.5倍(逆流が軽度またはない例)ないし2倍(逆流が多い例)に肥厚していた.またこの論文の図譜では胎生期の総動脈幹弁の弁尖の瘤状肥厚も提示されている.
このように総動脈幹弁逆流の成因は様々で,個々の逆流弁の形態に応じた弁形成術14, 15, 17)が試行されてきた.今村–Mee(Cleveland Clinic)は重症逆流4尖弁の4例に小さい弁を縫縮して2尖弁化し,3例で逆流完全停止に成功18)した.本症の手術成績向上のためにこれら合併症の胎児,新生児期の正確なエコー診断がまず必要であろう.
ヒトの胎児心エコーでは胸郭の横断面では,弁自体をほぼ正確に横断する断面にはならないことが多いので,直接これらと同様の画像が描出されるわけではない.しかし,総動脈幹弁の角度を確認して弁に対する横断面を描出すると,Figs. 4D, 5Eのごとく4弁性の半月弁やFigs. 3E, 5E, 6Eのような,肥厚した不整形の弁形態が確認できる.
染色体22q11.2欠失症候群でも高率に認められる大動脈弓や鎖骨下動脈の起始異常についても,この断面像から確認できる.右側大動脈弓についてはもちろん正確に確認できるが,今回の画像からは,右鎖骨下動脈の起始異常がある時の血管走行が,起始異常のない時の走行と比較できて興味深い.起始異常を認めるFigs. 3, 4では,下行大動脈からの異常起始後に気管と食道の後方を走行し,一つ頭側の断面で,上大静脈(SVC)の背側を走行する右鎖骨下動脈を確認できる.
ここに載せた画像はスライドや光沢紙へのプリント,拡大コピーで鮮明なカラー画像になるので,多くの胎児診断関係者の目に触れて,胎生期の総動脈幹遺残の早期診断が進み,手術成績向上につながることを期待したい.
謝辞Acknowledgments
英文チェックは湘南鎌倉総合病院内科Joel Branch医師によった.
利益相反
本稿について開示すべき利益相反(COI)はありません.
引用文献References
1) Cabalka AK, Edwards WD, Dearani JA: Truncus arteriosus, in Allen HD, Shaddy RE, Driscoll DJ, et al (eds): Moss and Adams’ Heart Disease in Infants, Children, and Adolescents. Philadelphia, Wolters Kluwer, 2008, pp 911–922
2) 藤原慶一:総動脈幹遺残.日本小児循環器学会(編):小児・成育循環器学.東京,診断と治療社,2018, pp 469–472
3) Tometzki AJ, Suda K, Kohl T, et al: Accuracy of prenatal echocardiographic diagnosis and prognosis of fetuses with conotruncal anomalies. J Am Coll Cardiol 1999; 33: 1696–1701
4) Momma K: Cardiovascular anomalies associated with chromosome 22q11.2 deletion syndrome. Am J Cardiol 2010; 105: 1617–1624
5) Momma K, Ando M, Takao A: Fetal cardiac morphology of tetralogy of Fallot with absent pulmonary valve in the rat. Circulation 1990; 82: 1343–1351
6) Momma K, Ando M, Takao A, et al: Fetal cardiovascular cross-sectional morphology of tetralogy of Fallot in rats. Fetal Diagn Ther 1990; 5: 196–204
7) Momma K, Ando M, Takao A, et al: Fetal cardiovascular morphology of truncus arteriosus with or without truncal valve insufficiency in the rat. Circulation 1991; 83: 2094–2100
8) Kuribayashi T, Roberts WC: Tetralogy of Fallot, truncus arteriosus, abnormal myocardial architecture and anomalies of the aortic arch system induced by bis-diamine in rat fetuses. J Am Coll Cardiol 1993; 21: 768–776
9) 門間和夫,豊島勝昭:肺動脈弁欠損を伴うFallot四徴症のラット胎仔心臓肺断面像.日小児循環器会誌2019; 35: 164–171
10) 門間和夫:先天性横隔膜ヘルニアのラット胎仔心臓肺断面像.日小児循環器会誌2020; 36: 36–45
11) 門間和夫:染色体22q11.2欠失症—発見と合併心奇形—.日小児循環器会誌2017; 33: 1–7
12) 古道一樹:22q11欠失症候群.日本小児循環器学会(編):小児・成育循環器学.東京,診断と治療社,2018, pp 656–659
13) 門間和夫:ラット胎仔先天性心疾患の断面像—胎児心エコーのための22q11.2欠失症候群モデル動物図譜として—.日小児循環器会誌2018; 34: 55–62
14) Morgan CT, Tang A, Fan C-P, et al: Contemporary outcomes and factors associated with mortality after a fetal or postnatal diagnosis on common arterial trunk. Can J Cardiol 2019; 35: 446–452
15) Naimo PS, Fricke TA, Konstantinov IE: Impact of truncal valve surgery on the outcomes of the truncus arteriosus repair. Eur J Cardiothorac Surg 2018; 54: 524–531
16) Becker AE, Becker MJ, Edwards JE: Pathology of the semilunar valve in persistent truncus arteriosus. JTCS 1971; 62: 16–26
17) Elami A, Laks H, Pearl JM: Truncal valve repair: Initial experience with infants and children. Ann Thorac Surg 1994; 57: 397–402
18) Imamura M, Drummond-Webb JJ, Mee RBB: Improving early and intermediate results of truncus arteriosus repair: A new technique of truncal valve repair. Ann Thorac Surg 1999; 67: 1142–1146