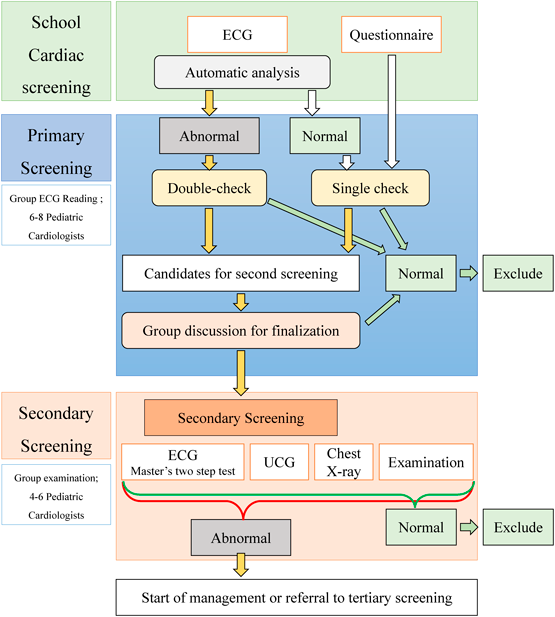
心臓検診の制度は1973年に文部省学校保健法施行規則が改正されて開始された.現在のように小学1年・中学1年・高校1年生全員の心電図検査が行われるようになったのは,1994年12月の「学校保健法施行規則の一部を改正する省令の施行及び今後の学校における健康診断の取扱いについて(平成6年12月8日文体学第168号文部省体育局長通知)」という通知がなされてからであり,詳細については通知を確認されたい.要点としては,心電図検査を新たに健康診断の検査方法として加えたこと,心電図検査に当たっては一般的な誘導法を用いてフィルターをできるだけ使用しないこと,心電図の判定は小児・若年者心電図判読に習熟した医師が行うことなどが記載されている.
心臓検診は心疾患の早期発見を目的とし,心疾患児に適切な治療および生活指導を行うことで疾病の悪化を防ぐことや学校管理下での心臓突然死の防止につながっている2, 3).地域による心臓検診実施形態の差異はあるものの4),死亡率軽減の要因として評価の画一的な基準5–8)が存在していることが大きく影響しているものと考えられる.くわえて診断後の管理方法についても統一が進んでいる.先天性心疾患に関しては「先天性心疾患の学校生活管理指導指針ガイドライン(2012年改訂版)」9),不整脈に関しては「器質的心疾患を認めない不整脈の学校生活管理指導ガイドライン(2013年改訂版)」10)が発表されており,「学校心臓検診のガイドライン(2016年版)」7)において管理方法までまとめて参照することができる.2019年改訂の現行ガイドライン8)における主な変更点は,これまで点数制で行われていた心室肥大判定5)がガイドラインの抽出基準にも明記された点である8).この変更に伴い,以前は右室肥大や左室肥大の疑い(点数制の3~4点)とされていた所見でも単独でA群(二次以降の検診に抽出すべき所見)となり,二次検診への抽出者の増加が予想される.これは心臓検診の目的である心疾患の早期発見,ことさら肥大型心筋症による若年突然死の予防に寄与するものと期待される.
心臓検診の具体的な実施方法は自治体に委ねられており,統一されたプロトコールは存在しない.最初のスクリーニングとして一次検診で行われているのは調査票による問診,学校医の診察,および児童生徒全員の心電図検査などであるが,過去の全国調査では調査票による問診の実施率は全体の91%,学校医の診察は79%であった4).また,12誘導心電図を用いた心電図検査の実施率が60%,省略4誘導心電図(I, aVF, V1, V6)が36%であった4).このように一次検診の実施方法が異なるため,そこから対象を抽出して精密検査として行われる二次検診の実施率も地域によって変わってくる.全国調査における二次検診対象者の割合は全体で3.3%であったが,都道府県ごとに比較すると1.2~8.4%と大きな差があった4).また,二次検診以降に要管理とされた者の割合は全体で0.98%,都道府県ごとのばらつきは0.2~2.8%という状況であった4).一次検診は疑い例を含めて可能な限り漏れなく疾患を発見すること,二次検診では正確に疾患を診断して医療機関での管理につなげることが目的である.一次検診の抽出率が低く(かつ漏れがなく),二次検診の有病率が高いことが検診の精度という意味で理想的であるが,地域の実情や小児循環器医の所在など多岐の要素を含み一律のプロトコール策定が困難な要因となっている.
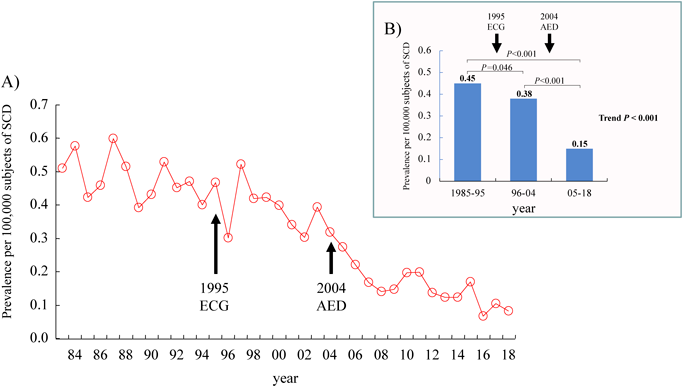
突然死とは,通常の生活を営んでいた人が急速に死に至ることであり,WHO(世界保健機構)の定義では「瞬間死,あるいは発病後24時間以内の内因死」とされている.本邦における学校管理下での心臓・大血管が原因の死亡例については,2016年の鮎澤の報告11)および日本スポーツ振興センターの資料12–16)を参照すると,Fig. 2(A)に示すように年々減少傾向となっていることがわかる(学校管理下での10万人あたりの年間心臓突然死数は1987年が0.60人,2018年が0.08人).特に図中の矢印で示した1995年の学校心臓検診における心電図義務化,および2004年の一般市民によるAED使用が可能になったことは,児童生徒の心臓突然死減少に寄与したと思われる.Fig. 2(B)は1985年から約10年ごとに群分けして心臓突然死死亡率を比較したものであるが,心電図検査が義務化される前とAED使用が許可されたあとの年代を比較すると有意に死亡率が減少している.特に1985~1995年の年間心臓突然死数は10万人あたり平均0.45人に対して,2005~2018年は0.15人と約1/3に減少している.
欧米における小児の突然死予防に対する考え方は,競争的スポーツを開始する前の運動選手に対するスクリーニングである17–19).本邦のように全児童・生徒の心電図を用いたものとは対象が異なるため正確な比較は困難であるが,Toresdahlらの報告では全米の高校生における非アスリートの心臓突然死年間発生率は,人口10万人あたり0.31とされている20).El-Assaadらの報告では,母集団の年齢が異なるため単純な比較はできないが,米国における若年者の心臓突然死年間発生率は1~10歳で人口10万人あたり約0.4,11~18歳で約0.5となっている21).また,Corradoらの報告では,イタリアの都市における前向きコホート研究で,非アスリートの突然死は10万人あたり年間0.9となっている22).Corradoらはさらに,1982年から病歴や診察および心電図によるスクリーニングを加えたところ,アスリートの年間突然死が1979~1980年の10万人あたり3.6から2003~2004年には0.4に減少し,主に心筋症による突然死が運動参加前のスクリーニングで識別されたことに起因すると報告している23).
本邦においてはこれまでの自治体,学校,保護者,そして小児循環器医の多方向からの協力により,児童生徒の突然死を減少させることができたものと思われる.しかしながら,近年でも年間20~30名程度の心臓突然死が発生していることを考えると,その原因や予防法の追求を続けることが必要である.
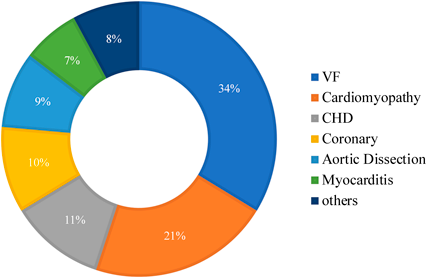
若年者の突然死に関する1991~2007年の報告をまとめた住友の論文24)によると,心疾患以外の原因を除く若年者(0~35歳)の突然死原因疾患で最も多かったものは心筋症(20%)で,次に虚血性心疾患(15%),心筋炎(12%),冠動脈起始異常(10%),不整脈(8%),先天性心疾患(7%)の順番であった22, 25–33).また,El-Assaadらは米国の若年者について年代別の心臓突然死の原因を報告しているが,心筋症の占める割合は1~10歳で13%,11~18歳で31%,18~25歳で35%となっている21).本邦における2008~2013年の学校管理下での心臓突然死の原因疾患で,原因が明らかな89例の内容をFig. 3に示す.そのなかで最も多かったものは心室細動(34%),次いで心筋症(21%),先天性心疾患(11%),冠動脈疾患(10%)であった11).これらの報告からは,学校心臓検診で抽出することが可能な心筋症は,現在も若年者の心臓突然死の主な原因になっていることがわかる.特に肥大型心筋症については早期に適切な診断を行うだけでなく,小児循環器医による適切な管理・教育が予後に大きく影響するといえる.学校心臓検診での抽出が難しい突然の心室細動や冠動脈疾患については,事前の予防や教育が困難であるため,学校を含めた社会全体での心肺蘇生・AED使用についての啓発という点で小児循環器医は貢献することができると思われる.
定義
2005年の特発性心筋症調査研究班の手引き34)で,肥大型心筋症は「(1)左室ないしは右室心筋の肥大と(2)心肥大に基づく左室拡張能低下を特徴とする疾患群」と定義されている.成人領域においては,基礎疾患ないし全身性の異常に続発した二次性心筋症(特定心筋疾患)を除外するとなっている35).しかしながら本邦の小児科領域では伝統的に二次性心筋症も肥大型心筋症として取り扱っており36),本稿ではこの分類に準ずる.
頻度
肥大型心筋症の頻度について,成人領域では世界的に様々な報告がある.多くの報告では肥大型心筋症の頻度は10万人あたり200人程度(0.16~0.23%)となっている37–42).Semsarianらは遺伝子異常のキャリアや発症前の患者も含めると10万人あたり500人(0.5%)程度の頻度があり得るとしている43).小児での頻度に関しては,Norrishらにより10万人あたり2.9人という報告がある44).本邦における小児での発生数については,日本小児循環器学会希少疾患サーベイランス45–49)による報告が参考になる.Table 2に示しているとおり2014年までは年間30~40例であったが,ここ数年の肥大型心筋症の新規発生数は年間70~80例である.発症数の増加は2015年以降にサーベイランスの実施方法が変更になり,調査対象施設や集計率の差があることが影響していると思われる.
Table 2 The number of pediatric myocardial diseases in Japan| Year | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|
| HCM | 27 | 28 | 23 | 23 | 28 | 32 | 52 | 80 | 81 | 74 |
| DCM | 39 | 41 | 30 | 38 | 38 | 39 | 70 | 63 | 71 | 70 |
| RCM | 6 | 9 | 6 | 16 | 8 | 6 | 6 | 9 | 15 | 10 |
| ARVC | 1 | 3 | 2 | 1 | 3 | 2 | 5 | 9 | 2 | 2 |
| LVNC | 21 | 25 | 22 | 28 | 25 | 25 | 54 | 50 | 78 | 57 |
| Myocarditis | 45 | 63 | 50 | 46 | 46 | 41 | 69 | 77 | 66 | 74 |
| Population (≦14 years old). (million) | 17.3 | 17.2 | 17.0 | 16.8 | 16.7 | 16.5 | 16.4 | 16.2 | 15.9 | 15.5 |
ARVC, arrhythmogenic right ventricular cardiomyopathy; DCM, dilated cardiomyopathy; HCM, hypertrophic cardiomyopathy; LVNC, isolated noncompaction of left ventricular myocardium; RCM, restrictive cardiomyopathy.
(Modified from Reference 45–49) |
原因
小児肥大型心筋症には多様な原因があり,特発性(74%),代謝疾患(9%),症候群(9%),神経筋疾患(8%)などが含まれている50).乳幼児期に診断されるものは症候性(Noonan症候群・LEOPARD症候群・Costello症候群など)のものが多く,小児期・青年期には心臓検診で見つかる特発性のものが多い36).特発性肥大型心筋症ではサルコメア遺伝子異常,Z帯遺伝子異常,カルシウム調節遺伝子異常などが見つかっている.肥大型心筋症の約半数は心筋の収縮単位であるサルコメアをコードする遺伝子変異が原因であり,心筋肥大や配列異常,間質の線維化などの形態的な異常を引き起こすと報告されている51).
特徴と診断
肥大型心筋症は若年者の心臓突然死の主な原因になっているが,とくに運動に関連した突然死が多い52).また小児の肥大型心筋症での突然死は成人の約2倍であり,最も起こしやすい年齢が12~35歳である53).このことからも,心臓検診で早期発見に努めて適切な運動制限などの介入を開始することが重要である.心臓検診では問診や調査票で失神の既往や突然死の家族歴を聴取し,心電図検査で肥大判定基準5, 8)を参考に診断と管理が行われる.肥大型心筋症のスクリーニングツールとして最も一般的なものは12誘導心電図である.代表的な心電図上の特徴は左室肥大,広範な異常Q波,陰性T波を含むST-T変化であるが,BrothersらはRaVL+SV2>23 mmが小児の肥大型心筋症のスクリーニングに適していると報告している54).2018年にはYoshinagaらにより本邦の小児の心電図正常値が新たに報告され55),これをもとにして小児の心電図による肥大判定基準が見直されている8).また,家族歴などを契機に肥大型心筋症の遺伝子変異陽性は判明しているが心エコーで心筋肥厚を呈していない発症前の段階でも,心電図異常が先行しているケースがある.このことから,肥大型心筋症患者の家族に対するスクリーニングツールとしても心電図検査は有用と考えられている56).一方,心エコー検査は肥大型心筋症の診断において中心的な役割を果たしており,成人では最大左室壁厚15 mm以上が診断基準として確立している51).小児では年齢・性別・体格別の平均値に対して+2.0 SD以上の左室壁厚と定義されている51).また,Axelssonらは小児の肥大型心筋症の46%で,肥大して線維化を呈した心筋がMRIのガドリニウム造影遅延(LGE)として描出されると報告しており57),診断の一助となる.
症状と日常管理
肥大型心筋症では,心筋が肥大して線維化の著しい領域を壁内走行する冠動脈が,血管壁肥厚や内腔狭窄をきたすことで心筋虚血を引き起こし,灌流領域の壊死やさらなる線維化の原因になっている58, 59).肥大型心筋症で起こりうる致死性不整脈は心室性不整脈であるが,心筋の線維化組織が関与していると考えられている60).小児の肥大型心筋症におけるコホート研究では,非持続性心室頻拍が18%認められたという報告があり61),身体活動によって症状が増悪して突然死を引き起こすリスクになるとされている62, 63).また肥大型心筋症はスポーツ選手の突然死の主な原因と考えられてきたため64),運動制限を課すことが推奨されている7, 37, 65, 66).そもそも肥大型心筋症の患者は左室流出路狭窄,心筋虚血,拡張障害67)や末梢血管抵抗の過度な低下68)といった様々な原因によって運動耐容能が制限されている.本邦の小児肥大型心筋症における運動制限は,ガイドラインに示されている通り学校生活管理指導表に基づいたリスク別の管理指導区分および観察間隔の設定である7).成人領域の肥大型心筋症における5年の心臓突然死予測確率モデル(HCM Risk-SCD formula)では,危険因子として若年,最大左室壁厚30 mm以上,左房拡大,左室流出路圧較差,突然死家族歴,非持続性心室頻拍,失神の既往が挙げられている69).18歳未満の小児を対象とした肥大型心筋症の心臓突然死リスク因子の報告では,診断時年齢が高い(概ね10歳以降),左室壁厚,左房拡大,非持続性心室頻拍,失神の既往は成人同様に含まれていたが,左室流出路圧較差や突然死家族歴は関連がなかったとされている70).また,40歳以下の患者では運動時血圧の異常反応(安静時からピーク時の収縮期血圧上昇が20 mmHg未満,またはピーク時からの低下が20 mmHg未満)があると,突然死のリスクが高いとされている51).これらを参照して,高リスク児と判断した場合はほとんどの運動を禁止して観察間隔を短くする必要がある(管理指導区分AまたはB.1か月毎).胸痛や失神などの症状がある例や左室流出路狭窄がある場合は,中等度および強い運動を禁止する(管理指導区分BまたはC.1か月毎).無症状で突然死のリスクが低いと判断される例であれば軽い運動は許可されるが,やはり競技やトレーニングなどは禁止である(管理指導区分D.6か月毎).一方で,突然の運動制限を課されることになる児童・生徒の心理的なストレスに対しては,小児循環器医のみならず児童精神の専門家や家族,臨床心理士,学校現場,クラブの指導者などを交えて,こどもを取り巻く環境に応じて多職種での意思統一と幅広いケアが必要になると思われる.
近年,肥大型心筋症の患者における運動は心血管系のリモデリングに良好な効果があり,適度な運動プログラムは安全性に問題がないことを示唆する新たなエビデンスが出てきている71).肥大型心筋症の患者に対する過度の運動制限による動脈硬化リスク因子の増加が,心血管イベントとの関連の可能性があるとの報告もある72–74).今の時点で肥大型心筋症における運動と致死的不整脈の関連性は無視できるものではなく,運動制限は続けるべきであると考えるが,今後長期的な追跡調査を伴うコホート研究などのデータによって肥大型心筋症に対する運動制限の在り方が変化するかもしれない.
肥大型心筋症と不整脈
日本小児循環器学会が行った2008年の全国調査75)によると,肥大型心筋症の患者162例のうち不整脈を示したのは23例(14%),不整脈の内訳は上室性2例,心室性21例であった.肥大型心筋症で起こりうる致死性不整脈は,線維化した瘢痕組織が関与するリエントリー機序と考えられる心室頻拍,および心筋配列の乱れや虚血によると考えられる心室細動である60).植込み型除細動器(ICD)に記録された高リスク者の心室性不整脈が誘発される前に,洞頻脈や心房細動が約8割で認められたという報告があり交感神経活動の亢進が不整脈誘発に関与していることが考えられている60).
治療
閉塞性肥大型心筋症で左室流出路圧較差30 mmHg以上の有意な狭窄を有する患者では,薬物療法としてβ遮断薬が第一選択となる.主な投薬の目的は,交感神経が賦活化して過収縮に陥っている心筋の弛緩や陰性変力作用による左室内圧較差の低減による症状の緩和などであるが,持続性心室性不整脈の有病率を低下させる効果もある76).非選択的なβ遮断作用を有するプロプラノロールが用いられることが多く77),使用量については2~5 mg/kg/日が一般的であるが,高用量(8 mg/kg/日以上)が生存率を改善させたという報告もある78).また,非閉塞性肥大型心筋症でも労作時狭心症や呼吸困難など症状がある場合は,β遮断薬の適応になる79).
閉塞性肥大型心筋症に起因する症状があり,β遮断薬が効かないかあるいは忍容性がない患者では,Ca拮抗薬での代替を推奨されているが,低血圧や肺水腫による重度の呼吸困難患者,生後6週間未満の小児では有害な可能性があるとされている79).β遮断薬やCa拮抗薬による治療を行っても持続する呼吸困難があり,体液貯留や左房圧上昇などが臨床的に確認されている患者では利尿薬の使用を検討してもよい79).ただし,症候性の低血圧や低K血症を予防するために必要に応じて断続的に使用するか,低用量で使用するなど慎重な投与が必要である.一方,閉塞性肥大型心筋症では,流出路閉塞によって引き起こされる症状を悪化させる可能性があるため,血管拡張薬(アンギオテンシン変換酵素阻害薬,アンギオテンシン受容体拮抗薬)あるいはジゴキシンは投与中止が妥当である79).
近年,肥大型心筋症に伴う致死性不整脈の治療としてICDを活用することで予後の改善につながることは,小児の領域でも明らかになってきている80).不整脈による突然死の発症リスクを予測し適切な患者にICDを使用することが必要であるが,HCM Risk-SCD formula69)などからリスク因子を有する患者に対してICDを導入し,突然死の予防に努めることが求められる.
肥大型心筋症で心室性不整脈の治療を要する場合は,すでにβ遮断薬が投与されていることが多く,併用療法が行われることになる.小児で推奨される抗不整脈薬はアミオダロン,メキシレチン,ソタロールなどであるが,年齢や併存疾患,重症度などを考慮して薬剤を選択する79).他に有用性が示されているものは,ジソピラミドやシベンゾリンといったIa群の薬剤である.成人のデータではNaチャネル抑制による陰性変力作用によって左室流出路狭窄の緩和に有効とされているが81),活動電位持続時間の延長によるQT時間の延長が問題になることがある.肥大型心筋症におけるQT時間延長は,QTc≧450 msで突然死のリスク因子になるという報告もあり82),特に使用経験の少ない小児では慎重に投与を考慮する必要がある.またQT時間を延長させ得るという同様の理由から,III群の薬剤であるアミオダロンやソタロールとの併用にも注意を要する.
引用文献References
1) 日本学校保健会:学校心臓検診の実際—スクリーニングから管理まで—(平成24年度改訂).東京,日本学校保健会,2013
2) Yoshinaga M: Prevalence of sudden death and out-of-hospital cardiac arrest in infants, children, and adolescents: What does it imply? Circ J 2013; 77: 2475–2476
3) 吉永正夫:学校心臓検診.小児科診療2016; 11: 1495–1499
4) 日本学校保健会:平成25年度学校生活における健康管理に関する調査事業報告書.https://www.gakkohoken.jp/books/archives/159
5) 大国真彦:小児心電図心室肥大判定基準の改訂.日小児循環器会誌1986; 2: 248–249
6) 馬場國藏:学校心臓検診—二次検診対象者抽出のガイドライン(2006年改訂)一次検診の心電図所見から—.日本小児循環器会誌2006; 22: 503–513
7) 住友直方:2016年版学校心臓検診のガイドライン.日本循環器学会・日本小児循環器学会.https://www.j-circ.or.jp/cms/wp-content/uploads/2020/02/JCS2016_sumitomo_h.pdf
8) 鮎沢 衛:学校心臓検診2次検診対象者抽出のガイドライン—1次検診の心電図所見から— (2019年改訂).日小児循環器会誌2019; 35: S3.1–12
9) 吉永正夫,泉田直己,住友直方,ほか:日本小児循環器学会学校心臓検診委員会.先天性心疾患の学校生活管理指導指針ガイドライン(2012年改訂版).日小児循環器会誌2012; 28: 2–5
10) 吉永正夫,泉田直己,岩本眞理,ほか:日本小児循環器学会学校心臓検診委員会.器質的心疾患を認めない不整脈の学校生活管理指導ガイドライン(2013年改訂版).日小児循環器会誌2013; 29: 277–290
11) 鮎沢 衛:学校管理下突然死の現状と課題救急蘇生・AED普及に伴うパラダイムシフト.日小児循環器会誌2016; 32: 485–497
12) 独立行政法人日本スポーツ振興センター:学校の管理下の災害[平成27年版].https://www.jpnsport.go.jp/anzen/Portals/0/anzen/kenko/jyouhou/pdf/H27saigai/H27saigai2.pdf
13) 独立行政法人日本スポーツ振興センター:学校の管理下の災害[平成28年版].https://www.jpnsport.go.jp/anzen/Portals/0/anzen/kenko/jyouhou/pdf/H28saigai/H28saigai2.pdf
14) 独立行政法人日本スポーツ振興センター:学校の管理下の災害[平成29年版].https://www.jpnsport.go.jp/anzen/Portals/0/anzen/kenko/jyouhou/pdf/H29saigai/H29saigai02.pdf
15) 独立行政法人日本スポーツ振興センター:学校の管理下の災害[平成30年版].https://www.jpnsport.go.jp/anzen/Portals/0/anzen/kenko/jyouhou/pdf/H30saigai/H30saigai02.pdf
16) 独立行政法人日本スポーツ振興センター:学校の管理下の災害[令和元年版].https://www.jpnsport.go.jp/anzen/Portals/0/anzen/kenko/jyouhou/pdf/R1saigai/R1saigai02.pdf
17) Gupta S, Baman T, Day SM: Cardiovascular health, part 1: Preparticipation cardiovascular screening. Sports Health 2009; 1: 500–507
18) Wheeler MT, Heidenreich PA, Froelicher VF, et al: Cost effectiveness of preparticipation screening for prevention of sudden cardiac death in young athletes. Ann Intern Med 2010; 152: 276–286
19) Chandra N, Bastiaenen R, Papadakis M, et al: Sudden cardiac death in young athletes: Practical challenges and diagnostic dilemmas. J Am Coll Cardiol 2013; 61: 1027–1040
20) Toresdahl BG, Rao AL, Harmon KG, et al: Incidence of sudden cardiac arrest in high school student athletes on school campus. Heart Rhythm 2014; 11: 1190–1194
21) El-Assaad I, Al-Kindi S, Aziz P: Trends of out-of-hospital sudden cardiac death among children and young adults. Pediatrics 2017; 140: 140
22) Corrado D, Basso C, Rizzoli G, et al: Does sports activity enhance the risk of sudden death in adolescents and young adults? J Am Coll Cardiol 2003; 42: 1959–1963
23) Corrado D, Basso C, Pavei A, et al: Trends in sudden cardiovascular death in young competitive athletes after implementation of a preparticipation screening program. JAMA 2006; 296: 1593–1601
24) 住友直方:学校における突然死の予防.小児科2019; 60: 1661–1671
25) Drory Y, Turetz Y, Hiss Y, et al: Sudden unexpected death in persons <40 years of age. Am J Cardiol 1991; 68: 1388–1392
26) Steinberger J, Lucas R Jr., Edwards J, et al: Causes of sudden unexpected cardiac death in the first two decades of life. Am J Cardiol 1996; 77: 992–995
27) Corrado D, Basso C, Thiene G: Sudden cardiac death in young people with apparently normal heart. Cardiovasc Res 2001; 50: 399–408
28) Dancea A, Côté A, Rohlicek C, et al: Cardiac pathology in sudden unexpected infant death. J Pediatr 2002; 141: 336–342
29) Wisten A, Forsberg H, Krantz P, et al: Sudden cardiac death in 15-35-year olds in Sweden during 1992-99. J Intern Med 2002; 252: 529–536
30) Eckart RE, Scoville SL, Campbell CL, et al: Sudden death in young adults: A 25-year review of autopsies in military recruits. Ann Intern Med 2004; 141: 829–834
31) Doolan A, Langlois N, Semsarian C: Causes of sudden cardiac death in young Australians. Med J Aust 2004; 180: 110–112
32) Puranik R, Chow C, Duflou J, et al: Sudden death in the young. Heart Rhythm 2005; 12: 1277–1282
33) Hofman N, Tan H, Clur S, et al: Contribution of inherited heart disease to sudden cardiac death in childhood. Pediatrics 2007; 120: e967–e973
34) 厚生労働省難治性疾患克服研究事業特発性心筋症調査研究班:北畠 顕,友池仁暢(編).心筋症—診断の手引きとその解説—.東京,かりん舎,2005
35) Gersh BJ, Maron BJ, Bonow RO, et al: American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2011; 58: e212–e260
36) 日本循環器学会/日本心不全学会:心筋症診療ガイドライン(2018年改訂版).https://www.j-circ.or.jp/old/guideline/pdf/JCS2018_tsutsui_kitaoka.pdf
37) Hada Y, Sakamoto T, Amano K, et al: Prevalence of hypertrophic cardiomyopathy in a population of adult Japanese workers as detected by echocardiographic screening. Am J Cardiol 1987; 59: 183–184
38) Maron BJ, Gardin JM, Flack JM, et al: Prevalence of hypertrophic cardiomyopathy in a general population of young adults: Echocardiographic analysis of 4111 subjects in the CARDIA Study. Coronary Artery Risk Development in (Young) Adults. Circulation 1995; 92: 785–789
39) Maron BJ, Mathenge R, Casey SA, et al: Clinical profile of hypertrophic cardiomyopathy identified de novo in rural communities. J Am Coll Cardiol 1999; 33: 1590–1595
40) Maron BJ, Spirito P, Roman MJ, et al: Prevalence of hypertrophic cardiomyopathy in a population-based sample of American Indians aged 51 to 77 years (the Strong Heart Study). Am J Cardiol 2004; 93: 1510–1514
41) Zou Y, Song L, Wang Z, et al: Prevalence of idiopathic hypertrophic cardiomyopathy in China: A population-based echocardiographic analysis of 8080 adults. Am J Med 2004; 116: 14–18
42) Maro EE, Janabi M, Kaushik R: Clinical and echocardiographic study of hypertrophic cardiomyopathy in Tanzania. Trop Doct 2006; 36: 225–227
43) Semsarian C, Ingles J, Maron M, et al: New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol 2015; 65: 1249–1254
44) Norrish G, Cantarutti N, Pissaridou E, et al: Risk factors for sudden cardiac death in childhood hypertrophic cardiomyopathy: A systematic review and meta-analysis. Eur J Prev Cardiol 2017; 24: 1220–1230
45) 日本小児循環器学会:平成26年度稀少疾患サーベイランス調査結果.http://jspccs.jp/member/report/database/index.php?download=rare_disease_surveillance_h26.pdf
46) 日本小児循環器学会:CHDサーベイランス2015調査結果.http://jspccs.jp/wp-content/uploads/rare_disease_surveillance_2015.pdf
47) 日本小児循環器学会:CHDサーベイランス2016調査結果.http://jspccs.jp/wp-content/uploads/rare_disease_surveillance_2016_rev181201.pdf
48) 日本小児循環器学会:小児期発生心疾患実態調査2017集計結果報告書.http://jspccs.jp/wp-content/uploads/rare_disease_surveillance_2017_rev1901.pdf
49) 日本小児循環器学会:小児期発生心疾患実態調査2018集計結果報告書.http://jspccs.jp/wp-content/uploads/rare_disease_surveillance_2018.pdf
50) Colan SD, Lipshultz SE, Lowe AM, et al: Epidemiology and cause-specific outcome of hypertrophic cardiomyopathy in children: Findings from the Pediatric Cardiomyopathy Registry. Circulation 2007; 115: 773–781
51) Elliott PM, Anastasakis A, Borger MA, et al:Authors/Task Force members: 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733–2779
52) Maron BJ, Cecchi F, McKenna WJ: Risk factors and stratification for sudden cardiac death in patients with hypertrophic cardiomyopathy. Br Heart J 1994; 72 Suppl: S13–S18
53) McKenna W, Deanfield J, Faruqui A, et al: Prognosis in hypertrophic cardiomyopathy: Role of age and clinical, electrocardiographic and hemodynamic features. Am J Cardiol 1981; 47: 532–538
54) Brothers MB, Oster ME, Ehrlich A, et al: Novel electrocardiographic screening criterion for hypertrophic cardiomyopathy in children. Am J Cardiol 2014; 113: 1246–1249
55) Yoshinaga M, Iwamoto M, Horigome H, et al: Standard values and characteristics of electrocardiographic findings in children and adolescents. Circ J 2018; 82: 831–839
56) Finocchiaro G, Sheikh N, Biagini E, et al: The electrocardiogram in the diagnosis and management of patients with hypertrophic cardiomyopathy. Heart Rhythm 2020; 17: 142–151
57) Axelsson Raja A, Farhad H, Valente AM, et al: Prevalence and progression of late gadolinium enhancement in children and adolescents with hypertrophic cardiomyopathy. Circulation 2018; 138: 782–792
58) Maron BJ, Wolfson JK, Epstein SE, et al: Intramural (“small vessel”) coronary artery disease in hypertrophic cardiomyopathy. J Am Coll Cardiol 1986; 8: 545–557
59) Maron BJ, Wolfson JK, Epstein SE, et al: Morphologic evidence for “small vessel disease” in patients with hypertrophic cardiomyopathy. Z Kardiol 1987; 76 Suppl 3: 91–100
60) Cha YM, Gersh BJ, Maron BJ, et al: Electrophysiologic manifestations of ventricular tachyarrhythmias provoking appropriate defibrillator interventions in high-risk patients with hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol 2007; 18: 483–487
61) McKenna WJ, Franklin RC, Nihoyannopoulos P, et al: Arrhythmia and prognosis in infants, children and adolescents with hypertrophic cardiomyopathy. J Am Coll Cardiol 1988; 11: 147–153
62) Dimitrow PP, Cotrim C, Cheng TO: Importance of upright posture during exercise in detection of provocable left ventricular outflow tract gradient in hypertrophic cardiomyopathy. Am J Cardiol 2011; 108: 614
63) Gimeno JR, Tomé-Esteban M, Lofiego C, et al: Exercise-induced ventricular arrhythmias and risk of sudden cardiac death in patients with hypertrophic cardiomyopathy. Eur Heart J 2009; 30: 2599–2605
64) Maron BJ, Doerer JJ, Haas TS, et al: Sudden deaths in young competitive athletes: analysis of 1866 deaths in the united states, 1980–2006. Circulation 2009; 119: 1085–1092
65) Maron BJ, Ackerman MJ, Nishimura RA, et al: Task Force 4: HCM and other cardiomyopathies, mitral valve prolapse, myocarditis, and Marfan syndrome. J Am Coll Cardiol 2005; 45: 1340–1345
66) Maron BJ, Udelson JE, Bonow RO, et al: Eligibility and disqualification recommendations for competitive athletes with cardiovascular abnormalities: Task Force 3: hypertrophic cardiomyopathy, arrhythmogenic right ventricular cardiomyopathy and other cardiomyopathies, and myocarditis: a scientific statement from the American Heart Association and American College of Cardiology. J Am Coll Cardiol 2015; 132: e273–e280
67) Plehn G, Vormbrock J, Meissner A, et al: Effects of exercise on the duration of diastole and on interventricular phase differences in patients with hypertrophic cardiomyopathy: Relationship to cardiac output reserve. J Nucl Cardiol 2009; 16: 233–243
68) Prasad K, Williams L, Campbell R, et al: Episodic syncope in hypertrophic cardiomyopathy: Evidence for inappropriate vasodilation. Heart 2008; 94: 1312–1317
69) O’Mahony C, Jichi F, Pavlou M, et al: Hypertrophic Cardiomyopathy Outcomes Investigators: A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J 2014; 35: 2010–2020
70) Miron A, Lafreniere-Roula M, Steve Fan CP, et al: A validated model for sudden cardiac death risk prediction in pediatric hypertrophic cardiomyopathy. Circulation 2020; 142: 217–229
71) Basu J, Malhotra A, Papadakis M: Exercise and hypertrophic cardiomyopathy: Two incompatible entities? Clin Cardiol 2020; 43: 889–896
72) Olivotto I, Maron BJ, Tomberli B, et al: Obesity and its association to phenotype and clinical course in hypertrophic cardiomyopathy. J Am Coll Cardiol 2013; 62: 449–457
73) Fumagalli C, Maurizi NDS, Day SM, et al: SHARE Investigators: Association of obesity with adverse long term outcomes in hypertrophic cardiomyopathy. JAMA Cardiol 2020; 5: 65–72
74) Sheikh N, Papadakis M, Panoulas VF, et al: Comparison of hypertrophic cardiomyopathy in Afro-Caribbean versus white patients in the UK. Heart 2016; 102: 1797–1804
75) 日本小児循環器学会学術委員会「小児期肥大型心筋症調査委員会」:小児期肥大型心筋症全国調査結果.日小児循環器会誌2008; 24: 572–574
76) Spoladore R, Maron MS, D’Amato R, et al: Pharmacological treatment options for hypertrophic cardiomyopathy: high time for evidence. Eur Heart J 2012; 33: 1724–1733
77) Maron BJ: Hypertrophic cardiomyopathy. Lancet 1997; 350: 127–133
78) Östman-Smith I: Beta-blockers in pediatric hypertrophic cardiomyopathies. Rev Recent Clin Trials 2014; 9: 82–85
79) Ommen S, Mital S, Burke M, et al: 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2020; 142: e533–e557
80) Maron BJ, Spirito P, Ackerman MJ, et al: Prevention of sudden cardiac death with implantable cardioverter-defibrillators in children and adolescents with hypertrophic cardiomyopathy. J Am Coll Cardiol 2013; 61: 1527–1535
81) Sherrid M, Delia E, Dwyer E: Oral disopyramide therapy for obstructive hypertrophic cardiomyopathy. Am J Cardiol 1988; 62: 1085–1088
82) Patel SI, Ackerman MJ, Shamoun FE, et al: QT prolongation and sudden cardiac death risk in hypertrophic cardiomyopathy. Acta Cardiol 2019; 74: 53–58