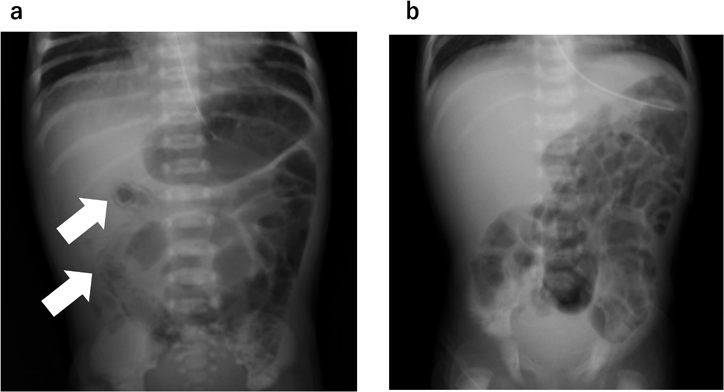
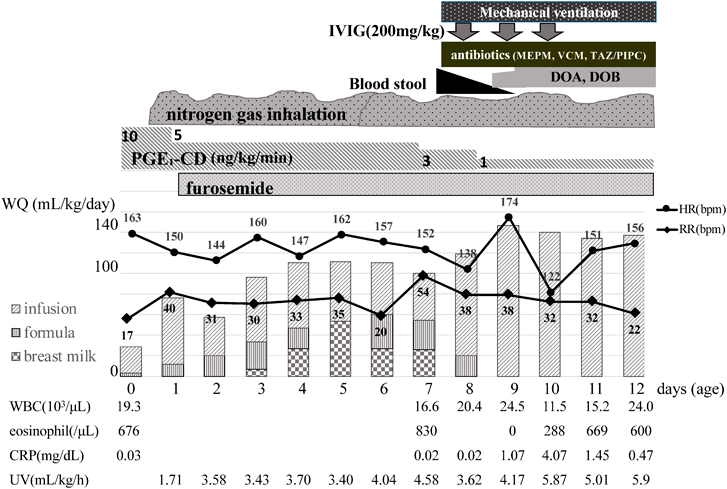
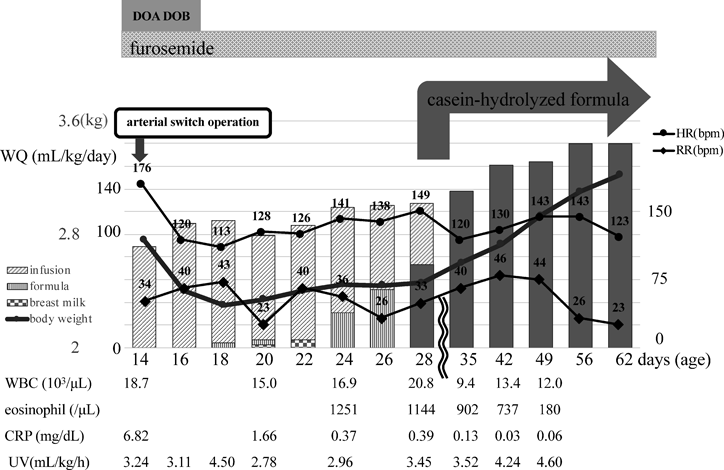
完全大血管転位症に合併した新生児壊死性腸炎後に新生児・乳児食物蛋白誘発胃腸症を発症した1例A Case of Transposition of the Great Arteries that Led to the Development of Non-IgE-Mediated Gastrointestinal Food Allergy after a Neonatal Necrotizing Enterocolitis Complication
永田 万純,若月 寿子,松井 こと子,神保 圭佑,古川 岳史,福永 英生,工藤 孝広,高橋 健,稀代 雅彦,清水 俊明Masumi Nagata, Hisako Wakatsuki, Kotoko Matsui, Keisuke Jimbo, Takeshi Furukawa, Hideo Fukunaga, Takahiro Kudo, Ken Takahashi, Masahiko Kishiro, Toshiaki Shimizu
順天堂大学医学部小児科Departments of Pediatrics, Juntendo University Faculty of Medicine ◇ Tokyo, Japan
受付日:2021年1月15日Received: January 15, 2021
受理日:2021年4月30日Accepted: April 30, 2021
発行日:2021年11月1日Published: November 1, 2021