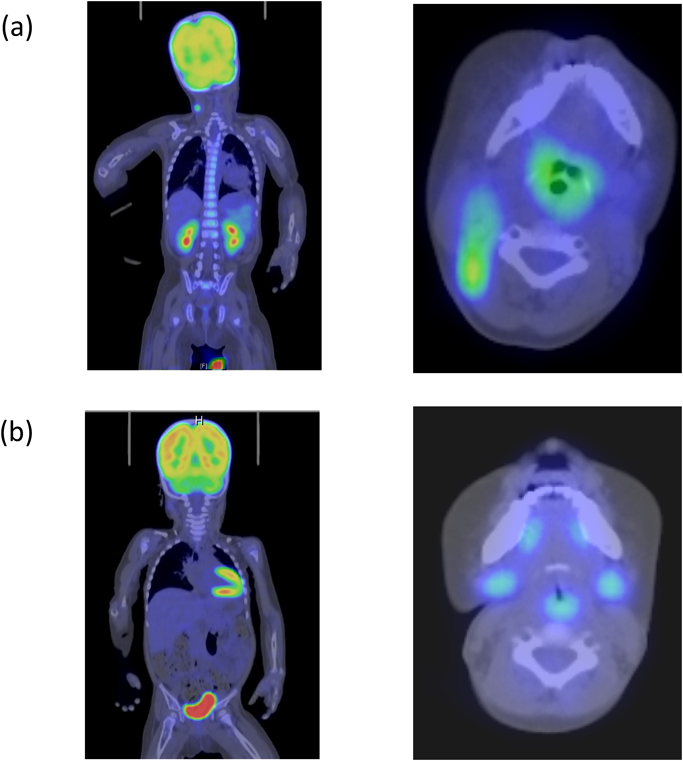
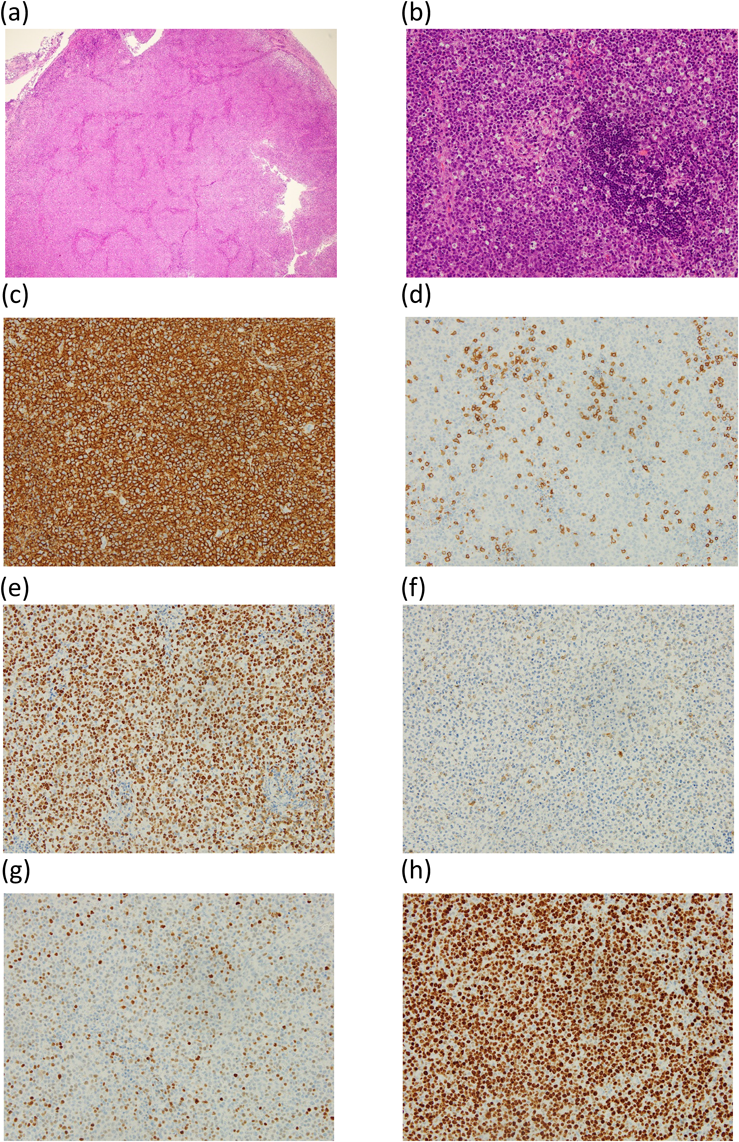
末梢血のEBウイルス感染細胞同定解析に基づき早期に治療開始できた心臓移植後リンパ増殖性疾患の1例Identification of Peripheral Blood Cells Infected with Epstein–Barr Virus: A Practical Method for Choosing the Initial Treatment for Post-Transplantation Lymphoproliferative Disease
1 東京大学医学部附属病院小児科Department of Pediatrics, The University of Tokyo Hospital ◇ Tokyo, Japan
2 国立研究開発法人国立成育医療研究センター 高度感染症診断部Division of Advanced Medicine for Virus Infections, National Center for Child Health and Development ◇ Tokyo, Japan
3 東京大学医学部附属病院病理部Department of Pathology, The University of Tokyo Hospital ◇ Tokyo, Japan