1971年にフォンタン手術が開始されて以来,単心室に対する治療が急速に発展してきた.当初の心房肺動脈連結法に代わり,現在では大静脈肺動脈連結法(TCPC: total cavopulmonary connection)が行われている.特に心外導管を用いたextracardiac TCPCは遠隔期不整脈やエネルギー効率の点からも有利とされている.しかしながら,フォンタン手術の遠隔期には心機能低下や静脈圧上昇の問題があり,注意深く患者観察を行っていく必要がある.フォンタン手術後遠隔期における外科的再介入としては,ペースメーカー植え込み,房室弁形成/置換,フォンタンコンバージョンなどがあるが1),心外導管狭窄の報告はほとんどない.今回我々は,心外導管型フォンタン手術後遠隔期に導管狭窄を認め,再導管置換手術を行った2例を経験したので報告する.
症例1
20歳,男性
現病歴
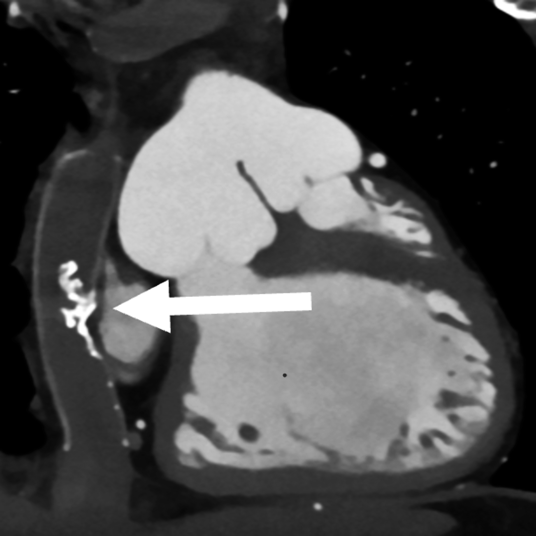
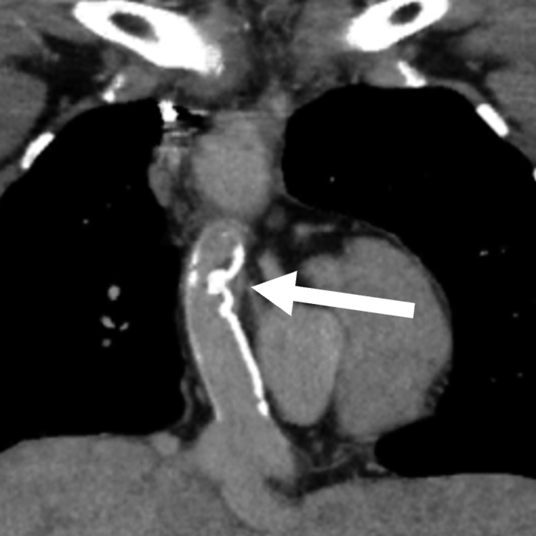
1か月健診で心雑音を指摘され,三尖弁閉鎖不全症(IIc型)と診断された.日齢41に肺動脈絞扼術を施行し,2歳4か月時に両方向性グレン手術,Damus–Kaye–Stansel(DKS)吻合,心房中隔欠損孔拡大を行った.3歳10か月時に心外導管型フォンタン手術(ePTFE: expanded polytetrafluoroethylene 20 mm)を施行した.9歳時の心臓カテーテル検査では,明らかな圧較差は認めないが,導管の一部にわずかに造影欠損を認めていた(Fig. 1).抗血栓薬は抗血小板薬のみを内服していた.19歳時に完全房室ブロックが出現し,ペースメーカー植え込みが必要となった.経胸壁心エコー検査にて中等度の新大動脈弁閉鎖不全を認め,心臓カテーテル検査・CT検査にて心外導管中央に狭窄を認め,同時手術目的に当科紹介となった.
入院時現症
身長:177 cm,体重:90.9 kg,血圧:110/56 mmHg,脈拍:48回/min, SpO2: 98%(room air),頸静脈怒張なし,下腿浮腫なし.
血液検査
T.Bil 1.4 mg/dL, AST 31 U/L, ALT 41 U/L, γ-GTP 98 U/L, BUN 15 mg/dL, Cre 0.77 mg/dL, BNP 11 ng/mL,ヒアルロン酸59 ng/mL,IV型コラーゲン134 ng/mL, PTINR 1.09 INR, D-dimer 0.5 µg/mL以下
胸部X線写真
心胸郭比53%,肺血管陰影増強なし,左第3, 4弓突出あり
心電図
心拍数:47回/分,心房レート:83回/分,完全房室ブロック,右軸偏位
心エコー検査
左室拡張末期径:55.5 mm,左室収縮末期径:36.3 mm,左室駆出率:72%,大動脈弁逆流:軽度,新大動脈弁逆流:中等度
心臓カテーテル検査
上大静脈圧:14 mmHg,下大静脈圧:15 mmHg,平均肺動脈圧:11 mmHg,肺動脈楔入圧:8 mmHg,導管中央に狭窄あり,圧較差は2 mmHg.冠動脈は単一冠動脈であり,右冠尖から起始.新大動脈弁逆流:sellers III度
造影CT検査
導管内に粗大な石灰化あり,内腔の狭小化を認めた(Fig. 2).
手術
再心外導管置換術(ePTFE 22 mm),新大動脈弁置換術(SJM 23 mm),心外膜ペースメーカー植え込み術.手術時間:9時間25分,人工心肺時間:189分,大動脈遮断時間:88分,輸血:有
手術所見
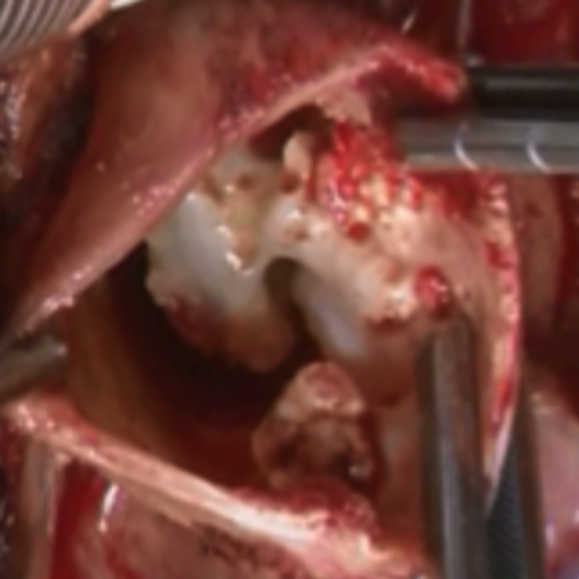
再胸骨正中切開.癒着は中等度~高度,心外導管と右心房の癒着は丁寧に剥離を進めることにより可能であった.右大腿動脈送血,上下大静脈脱血で人工心肺を確立した.大動脈遮断時は新大動脈弁を外側から用手圧迫し大動脈弁逆流を制御することにより順行性心筋保護液注入により心停止を得ることができた.2回目以降はDKS吻合越しに単冠動脈に選択的冠動脈還流を行うことにより心筋保護を行った.心停止下に新大動脈弁置換(SJM 23 mm)施行.大動脈遮断解除後,導管の両端を遮断して,切開.内腔は石灰化により狭窄をきたしていた(Fig. 3).下大静脈側の導管は石灰化が著しく,完全に切除した.右大腿静脈より脱血カニューラを挿入し,下大静脈カニューラを抜去し,下大静脈と人工血管を吻合した.肺動脈側の導管を1.5 cm程度残した状態で切り離し,人工血管同士を吻合した.人工心肺離脱問題なし.心外膜リードを心房・心室に留置し左前胸部にリードを誘導しペースメーカー本体に装着し,通常通り閉胸した.
術後経過
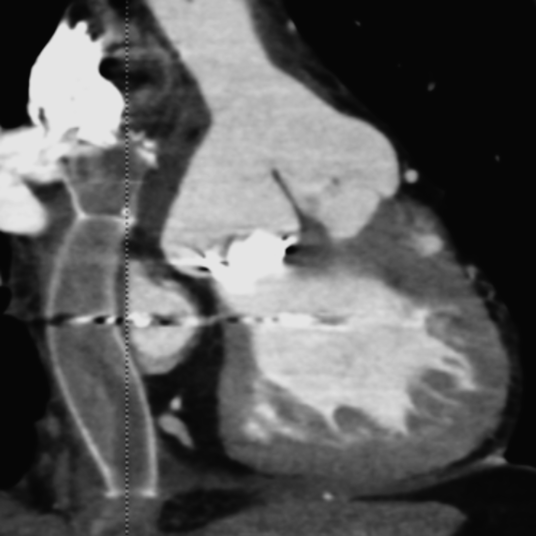
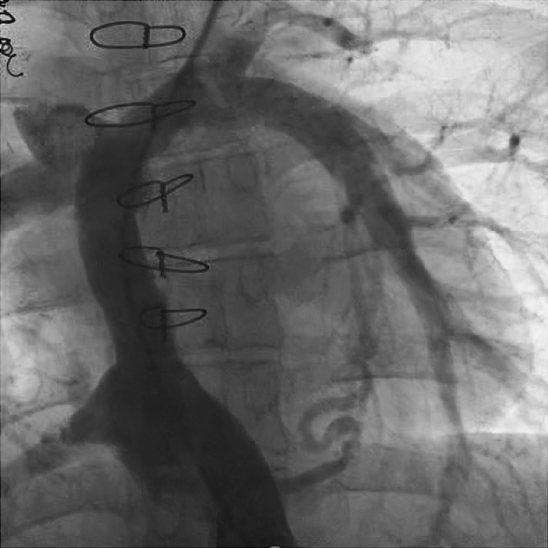
術後4時間で抜管となり,術後1日目にICU退室となった.経過良好にて術後18日目に自宅退院となった.術後1年での心臓カテーテル検査にて,上大静脈圧:10 mmHg,下大静脈圧:10 mmHg,平均肺動脈圧:9 mmHg,肺動脈楔入圧:4 mmHg,心係数:2.58 L/min/m2,肺血管抵抗:0.8 wood unit,導管再狭窄は認めなかった(Fig. 4).現在術後1年6か月経過し社会復帰している.
症例2
20歳,男性
現病歴
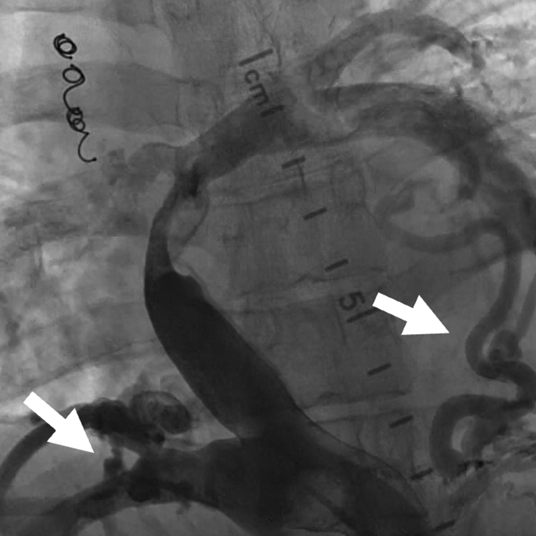
肺動脈閉鎖症,無脾症の診断で月齢3に左BTシャント変法を施行された.シャント閉塞認め,1歳3か月時に左BTシャント変法を,2歳時に右BTシャント変法を追加された.3歳時に両方向性グレン手術施行し,5歳時に心外導管型フォンタン手術(ePTFE 18 mm)施行した.術直後の心臓カテーテル検査から心外導管に造影欠損部を認めており,2 mmHgの圧較差を認めていた(Fig. 5). 17歳時の心臓カテーテル検査では,心外導管の圧較差2 mmHgと狭窄の進行はなく,下大静脈圧は14 mmHgで再手術の適応はないと判断されていた.17歳ごろより1年間ワーファリンを自己中断していた.その後当院成人先天性心疾患外来紹介.19歳時より倦怠感,下血,喀血が出現し,心臓カテーテル検査を施行した.下大静脈圧は26 mmHg,平均肺動脈圧は8 mmHgと圧較差を14 mmHg認めた(Fig. 6),心外導管に対してバルーン拡張術を施行し,下大静脈圧は20 mmHgと軽度改善したが下大静脈圧の十分な低下は得られず,手術適応と考えられ,再心外導管置換目的に当科入院となった.
入院時現症
身長162 cm,体重66.1 kg,血圧94/57 mmHg,脈拍104/分,SpO2 92%(room air),頸静脈怒張なし,心雑音なし,右上腹部皮下静脈の拡張あり,下腿浮腫なし.
血液検査
T.Bil 0.7 mg/dL, AST 89 U/L, ALT 95 U/L, γ-GTP 92 U/L, BUN 12 mg/dL, Cre 0.6 mg/dLヒアルロン酸:16.2 ng/mL,IV型コラーゲン273 ng/mL, PTINR 1.26 INR, D-dimer 0.5以下µg/mL
胸部X線写真
心胸郭比42%,肺野に異常所見なし
心電図
心拍数100 bpm,洞調律,不確定軸,陰性T波(V1–V4)
心エコー検査
左室拡張末期径:48.1 mm,左室収縮期径:32.8 mm,左室駆出率:68.3%
心臓カテーテル検査
上大静脈圧:14 mmHg,下大静脈圧:23 mmHg,平均肺動脈圧:13 mmHg,肺動脈楔入圧:12 mmHg,心係数:2.66 L/min/m2
造影CT検査
心外導管内に突出した石灰化を認め,導管内狭窄を認めた(Fig. 7).
手術
再心外導管置換術(ePTFE 18 mm),手術時間:10時間18分,人工心肺時間:143分,大動脈遮断時間:0分,輸血:有
手術所見
右大腿動脈送血,右大腿静脈脱血を用いて人工心肺を使用しながら再胸骨正中切開.心外導管は肺動脈との吻合部より5 cm程度尾側で屈曲しており,同部位から肺動脈側へ古い血栓の付着とグラフト内に偽内膜肥厚を認めた.導管を肺動脈吻合ラインより4~5 mm残したラインで切断し,ePTFE 18 mmを吻合した.
術後経過
術翌日に抜管となり,術後3日目にICU退室となった.術後10日目に心臓カテーテル検査施行し,平均肺動脈圧:10 mmHg,肺動脈楔入圧:12 mmHgであり,導管内に狭窄は認めなかった(Fig. 8).術後32日目に自宅退院となり,現在術後6年で経過良好である.
1971年に12歳の三尖弁閉鎖症の患児に対して心房肺動脈連結法を用いたフォンタン手術が報告されて以降,単心室症に対する外科治療は飛躍的に進歩した.現在ではエネルギー効率や不整脈の問題からも心外導管型TCPCが主に行われている2, 3).
フォンタン手術成績の向上に伴い,現在ではフォンタン術後遠隔期合併症が問題となってきている.Mayo Clinicからの40年にわたる1,052名のフォンタン術後患者の報告でも2001年以降のフォンタン術後10年生存率は95%と良好である.フォンタン術後再手術はペースメーカー挿入術が212例(20%)再フォンタン手術117例(11%),房室弁形成もしくは置換術が66例(5%)などの報告があり,遠隔期にも外科的介入が必要となる症例は認められる4).しかしながら,心外導管狭窄における導管再置換の報告は散見される程度である.
主に用いられているePTFEによる心外導管型TCPCに関しては,Leeらの154例の心外導管型TCPCのうち術後約3年間で導管狭窄によって再手術となった症例はなかったとの報告6)や,Ochiaiらの33名の心外導管型TCPCのうち術後約5年間で導管狭窄や屈曲症例はなかったとの報告7)など,良好な成績が報告されている.Brakelらは,ダクロンを用いた心外導管では,フォンタン手術後,平均6.5年で75%が導管狭窄に対して導管置換を必要であったと報告している8).
フォンタン手術成績が向上していくにつれ遠隔期合併症の予防及び治療が重要となってくると考えられるが,遠隔期合併症には,不整脈,心不全,房室弁閉鎖不全,血栓塞栓症,肝機能障害,蛋白漏出症候群,チアノーゼなどがある9).その中でも肝機能障害はフォンタン循環関連肝臓病(Fontan-associated liver disease; FALD)として非常に重要な予後規定因子とされている.フォンタン循環関連肝臓病は,中心静脈圧上昇に基づく肝類洞の拡張による機械的刺激,血栓形成,虚血により肝細胞への酸素供給の低下により肝類洞の線維化がみられ,さらに門脈域の線維化が加わることで肝硬変に進展すると考えられている10).フォンタン術後患者にとって良好な心機能と低い中心静脈圧を保ち,良好なフォンタン循環を維持することが重要であり,導管狭窄による高い下大静脈圧は肝機能障害の悪化,進行を助長することとなると考えられる.本研究のように導管狭窄が認められる症例では,早期に狭窄解除を行うことにより下大静脈圧を低下させることは長期的な予後の観点からも重要であると考えられる.
今回の2症例で導管狭窄が生じた原因としては,心外導管の屈曲もしくは心房などによる外的圧迫などが考えられ,狭窄・屈曲部位に血栓を生じ石灰化することにより狭窄が進行していくと考えられる.Cateらは,導管狭窄の原因として,外的圧迫とそれに伴いグラフトが引き延ばされることで内腔が狭窄するのではないかと推察しており,年齢とともに心房が拡大することも術後遠隔期にグラフトを圧迫する要因の一つではないかと考察している11).またHaglerらは,2歳程度で吻合されているグラフトであるため,体格の成長によるグラフトが引き延ばされることでTCPC後10~15年後に導管狭窄が認められるようになるのではないかと推察している12).本研究では2症例ともに,術後早期の心臓カテーテル検査において心外導管の一部に造影欠損を認めており,導管全体の狭窄というよりは,導管の圧迫もしくは屈曲部位を中心として狭窄が進行していると考えられた.フォンタン手術時において心外導管の長さの決定は比較的難しいが,心房や肺静脈などの周囲組織を圧迫することない導管吻合に留意することが重要と考えられる.
また抗凝固療法としては,症例1に関しては抗血小板薬のみであったこと,症例2では1年間のワーファリン自己中断期間があったなどがあった.術後早期より心外導管の一部に造影欠損を認めているおり,血栓が疑われる場合には抗凝固療法の開始を考慮し経過観察を行う必要があると思われた.両症例ともに喫煙や高コレステロール血症等の血栓症の危険因子は認められなかった.
当院における約3年間の成人先天性心疾患手術92例のうち約80%の症例が再手術である.成人先天性心疾患手術の特徴としては,1. 患者の多くが20~40代となっており,社会的,家庭的背景に考慮する必要があること.2. 手術をする際にはガイドライン上境界領域にある複合病変を持ち合わせていることが多いこと.3. 生命予後は長いと考えられるため一生のうちでの手術回数をできるだけ減らす考慮が必要なこと.などがあげられる.症例1では,当初有症候性の完全房室ブロックに対して,再開胸での心外膜ペースメーカー装着のみを行う予定であった.精査をしてみると心外導管狭窄(圧較差2 mmHg)及び中等度の新大動脈逆流が認められた.この2つに関しては各々単独では手術適応にならない可能性もあるが,心不全や肝機能障害,蛋白漏出性症候群などのフォンタン術後合併症に予防,手術介入回数の減少などを考慮し,患者及び家族とも相談の上で再心外導管置換及び新大動脈弁置換を同時に施行することとなった.
導管狭窄の治療法としては,カテーテル治療によるステント留置により導管狭窄解除を行う報告もある.HeglerやCateらの報告にもあるように,ステント留置により導管内腔をもともとの内腔と同程度まで拡張でき,導管内の圧較差を減少できたとの報告がある11, 12).当然カテーテル治療は外科手術と比較して侵襲度は低く安全行うことはできるが,外科手術のようにもとの大きさ以上のグラフトに変えることは不可能であり,開心術に耐えれないような症例や成人期の再手術までに橋渡しとしては有効と考えられる.症例2のようにバルーン拡張術が有効でない症例では,外科的導管再置換が有用であると考えられる.
心外導管型フォンタン手術後に再導管置換を行った2症例を経験した.心外導管狭窄における再導管置換自体は比較的稀な合併症であるが,心外導管型フォンタン手術後には起こりうる合併症の一つであり,定期的な画像検査にてフォローアップを行い,フォンタン循環維持のため早期に対応が必要である.今回2症例に対して導管再置換手術を行い良好な経過であったので報告した.
利益相反
本論文について開示すべき利益相反(COI)はない.
引用文献References
1) 中野俊秀:Fontan手術の遠隔成績と再介入.日小児循環器会誌2017; 33: 362–370
2) d’Udekem Y, Iyengar AJ, Cochrane AD, et al: The Fontan procedure: Contemporary techniques have improved long-term outcomes. Circulation 2007; 116 Suppl: I-157–I-164
3) Backer CL, Deal BJ, Kaushal S, et al: Extracardiac versus intra-atrial lateral tunnel Fontan: Extracardiac is berter. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2011; 14: 4–10
4) Pundi KN, Johnson JN, Dearani JA, et al: 40-year follow-up after the fontan operation long-term outcome of 1,052 patients. J Am Coll Cardiol 2015; 66: 1700–1710
5) Nakano T, Kado H, Tatewaki H, et al: Results of extracardiac conduit total cavopulmonary connection in 500 patients. Eur J Cardiothorac Surg 2015; 48: 825–833, discussion, 832
6) Lee C, Lee CH, Hwang SW, et al: Midterm follow-up of the status of Gore-Tex graft after extracardiac conduit Fontan procedure. Eur J Cardiothorac Surg 2007; 31: 1008–1012
7) Ochiai Y, Imoto Y, Sakamoto M, et al: Mid-term follow-up the status of Gore-Tex graft after extracardiac conduit Fontan procedure. Eur J Cardiothorac Surg 2009; 36: 63–68, discussion, 67–68
8) Brakel TJ, Schoof PH, Roo F, et al: High incidence of Dacron conduit stenosis for extracardiac Fontan procedure. J Thorac Cardiovasc Surg 2014; 147: 1568–1572
9) Ohuchi H: Adult patients with Fontan circulation: What we know and how to manage adults with Fontan circulation? J Cardiol 2016; 68: 181–189
10) Luis T, Enrique R, Agustin A, et al: Fontan-associated liver disease: A review. Ann Hepatol 2018; 17: 192–204
11) Cate F, Tireschmann U, Germund I, et al: Stenting the Fontan pathway in paediatric patients with obstructed extracardiac conduit. Heart 2017; 103: 1111–1116
12) Hagler DJ, Miranda WR, Haggerty BJ, et al: Fate of Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis 2019; 14: 1–11