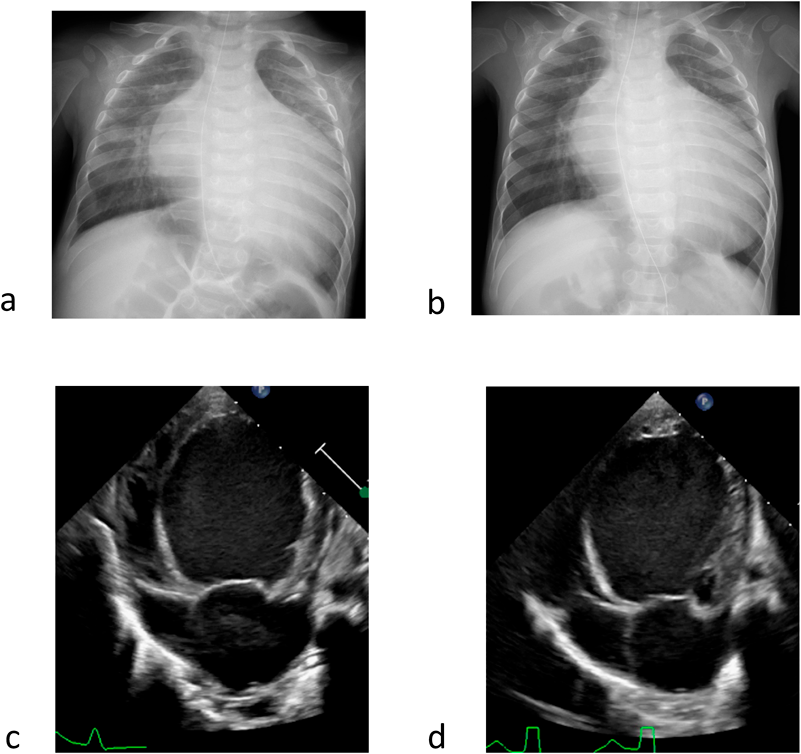
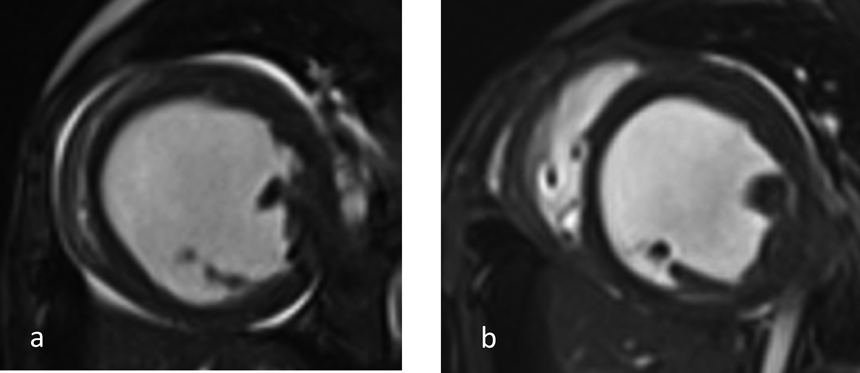
特発性拡張型心筋症に対し肺動脈絞扼術を施行した1乳児例Pulmonary Artery Banding in an Infant with Idiopathic Dilated Cardiomyopathy
1 国立成育医療研究センター循環器科Division of Cardiology, National Center for Child Health and Development ◇ Tokyo, Japan
2 国立成育医療研究センター心臓血管外科Division of Cardiovascular surgery, National Center for Child Health and Development ◇ Tokyo, Japan