先天性心疾患は心臓の形態形成異常である.外科医は,手術によって心臓の形を作り変えて心形態異常を“治す”のではなく,生まれてきた新生児が肺呼吸を始めることにより出現してくる様々な症状を,手術によって“寛解”するのである.
著者が国立循環器病センター(現国立循環器病研究センター)に勤務していた1986~91年当時の先天性心疾患に対する2心室治療の成績は,乳児期以降に修復手術を行う症例では概ね良好となり,新生児期に修復手術が必要な総肺静脈還流異常,完全大血管転位,大動脈縮窄・離断を伴う心室中隔欠損などにおいても手術成績の向上がみられていた.
1心室治療(Fontan型手術)のための準備手術の成績
一方,Fontan型手術を目指さざるをえない単心室類似疾患においては,体心室が左心室である三尖弁閉鎖では手術成績は良好であったものの,共通房室弁を有する単心室では房室弁閉鎖不全や心室機能の低下を来すことが多く,また心外型総肺静脈還流異常(TAPVC)や体心室流出路狭窄(大動脈弁下狭窄)を合併する症例があり,Fontan型手術に到達できない例が多数存在した.
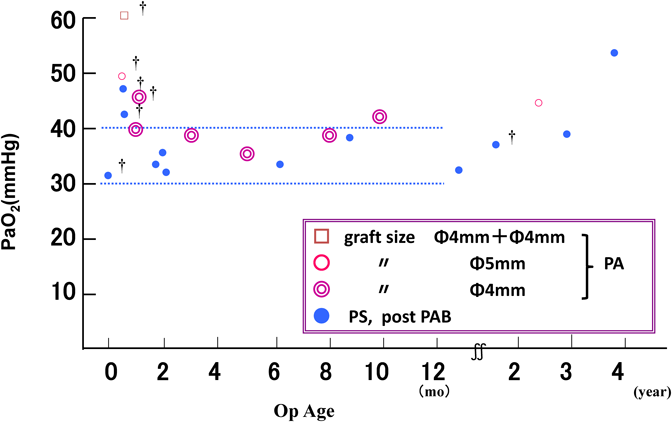
特に,right isomerism(無脾症候群)においては,90%の症例が肺動脈狭窄(PS),肺動脈閉鎖(PA)で,約50%がTAPVCを合併していた1).このような症例では,新生児,乳児期早期に体外循環下に肺静脈閉塞の解除を行う必要があるが,肺血管抵抗が高くて安定しない新生児期の成績は不良であった.できるだけ新生児期を超えるまで手術を待機し,PA例では体肺動脈短絡(BT shunt)による短絡量を最小限にし,心室容量負荷を少なくするような人工血管のサイズの選択と術後管理により手術成績が向上することを,1989年第42回日本胸部外科学会総会で発表した1).
また,無脾症候群に対しTAPVCの修復を行って体外循環を離脱した時の,閉胸直前の動脈血酸素分圧(PaO2)と手術成績の関係を検討したところ,救命可能であったのは乳児期以降の手術例で,PaO2を30~40 mmHgにコントロールすることができた症例であった2)(Fig. 1).
当時の心臓外科医は,術後もICUのベッドサイドに座り込み,尿量計を見つめて仲間と議論しながら夜を徹して術後管理を行うのが常であったが,この時重大なことに気づいた.PS例や肺動脈絞扼術(PAB)後の症例では術後管理が比較的容易で救命例が多かったのに対し,肺への血流路としてBT shuntを行った症例では術後管理に難渋することが多く,気管内吸引などを行って肺血管抵抗が低下することをきっかけに突然心停止を来す症例を経験したことである.
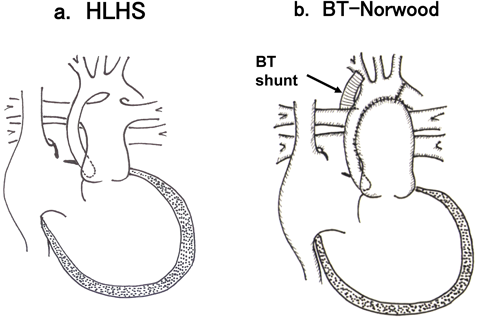
HLHSは,大動脈弁閉鎖または高度狭窄で,左心室,僧帽弁が高度低形成の心形態形成異常である(Fig. 2a).右心室から肺動脈幹へ駆出された血液は,左右肺動脈と,動脈管を介して大動脈に流れ,酸素化されて肺から還ってきた血液は,左心房から卵円孔を介して右心房に流入し,上下大静脈から還ってきた静脈血とともに右心室へ流入する.出生後動脈管が収縮すると大動脈へ駆出される血液が減少してショックに陥るため,PGE1の投与により動脈管の開存を図る.動脈管が開存していても生後間もなく肺血管抵抗が低下するので,体動脈の拡張期圧が低下し,体の臓器血流が低下して強い循環不全に陥る.
本症もFontan型手術を目指す心形態の1つであるが,症状を寛解する準備手術を新生児期から何回か行って,肺血管抵抗が低下する年齢までFontan型手術を待機する必要がある.その準備手術としては,
- 1)動脈管を介さない右心室から大動脈への血流ルートの作成
- 2)肺への血流路の確保
- 3)心房間交通孔の拡大
が基本であるが,これらの手術手技を生後すぐの肺血管抵抗が不安定な新生児期に,体外循環下に行う必要がある.
1981年Norwoodらは,HLHSに対する第一期手術の成功を報告した3).それは,大動脈弓から細い上行大動脈にかけて肺動脈幹を吻合して大動脈を再建し,新大動脈から肺動脈へ径4 mmのePTFE人工血管を用いて肺への血流路としたものであった.その後,肺への血流路としては,,腕頭動脈または鎖骨下動脈から右肺動脈へ,径3 mmまたは3.5 mmの人工血管を用いて短絡路を作成する方法(BT Norwood)が一般的となっている(Fig. 2b).
しかし本邦においてはほとんど成功例がなく,Norwoodらとの手術成績の違いは,患者の術前状態に加え,手術手技,術後管理の習熟度の違いによるものが大きいと考えられた.また成績が不良であった他の要因としては,生まれてすぐの新生児期に体外循環を用いた大きな侵襲の手術手技が必要であることに加え,術後の肺への血流路がBT shuntであることより,体動脈の拡張期圧の低下による体の臓器血流の低下,特に冠血流の低下により体心室(右心室)不全を来すことである.
そこで,無脾症候群に対し体外循環下にTAPVCの修復を行った経験から,肺への血流路としてBT shuntではなく,PSすなわち右室肺動脈導管(RV-PA conduit)により血流を確保すれば,体血圧の拡張期圧が低下することなく臓器血流を良好に維持し,冠血流を良好に維持して症状を寛解できるのではないかと考えた.
そもそもBT shuntの血行動態は,動脈管開存(PDA)そのものである.低出生体重の新生児におけるPDAでは強い循環不全を呈し,早急な動脈管の閉鎖を必要とすることを,1981~83年に勤務していた大阪府立母子保健総合医療センター(現大阪母子医療センター)(以下,母子医療センター)で経験した.頭部のドップラーエコー検査で前大脳動脈の血流を見ると,拡張期に血液が後方に大きく引き込まれている.これが体のすべての臓器で起こって強い循環不全を呈し,十分な尿量が得られない.そこで動脈管を結紮すると,劇的に心不全,循環不全が改善する.BT Norwood法は人工血管で鎖骨下動脈や腕頭動脈などの体の動脈から肺動脈にシャントを置いて肺血流を確保する方法で,PDAと類似の血行動態のため,術後も体血圧の拡張期圧が低い状態が続く.手術侵襲が加わった分,救命は難しいことになる.
RV-PA conduitによるNorwood手術(RV-PA Norwood)第1例目
1991年に著者が母子医療センターに勤務して1年が経ち,出生時体重3,648 gの男児が,PGE1をショットで静注してBE-20で救急搬送されて入院となった.HLHSと診断した後手術の承諾が得られるまで1週間を要したが,結果として患者の状態は改善して安定し,生後18日に手術を行うこととなった.母子医療センターのこれまでの成績は,13例中の手術死亡が11例(手術死亡率85%)で,大きな施設でたくさんのHLHSの手術をしているNorwoodらと同じやり方では到底救命できない,母子医療センターの力量に応じた術式でやろうと考えた.
手術の前日,当時の心臓血管外科のメンバー(著者,飯尾雅彦,明渡 寛,福田宏嗣,久米庸一)がICUのラウンドテーブルの前に集まって術前の検討を行った.これまで本邦では救命例がほとんどない疾患であり,とにかく1例目は絶対に助けたいという思いで以下の手術手順を考えた.術前状態は不良で強い心不全状態にあるため,できるだけ侵襲の少ない方法,すなわち心臓を止めずに手術ができないかという中田 健(当時母子医療センター副院長)の提案から,
- 1)体外循環下に心停止を行わずにすべての手術手技を行うこととし,右鎖骨下動脈から送血し,上行大動脈の拡大は行わないことにした.胎児期にこの細い上行大動脈で冠血流が維持できていたわけであるから,Norwood手術後もこの上行大動脈で冠血流はとりあえずまかなえると考えた.
- 2)心房間の交通孔(卵円孔)の拡大は行わずにそのままとし,必要なら後に体外循環を用いずに非直視下に拡大することとした.
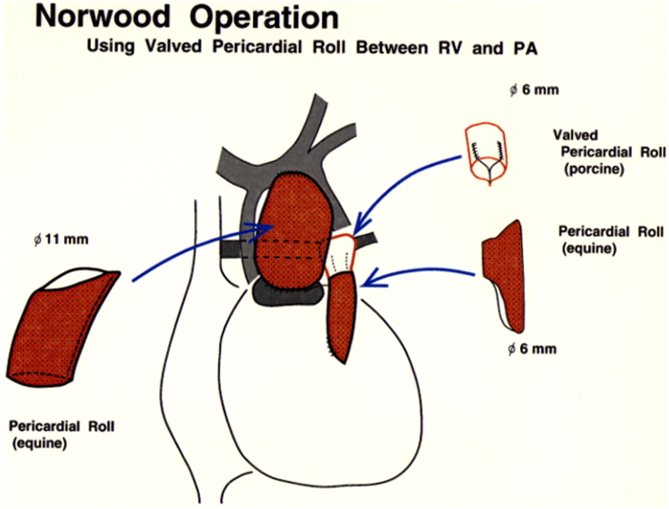
- 3)動脈管を切除した後の大動脈弓と肺動脈幹の間は,ウマ心膜でロールを作成して間置する.心膜ロールを大動脈弓に吻合する際,下半身の血流が遮断されて腎機能の低下が危惧されるので,大腿動脈から少しでも血液を送って下半身の血流を止めずにやろう,その方が気分的に余裕を持って確実な吻合ができるということで,18Gのカニューレを大腿動脈に留置し,下半身にも送血することとした.
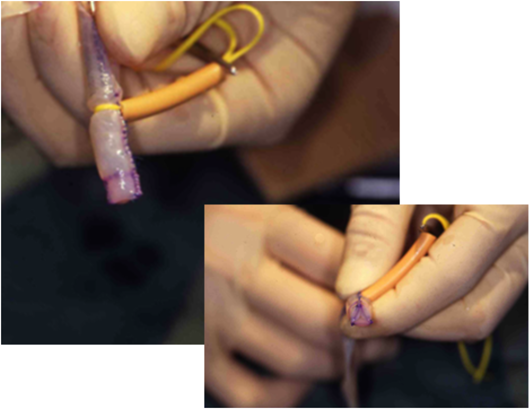
- 4)RV-PA conduitは,八木原俊克(当時国立循環器病センター)により考案されたvalved pericardial roll(VPR)4):内径6 mmの3弁付きブタ心膜ロール(Fig. 3)を作成して肺動脈に吻合し,conduitの近位部はウマ心膜ロールとし,これも心拍動下に心室と吻合することとした.
手術を行ったのは1992年6月2日,体外循環時間4時間56分,心停止0分であった(Fig. 4).心停止を行わず安定した体外循環であったので,患者の心臓に大きな負担をかけていない,体外循環の影響で多少肺への侵襲があったとしても,術中尿量は維持できていたので回復は可能である.ポンプオフができないはずはないと信じて体外循環からの離脱を行ったところ,予想どおり全く良好な血行動態であった.体外循環離脱直後のPaO2は34 mmHg,手術終了時は29 mmHg(FiO2 1.0)であった.術後2日目に,心エコー下に特製のナイフを用いて非直視下に卵円孔の拡大を行うことにより低酸素血症の改善が見られ,術後23日目に気管内チューブを抜去して病棟へ帰室した.しかしその後急速にチアノーゼが進行し,啼泣時にさらに増強した.まるでファロー四徴の無酸素発作のようで,術後3か月に失った.
原因はconduitの狭窄が進行したためであり,バルーンによる拡大,あるいはBT shuntの追加をすべきであったかと悔やまれた.
この症例をビデオで1993年3月に第23回日本心臓血管外科学会総会5)で,6月にWorld Congress of Pediatric Cardiology and Cardiac Surgery(Paris)6)で発表した.
この発表に注目して声をかけてくださったのは竹内成之先生(当時慶應大学)と横田道夫先生(当時静岡県立こども病院)で,竹内先生は学会会場の出口で待っていてくださり,術式の詳細について質問された.また横田先生は海外の誰がやっているのかと尋ねられ,「誰もやっていません」と得意になってお答えしたが,conduitの設置のために体心室を切開することに懸念を示された.
その後の母子医療センターにおけるRV-PA conduit手術
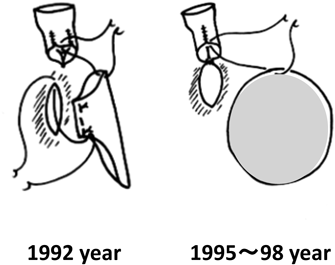
PSの進行を少しでも遅らせることはできないものかと,以後はconduitの形状の工夫を試みることにした.1例目を失ってから3年が経ちやっと2例目が入院した.1例目(1992年)のRV-PA conduitは,内径6 mmの3弁付きブタ心膜ロールを遠位端として肺動脈に吻合し,近位部は内径6 mmのウマ心膜ロールを右心室流出路に吻合したものであった.Conduitが早期に狭窄を来した原因は,心膜を折り返して作成した弁のところが最狭小部であったことより,2例目から(1995~98年)は心膜ロールを2弁とし,近位部はウマ心膜ロールでなくパッチとして縫着した(Fig. 5).
当時,体心室である右心室を切開することが遠隔期の心機能に悪影響を及ぼすのではないかということが危惧されていた.この頃,田村時緒先生(当時天理よろづ相談所病院)の「右室流出路は収縮に関与しない場所だから,切開しても心機能には影響しないので大丈夫!」という言葉を伝え聞いたことも後押しとなり,また1997年に安井久喬先生(当時九州大学)が大阪大学で講演された際の「先輩と同じことをしていたのでは助からない!」という言葉にも支えられ,さらに症例を重ねることになった.
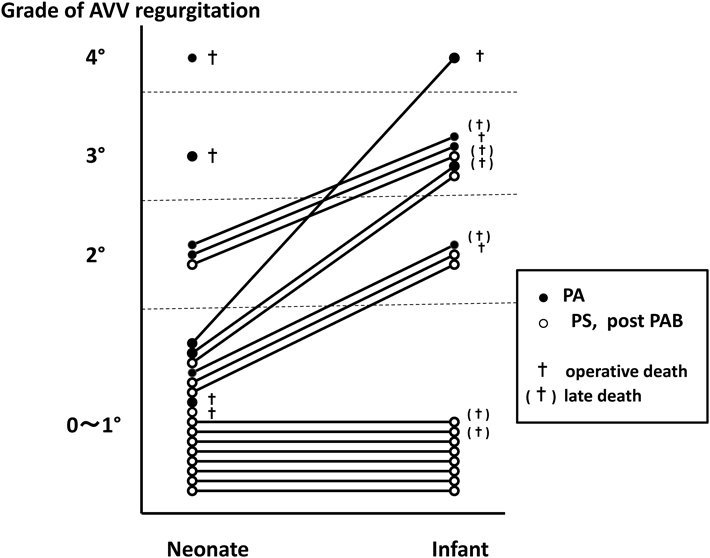
この術式の優位性は,その後の母子医療センターでの1991年から97年における無脾症候群21例の手術成績の検討7)において確信した(Fig. 6).新生児期における共通房室弁の逆流が2度以上であったものはPAの症例では8例中4例であったのに対し,PS, PAB後の症例では13例中1例のみであった.21例中,手術死亡の4例を除く17例の乳児期における房室弁逆流の程度は,新生児期より増強したものが9例(PA 5例,PS 4例),増強せずに0~1度にとどまったものは8例ですべてPSの症例であった.また,乳児期を超えての生存例8例は全例がPS例であった.
単心室類似疾患に対するFontan型手術のための準備手術としてのRV-PA conduitによる肺血流の確保は,HLHSに対し1981年Norwoodらにより径12 mmのHancock valved conduitにより行われ3),また1991年Imaiらによって三尖弁閉鎖に対し,径5 mmのEPTFE人工血管によりRV-PA “shunt”が行われていた8).しかし,体血圧の拡張期圧を低下させない利点を意識して行われたものでなかったものと考え,この新しい考え方による術式を1998年,“The modified Norwood operation using an extra cardiac conduit from the right ventricle as a pulmonary blood supply”というタイトルでAnn Thorac Surgに投稿した.しかし症例が5例と少なく,しかも経過が短期間であること,体心室である右心室を切開することの心機能への影響が危惧される等を指摘されrejectされた.“Small institute”からの新しい術式の発表なので受け入れてもらえないのかと落胆したが,タイトルを“The modified Norwood palliation on a beating heart”と変更し,以後の2例の症例を追加し,連続7例が全例手術生存して術後経過が安定したものであった内容を投稿し,1999年やっとJ Thorac Cardiovasc Surgのbrief communicationに掲載された9).
1998年2月に佐野俊二(当時岡山大学)が,同8月に角 秀秋(福岡市立こども病院)がRV-PA conduit法による低出生体重児のNorwood手術に成功し,この術式の術後経過が安定したものであることを,手術に関係した者が実感することとなった.また2000年11月には原田順和(長野県立こども病院)が,ECCより離脱できないHLHSの症例に対し,BT shuntをはずしてRV-PA conduitに変更して救命したことを報告し,本邦において一気にこの術式が行われることになった.
2000年の第37回日本小児外科学会総会のHLHSの外科治療に関するシンポジウムにおいて発表があった5施設すべてにおいて,肺血流路の再建はRV-PA conduit法を第一選択としていた10).Imoto, Kadoら11)は1998年8月~1999年9月に6例のRV-PA conduit法によるNorwood手術を行い,4例の生存を2001年に報告した.またSanoら12)は,1998年2月~2002年2月に19例のRV-PA “shunt”手術を行い,体重2 kg未満の3例を含む17例(89%)に成功したことを,2003年第83回米国胸部外科学会(AATS)で発表し,このJapanese methodがNorwood手術の一方法として,広く世界で認識されるようになった.
本術式の欠点であるRV-PA conduitの早期の狭窄については,体心室である右心室から血管抵抗の低い肺へのルートでは,乱流の発生により細いconduitの狭窄が急激に進行するのは当然のことであった.その対策としてBT shuntの追加が考えられるが,体血圧の拡張期圧の低下による冠血流量の低下と,本来低圧系の構造である右心室への心室容量負荷による心機能の低下,三尖弁閉鎖不全の増強が危惧される.唯一の解決策としては,体血圧の拡張期圧を低下させずに,また心室に容量負荷をかけることなく肺血流量を増加させることができる両方向性Glenn手術(上大静脈を肺動脈に端側吻合)が最良の方法である.
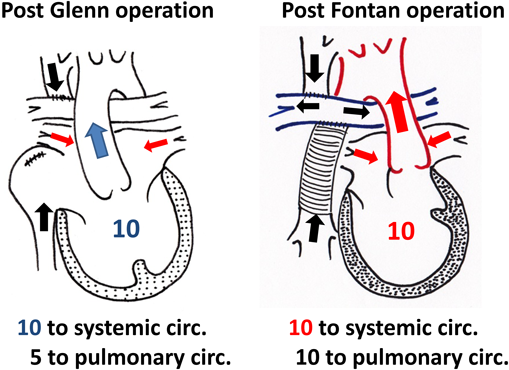
Glenn手術を行うことにより,上半身から還流してきた静脈血が左右肺動脈に流入し,酸素化された血液が肺静脈から心房に流入し,下大静脈に還流してきた下半身の静脈血とともに右心室(体心室)から全身に駆出される.BT shuntなどの付加的な肺血流がない場合,右心室に流入する血液は肺静脈血と下大静脈から還流する血液のみであるので,心室にかかる容量負荷はFontan術後と同じである(Fig. 7).上大静脈より還流する血流と下大静脈から還流する血流が等しく5と仮定すると,Glenn手術後の肺血流量は5,体血流量は10で,Fontan手術後の肺血流量は10,体血流量は10となる.すなわち,Fontan手術を行う前の早い時期に,心室への容量負荷が減少することになる.この血行動態の変化は心房中隔欠損閉鎖術後の右心室のようで,体の成長とともに右室容積は正常化する.
しかしこのGlenn手術は,肺血管抵抗がまだ不安定な乳児期早期に成り立つかどうかの懸念があり,これまで手術は生後6か月以降とする意見が多かった.しかしReddyら13)は生後1~4か月でも良好な成績を報告し,必要なら3か月にGlenn手術を行うことが一般的となり,Fontan手術に向かう症例が一気に増加しHLHSに対する救命率が向上することになった.
ベッドサイドで患者の“声”に耳を傾け,患者が教えてくれることの中に真実の道が見えてくる.30年経って時代は変わったが,これからの若い人たちがこういう気持ちを失わない臨床医として育っていただけるきっかけに本稿がなれば幸いである.
利益相反
本稿について開示すべき利益相反(COI)はありません.
引用文献References
1) 岸本英文,八木原俊克,磯部文隆,ほか:Right isomerism heartに対する外科治療成績の検討.日胸外会誌1989; 37(Suppl): 1785
2) 岸本英文,八木原俊克:1. 先天性心疾患 II-6 術後管理 開心姑息手術,国立循環器病センター心臓血管部門(編),心臓血管外科管理ハンドブック,東京,南江堂1995, pp143–147
3) Norwood WI, Lang P, Casteneda AR, et al: Experience with operations for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 1981; 82: 511–519
4) 岸本英文,八木原俊克,磯部文隆,ほか:Valved pericardial roll(VPR)を用いたexternal conduit手術.日胸外会誌1989; 37: 658–663
5) 岸本英文,飯尾雅彦,久米庸一,ほか:左心低形成症候群に対し右室肺動脈間に弁付き心膜ロールを用いたNorwood手術.日心外会誌1993; 22(Suppl): 272
6) Kishimoto H, Iio M, Kume Y, et al: The Norwood operation for hypoplastic left heart syndrome using a valved pericardial roll between the right ventricle and pulmonary artery. Cardiol Young 1993; 3(Suppl 1): 162, abstract
7) 岸本英文,川田博昭,三浦拓也,ほか:Univentricular repairをめざすstrategy—房室弁逆流,肺静脈閉塞からの検討—.日胸外会誌1998; 46(Suppl): 138–139
8) Imai Y, Kurosawa H, Fujiwara T, et al: Palliative repair of aortic atresia associated with tricuspid atresia and transposition of the great arteries. Ann Thorac Surg 1991; 51: 646–648
9) Kishimoto H, Kawahira Y, Kawata H, et al: The modified Norwood palliation on a beating heart. J Thorac Cardiovasc Surg 1999; 118: 1130–1132
10) 山口眞弘,安井久喬:第37回日本小児外科学会総会 シンポジウムIV 司会総括 左心低形成症候群に対する外科治療戦略.日小外会誌2001; 37: 247–248
11) Imoto Y, Kado H, Shiokawa Y, et al: Experience with the Norwood procedure without circulatory arrest. J Thorac Cardiovasc Surg 2001; 122: 879–882
12) Sano S, Ishino K, Kawada M, et al: Right ventricle-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2003; 126: 504–509
13) Reddy VM, Liddicoat JR, Hanley FL: Primary bidirectional superior cavopulmonary shunt in infants between 1 and 4 months of age. Ann Thorac Surg 1995; 59: 1120–1126