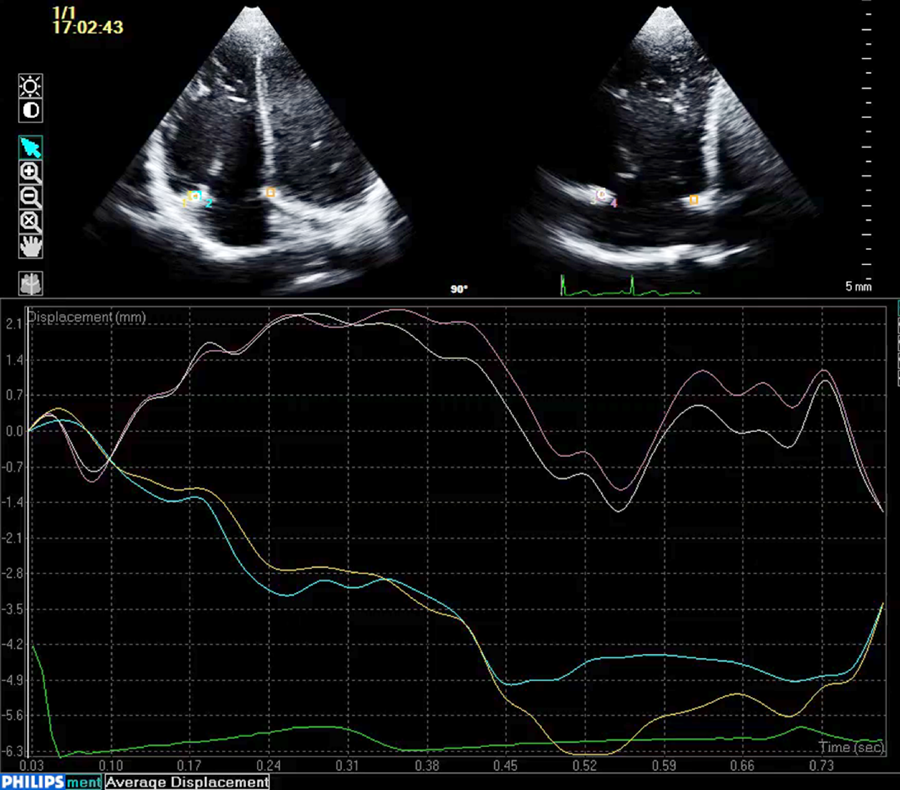
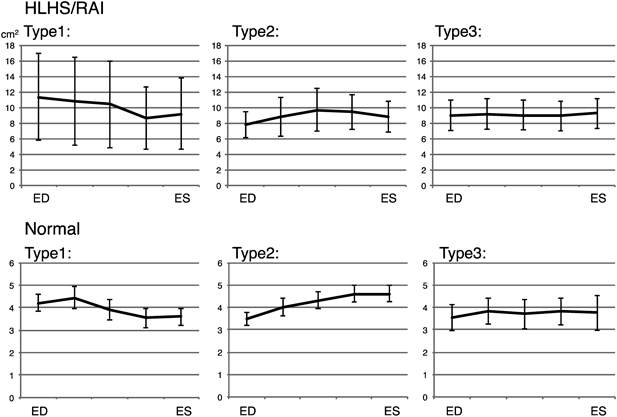
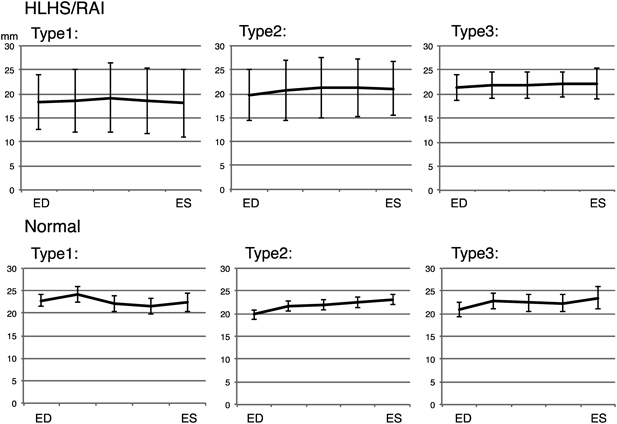
左心低形成症候群と右側心房相同における房室弁輪面積時相変化:弁輪スペックルトラッキングを用いた検討Annular Atrioventricular Valve Area Dynamics in Patients with Hypoplastic Left Heart Syndrome and Right Atrial Isomerism: Insights Using Speckle-Tracking of the Atrioventricular Valve Annulus
1 静岡県立こども病院循環器科Department of Cardiology, Shizuoka Children’s Hospital, Shizuoka, Japan
2 順天堂大学医学部付属順天堂医院小児科思春期科Department of Pediatrics and Adolescent Medicine, Juntendo University Hospital, Tokyo, Japan
3 長野県立こども病院循環器小児科Department of Cardiology, Nagano Children’s Hospital, Nagano, Japan
4 秋田大学医学部付属病院小児科Department of Pediatrics, Akita University Hospital, Akita, Japan
5 中東遠総合医療センター小児科Department of Pediatrics, Chutoen General Medical Center, Shizuoka, Japan
6 聖隷浜松病院小児循環器科Department of Pediatric Cardiology, Seirei Hamamatsu General Hosital, Shizuoka, Japan
7 静岡県立こども病院心臓血管外科Department of Cardiovascular surgery, Shizuoka Children’s Hospital, Shizuoka, Japan