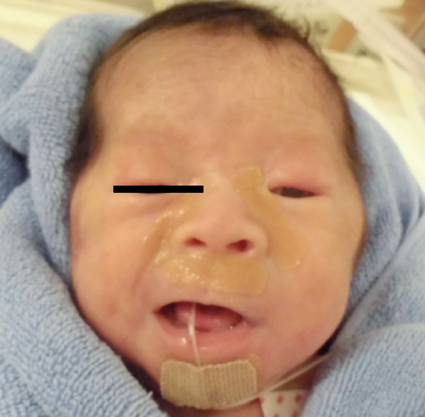
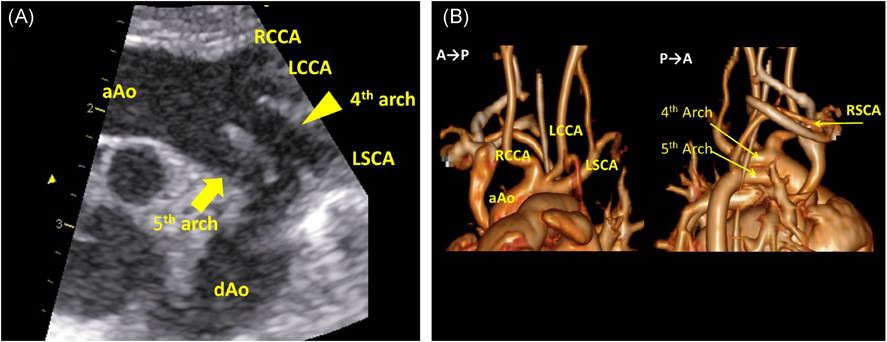
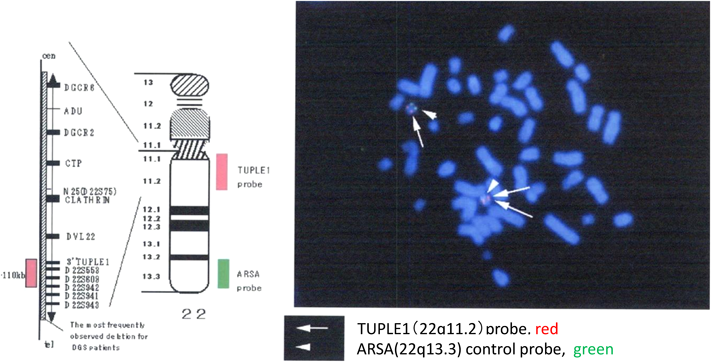
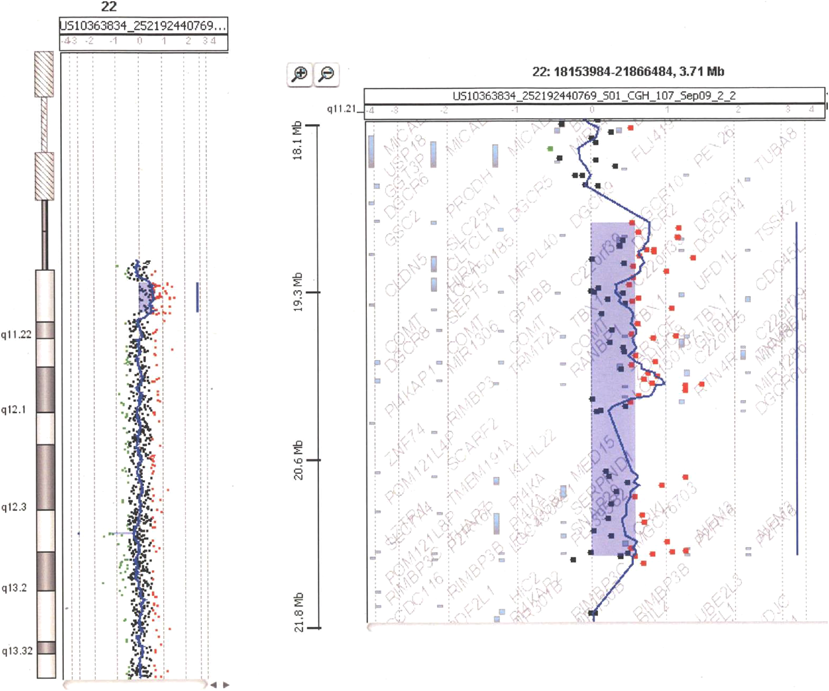
第5大動脈弓遺残を伴った22q11.2重複症候群22q11.2 Duplication Syndrome with Persistent 5th Aortic Arch
1 筑波大学小児科Department of Child Health, University of Tsukuba ◇ Tsukuba, Ibaraki, Japan
2 茨城県立こども病院小児循環器科Department of Pediatric Cardiology, Ibaraki Children’s Hospital ◇ Mito, Ibaraki, Japan
3 筑波大学心臓血管外科Department of Cardiovascular Surgery, University of Tsukuba ◇ Tsukuba, Ibaraki, Japan