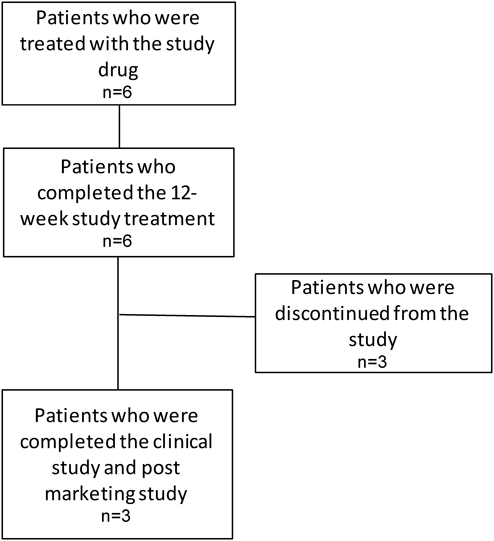
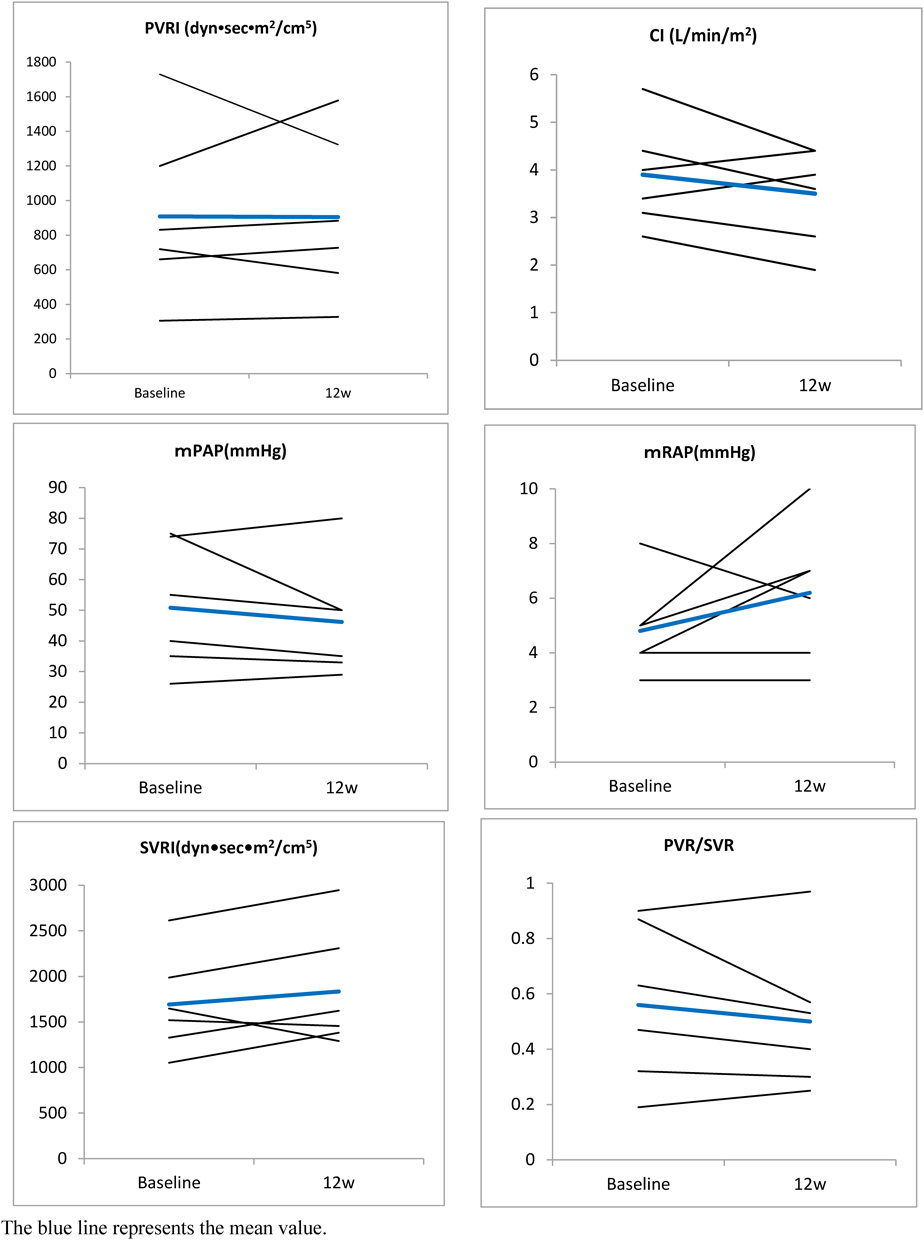
日本人小児肺動脈性肺高血圧症患者に対するボセンタン新規小児用製剤の治験成績:有効性,薬物動態,安全性,及び忍容性の検討Clinical Use of Pediatric Bosentan in Japanese Children with Pulmonary Arterial Hypertension: Investigation of Efficacy, Pharmacokinetics, Safety, and Tolerability
1 東邦大学医学部心血管病研究先端統合講座Advanced and Integrated Cardiovascular Research Course in the Young and Adolescence, Toho University ◇ Tokyo, Japan
2 東京女子医科大学成人先天性心疾患病態学寄附研究部門Pediatric Cardiology, Tokyo Women’s Medical University ◇ Tokyo, Japan
3 国立循環器病研究センター小児循環器科Department of Pediatrics, National Cerebral and Cardiovascular Center ◇ Osaka, Japan
4 東京医科歯科大学大学院医歯学総合研究科小児・周産期地域医療学講座(小児)Department of Pediatrics, Perinatal and Maternal Medicine, Tokyo Medical and Dental University, Graduate School ◇ Tokyo, Japan
5 神奈川県立こども医療センター循環器内科Department of Cardiology, Kanagawa Children's Medical Center ◇ Kanagawa, Japan
6 東京大学小児科Department of Pediatrics, Tokyo University ◇ Tokyo, Japan
7 滋賀医科大学小児科Department of Pediatrics, Shiga University of Medical Science ◇ Shiga, Japan
8 Actelion Pharmaceuticals Ltd.Clinical Pharmacology, Actelion Pharmaceuticals Ltd. ◇ Actelion Pharmaceuticals Ltd., Allschwil, Switzerland
9 アクテリオン ファーマシューティカルズ ジャパン株式会社研究開発本部Research and Development, Actelion Pharmaceuticals Japan Ltd. ◇ Tokyo, Japan
†2017年5月22日逝去.Deceased 22 May 2017.