症例1
症例
4か月女児,体重5.4 kg
診断
右側相同,共通房室弁口,右室性単心室,肺動脈狭窄,右側大動脈弓,動脈管開存
胎児診断症例.県外大学病院より当院へ紹介され,在胎40週に自然経腟分娩,体重3,936 g,APGAR 7点(1分)/8点(5分)で出生した.生後に右側相同,右室性単心室,肺動脈狭窄(弁下,弁性),右側大動脈弓,動脈管開存と確定診断され,日齢24に右modified Blalock–Taussig体肺動脈シャント手術(3.5 mm ePTFE)および肺動脈形成術を施行し,日齢50に在宅酸素0.5 L/分下にSpO2 85%で退院した.
日齢80に前医を定期受診時に,啼泣を契機にチアノーゼ著明となり当院へ緊急搬送された,入院後著明なチアノーゼは改善したが,入院2日目に啼泣後に著明な低酸素血症・徐脈となった.直ちに気管内挿管・心肺蘇生をしたが回復せず,発症25分後に緊急でVA-ECMOを導入した(右頚部より刺入し右房より脱血,下行大動脈へ送血).
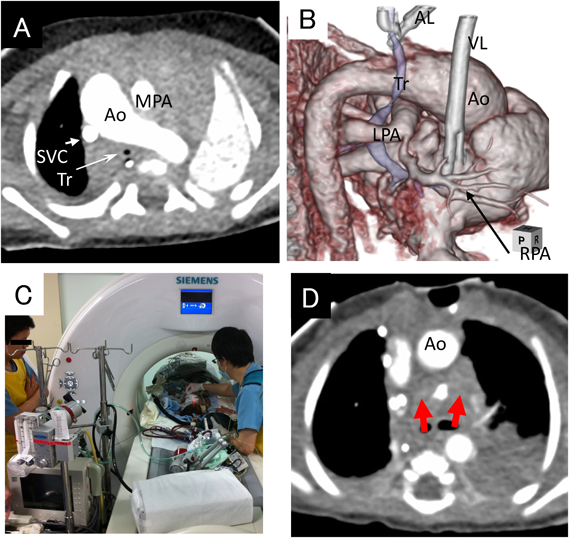
ECMO開始後の経胸壁心エコー検査(以下心エコー)では,心室収縮能は保たれていたが,シャント血管への血流が乏しかった.当初はGlenn手術を考慮したため,ECMO開始の約17時間後に,シャント血管および肺動脈の形態評価のためECMO下に造影CTを施行した.
ECMOの機器はEndumo 2000で,priming volumeは180 mL,検査前の流量は550 mL/分だった.CT検査室への移動に医師3名,看護師2名とECMO操作を担当する臨床工学技士2名が同行した.MDCTはSOMATOM Definition Flash(Siemens AG, Forchheim, Germany)を使用し,撮影方法はレトロスペクティブ法による心電図同期撮影(ECG同期法)を用い,撮影条件はピッチ0.56,管電圧80 kV,管電流70 mAs/rotationとした.撮影時の心拍数150~153 bpm,撮影時間1.82秒で,心電図同期管電流変調を併用し,呼吸停止下に撮影した.撮影中は3名が検査室内で呼吸とECMOの補助を行った.CT撮影中はECMOの流量は変更せず,造影剤はイオパミドール370 mgI/mLを生食で2倍希釈し,25 mL(5 mL/kg,原液では2.5 mL/kg)を下肢末梢静脈より1.0 mL/秒で注入し注入開始27秒後に撮影を開始した.
造影所見では肺動脈分岐部は著しく狭窄し,その部分に吻合したシャント血管は閉塞しかかっていた.肺動脈の形態と内径から,Glenn手術も可能と考えられたが(Fig. 1),同時に撮影した頭部CTで軽度の脳浮腫が認められたため,同手術は施行せず.日齢82にシャント交換手術(4.0 mm ePTFE)および肺動脈形成術を施行した.手術後は順調にECMOを離脱できた.
症例2
症例
1か月女児,体重3 kg
診断
- (1)共通房室弁口,右室性単心室,肺動脈弁下狭窄,両側上大静脈,肺動脈スリング,右肺動脈低形成
- (2)気管低形成
在胎40週,2,384 g,自然経腟分娩にて出生.APGAR 8点(1分)/8点(5分)であったが,チアノーゼが持続するため県外のNICUに入院し,心エコーとCT検査で上記の診断に至った.気道狭窄症状はないため日齢40に退院した.しかし日齢42に自宅で呼吸不全となり,前医へ緊急入院した.気管内挿管されたが,換気不良で呼吸循環動態が維持できなかった.当初は呼吸不全の原因である気管低形成に対して外科的治療を要する状態であると判断され,他院小児外科へ紹介搬送となった.移動中に進行性に換気不全・徐脈となり,途中に位置していた当院へ急遽転送された.当院に到着後直ちにVA-ECMOを導入した(両側頚部を切開し左内頸静脈より脱血,右総頚動脈より送血).急に増悪した呼吸不全の要因として,気管低形成と肺動脈スリングだけでなく,大動脈弓の走行位置の影響や肺病変の有無も検討されたため,ECMO開始約12時間後に造影CT検査を施行した.
使用機器はいずれも症例1と同様で,検査前のECMO流量は450 mL/分だった.移動には医師3名,看護師2名,ECMO操作を行う臨床工学技士が2名同行した.CT検査は,症例1と同様にECG同期法を用い心電図同期管電流変調を併用して,ピッチ0.38,管電圧80 kV,管電流62 mAs/rotationで呼吸停止下に撮影した.撮影時の心拍数92~94 bpmで,撮影時間は2.2秒だった.撮影中は3名が検査室内で呼吸とECMOの補助を行った.CT撮影中はECMO流量は変更せず,造影剤はイオパミドール370 mgI/mLを生食で2倍希釈し12 mL(4 mL/kg,原液では2 mL/kg)を下大静脈に留置した中心静脈カテーテルより0.7 mL/秒で注入し,注入開始15秒後に撮影を開始した.
CT画像からは広範囲な気管低形成が認められた.当初転院予定だった他院小児外科と協議の結果,肺動脈スリングと大動脈弓による圧排が増悪因子となっており(Fig. 2A, B),気管形成のみでは今回の呼吸循環不全からの回復は困難であると考えられ,日齢43に肺動脈スリング解除術および上行大動脈吊り上げ術を施行し,引き続いて,日齢46に気管形成術を施行した.術後の気管支ファイバーにて気道狭窄はなく,人工呼吸器の1回換気量は改善したがECMOを離脱できなかった.術後4日目に開胸洗浄を行った際に主肺動脈に血栓を認め,血栓除去術を施行した.その際に末梢肺動脈から血液の逆流がなかったため,さらに遠位に血栓が及んでいる可能性が示唆された.術後5日目に肺動脈の評価目的に再度造影CT検査を施行した(Fig. 2C).
ECMOの条件および移動手段は前回と同様で,CT検査も同様に心電図同期管電流変調を併用したECG同期法を用い,ピッチ0.46(撮影中心拍数114~115 bpm),管電圧70 kV,管電流130 mAs/rotationで呼吸停止下に撮影した.造影剤も前回と同様に2倍希釈したもの15 mL(7.5 mL/kg,原液で2.5 mL/kg)を0.5 mL/秒で下肢末梢静脈から注入し,注入開始25秒後に撮影を開始した.CT所見では,左右肺動脈幹の造影は乏しいが両側の末梢肺動脈は造影され,末梢肺動脈は開存していると判断し,シャント手術による肺血流の確保を考慮した(Fig. 2D).気管形成術後であり,人工物使用を避けるために,同日に左original Blalock–Taussig shunt手術を実施した.また術後7日にさらに右original Blalock–Taussig shunt手術を追加した.その後患児の状態は改善し,術後17日目(日齢63)にECMOから離脱した.術後経過も順調であり,現在Glenn手術を待機している.
症例3
症例
5歳男児,体重14 kg
診断
- (1)修正大血管転位症,心室中隔欠損症(膜性部型),肺動脈弁狭窄経皮的肺動脈形成術後,ダブル・スイッチ手術後
- (2)右横隔神経麻痺
- (3)間質性肺炎
- (4)肺出血
生後2か月時にバルーン心房中隔裂開術(BAS)を施行し,3歳時に軽度の左室流出路狭窄に対して経皮的肺動脈形成術を施行した.BAS後から僧帽弁逆流が中等度認められていた.
5歳時にダブル・スイッチ手術(Senning手術+Rastelli手術),Damus–Kaye–Stansel手術,僧帽弁形成術を施行した.術後1日目に抜管したが,術後3日目に右上葉の無気肺を契機に呼吸状態が悪化し,再挿管となった.術後6日目に抜管したが右横隔神経麻痺が判明し,非侵襲的陽圧換気(NPPV)を導入した.呼吸状態悪化を来し術後10日に再挿管し,術後11日に右横隔膜縫縮術を施行した.術後19日に抜管したが,気管内分泌が多く呼吸状態も不安定であり再びNPPVを継続した.術後25日目より高流量経鼻酸素吸入を導入した.
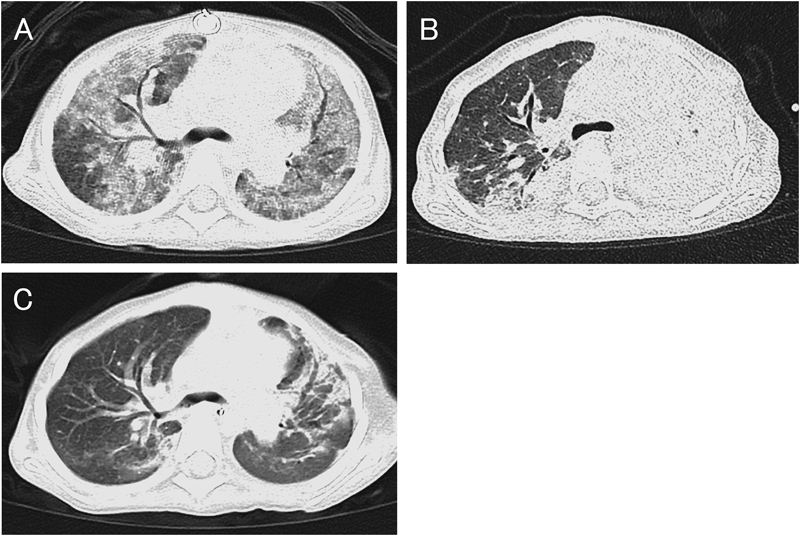
術後28日目頃より間質性肺炎を発症し増悪した.術後43日のCT検査では,両側肺野にスリガラス状陰影を認め(Fig. 3A),ステロイドパルス療法を行ったが改善なく,NPPVを再度導入したが呼吸不全が進行した.術後45日に再挿管し人工呼吸器管理となるがさらに増悪し,術後46日にECMOを導入となった.術後48日には左肺に肺出血をきたし保存的に加療し止血を待った.術後62日にフォローアップ目的でECMO下の胸部単純CT検査を施行した.検査室への移動には医師2名,看護師2名,臨床工学技士が2名同行した.CT検査はFlash Spiral法を用い,ピッチ1.0として呼吸停止下に撮影した.スリガラス陰影の改善傾向(Fig. 3B)および気管内からの新鮮血の消失を確認し,術後64日にECMOを離脱した.以後も理学療法を継続し,肺野の異常陰影はやや残存するも,術後69日に無気肺は大幅に改善した(Fig. 3C).
今回経験した3症例は,いずれもECMO装着下においてCT検査を安全に実施することができ,治療方針の決定に大きな役割を果たした.症例1では,神経学的予後を考慮して治療介入方法を決定することができた.症例2では気道および大血管の立体走行の把握に有用であった.症例3もECMO離脱の判断の目安となった.特に症例1,2は心エコーによるアプローチに制限があったため,造影CT検査により速やかに状態の把握が可能であった.心臓カテーテル検査も検討されたがより低侵襲かつ短時間に検査可能である点からCT検査を選択した.
ECMO下にCT検査を行う際に問題となるのは,安全性と検査プロトコールである.安野らはECMO管理下でのCT撮影において,移動時のチューブ,回路,バッテリートラブルへの対策が不可欠であると述べ6),またExtracorporeal Life Support Organization(ELSO)guidelineでは,移動の準備と移動中の注意点を具体的に次のように述べている.ECMOのバッテリーを確認,手回し用クランクを準備し,満たんにした小型の酸素ボンベをスウィープガス用に準備する.患者をベッドから移す前には,電源をバッテリーに切り替え,酸素はポータブル酸素ボンベにつなぎ,モニターもポータブルに代える.持続注入薬剤は最小限とし,アンビューバッグ,酸素ボンベ,非常用薬剤の携行など準備を整える.その上で移送計画を練り,エレベーターを止め,廊下を片付け,移送先の準備が整っていることを確認して移動する.患者と装置を動かす際には,1名は片手をストレッチャーに,もう一方の手を装置にかけ,チューブが引っ張られないようにする7).これらから,ECMO管理でのCT検査には多くの細かい配慮が必要かつ,作業には臨床工学技士・看護師など複数の専門職種の協力が必要となる.今回の我々の症例では,移動には医師2~3名,看護師2名,臨床工学技士2名が同行し,CT撮影時は3名が検査室内で補助し,トラブルなく検査を遂行できた.
次に,ECMO下のCT検査の際に特に問題となるのは造影方法であり,通常と異なる血行動態を加味しなければならない.ECMO下にCTを行うにあたり,Kaoらは,ECMO(VA-ECMO)下での造影CT検査では造影剤の希釈を防ぐために膜型人工肺の静脈カニューラより末梢側の中心静脈ラインから注入し,造影直後にECMO流量を一時的に減速するとしている.ECMO管理の患者は通常末梢循環不全であるため,末梢静脈からの造影は動脈虚血や静脈うっ血を来す危険性があり,明瞭な画像も得られず推奨されないとしている5).しかしこれらは成人かつ正常構造の心臓における報告例である.小児先天性心疾患に関する報告としては,Friedmanらの報告があり,生後1か月の総肺静脈還流異常の児に対しECMO下に造影CTを施行した際に,2 mL/kgの造影剤を手押し静注にて末梢静脈ルートから投与し,撮影中はECMO補助条件を25%まで下げて検査を行うことにより,良好な画像を得たとしている8).
今回,我々の症例1, 2の造影に際しては,造影剤量を通常よりも増量し,bolus tracking法により上行大動脈や肺動脈への造影剤の流入を確認して撮影を開始した.いずれもECMO流量は調節せずに撮影を行ったが,治療方針の決定に必要な画像を取得できた.しかし,症例2の1回目の検査ではECMOを経由した血流の造影効果の不均等により,送血管が刺入された大動脈弓部以遠の造影効果が弱く不均一であった.ECMO流量を変更しない場合には,造影剤注入時間と撮影開始のタイミングには注意が必要と思われた.また同症例の2回目の検査では造影効果を上げるため70 kVまで管電圧を低下したことで肺動脈を描出できた可能性があり,ECMO流量の調整以外に,管電圧も留意するべきと思われた.
CT検査を行うに際し,被ばくにも注意が必要である.米国小児放射線学会のExecutive Summary(Conference of ALARA(as low as reasonably achieved))によると,小児のCT撮影では,診断に必要な画質レベルを満たした上で,線量を最小限にすることが重要とある9, 10).実際,乳幼児のCT検査では,管電圧を80 kVまで減圧し,管電流も体重に応じて調節することが望ましい11, 12).今回我々は,重症例であり鮮明な画像が必要であること,低被ばくであるFlash Spiral法は検査台の移動速度が速く危険も起こりうることを考慮し,造影を行った症例1,2ではECG同期撮影法とした.被ばく低減のため,管電圧の選択,管電流の調整,心電図同期管電流変調の併用を積極的に行った.症例3においては,単純CTであり造影の工夫は不要であったが,自発呼吸下のためFlash Spiral法を用いた.検査台の移動速度を考慮して通常よりもpitchを小さくし,検査は安全に施行でき,鮮明な画像を得た.被ばくを考慮し,症例ごとに適した撮影方法の選択が肝要である.
ECMO管理下にCTを遂行するにあたっては,設備や人員確保の点に限界がある.今回経験した3症例では,複数の臨床工学技士や心臓血管外科医,撮影や読影のために児の病態を理解した放射線科医の協力が不可欠であった.CT機器もECMOと多数の人員があったが撮影には支障なかった.しかし現状では,どの施設でも複数の専門職が確保できるとは言えず,設備上の問題からもECMO下のCT検査が可能な施設は限られる.今後は,小児循環器領域においてもECMO下CT検査は増加すると思われる.症例の蓄積により検査のプロトコールを確立するとともに,各々の分野の専門医師の確保,教育が必要と考える.また,普段から移動のためのベッドや蘇生道具,緊急薬品の点検・マニュアルの作成・シミュレーション,スタッフ間の意思の疎通などを十分に行い,必要時に安全に施行できるように備えることが大切である.