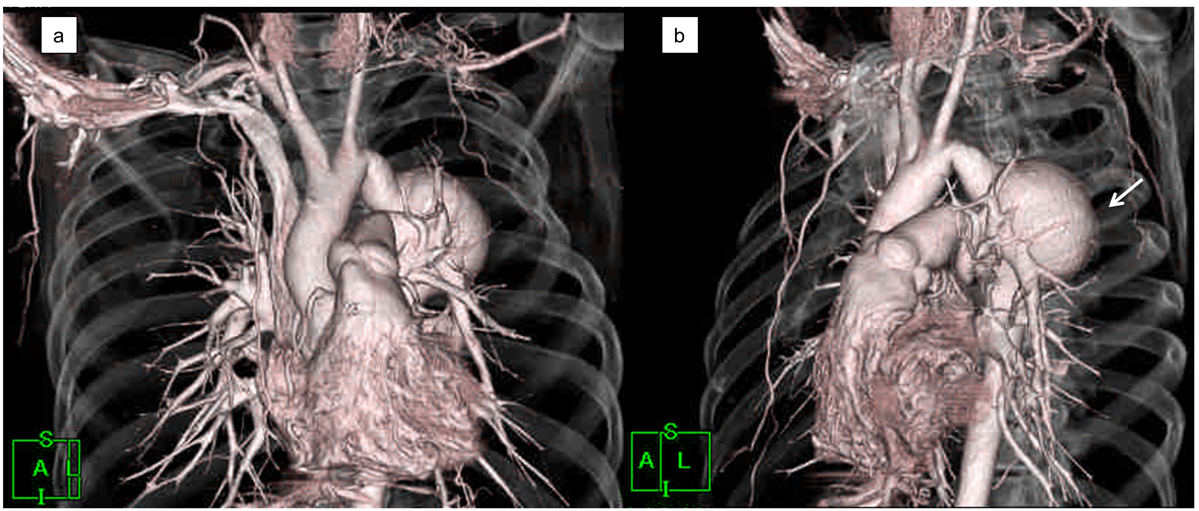
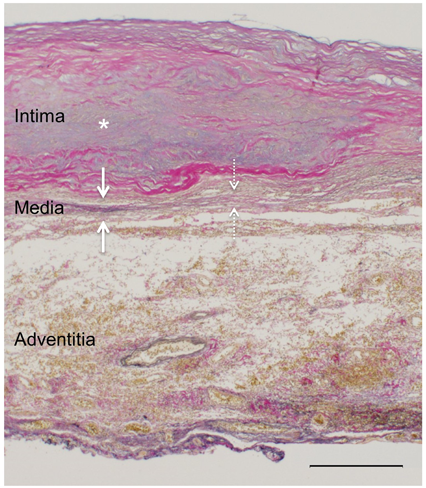
大動脈弓離断症術後遠隔期に発生した胸部大動脈瘤の一例A Case of Thoracic Aortic Aneurysm Years after Repair of Interrupted Aortic Arch
1 独立行政法人地域医療機能推進機構九州病院心臓血管外科Department of Cardiovascular Surgery, Japan Community Health Care Organization Kyushu Hospital ◇ Fukuoka, Japan
2 独立行政法人地域医療機能推進機構九州病院小児循環器科Department of Pediatric Cardiology, Japan Community Health Care Organization Kyushu Hospital ◇ Fukuoka, Japan