近年のコンピュータ技術やIT技術の進歩は目覚ましく,情報処理や画像処理はこの数十年で飛躍的に進歩しているが,この進歩が循環器診療での診断や治療の在り方にも少なからず影響を与えつつあると言っても過言ではない.従来より用いられてきた白黒静止画での画像診断では,心室のサイズや血管の狭窄率などといった,主に心臓や血管の形態に立脚して判断してきたが,フルカラーでの3次元の動画をスムーズに扱うことが珍しくなくなった今日,形態のみならず心臓の機能に関する情報までも,患者さんやその家族にもわかりやすい形で病状を画像で説明できるようになりつつある.『血流解析』というのは画像をもとに心臓血管の内腔での血流情報を可視化し,病態生理を詳細に把握したり治療方針を考慮したりする上で必要な情報を引き出す技術であるが,血液の流れを記述するために流れの物理学である流体力学と循環器画像診断との融合領域の中で生まれた学問である1).心臓の生理学を力学的にあるいは流体力学的にとらえようとする学問は決して今日に始まったものではなく,1980年代にはすでに存在していたが2),当時はどちらかと言うと血流のエネルギーの損失や血管内皮への壁ずり応力(WSS: Wall Shear Stress)などが概念的に記載されていたにすぎず3),これらを実際に可視化して実測できるようにするためにはこの20年間でのIT技術の後押しが必要であった1).
血流解析は循環器生理学の詳細を明かす手法であり,例えば動脈硬化疾患において,異常なずり応力が血管内皮の変性を及ぼすように,血流解析は病態生理を新しい視点でとらえられるかもしれないという期待をもたらし,どちらかと言うとその位置づけは循環器医学の中では基礎医学的な側面を有してきた1).一方で循環生理をあるいは病態生理を詳細にとらえ,複雑な解剖学の中で次の一手をどう決めるかを考えることを余儀なくされている先天性心疾患では,血流解析は患者の生命予後を決めうる重要な位置づけとして古くから実践上の大きな期待を担ってきた.事実,今日では冠動脈での虚血診断に広く適用されているコンピュータに基づく流体シミュレーション(CFD: Computational Fluid Dynamics)が循環器疾患に歴史上初めて本格的に適用されたのはFontan手術術式に関してAtriopulmonary connection(APC)FontanとTotal cavopulmonary connection(TCPC)との血行動態の違いの検討の課題であった4).血流解析技術が格段に進歩し,幅広いモダリティが利用できるようになった今日,また先天性心疾患での患者管理が向上し,手術成績が向上してきた今日,血流解析手法は先天性心疾患に対して新たな役割を担い始めていると考えられる.本稿では今日普及しつつある血流解析手法を網羅的に説明し,先天性心疾患遠隔期予後を向上させるためにどのような使い方が考えられるのかを議論する.
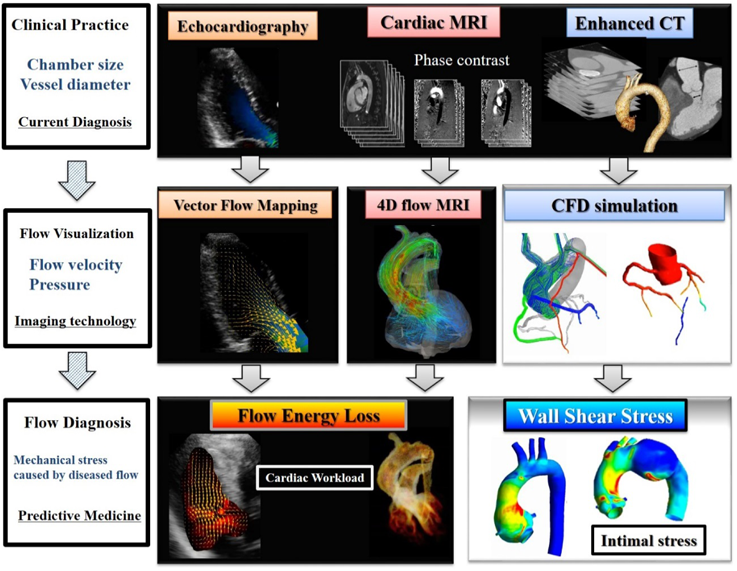
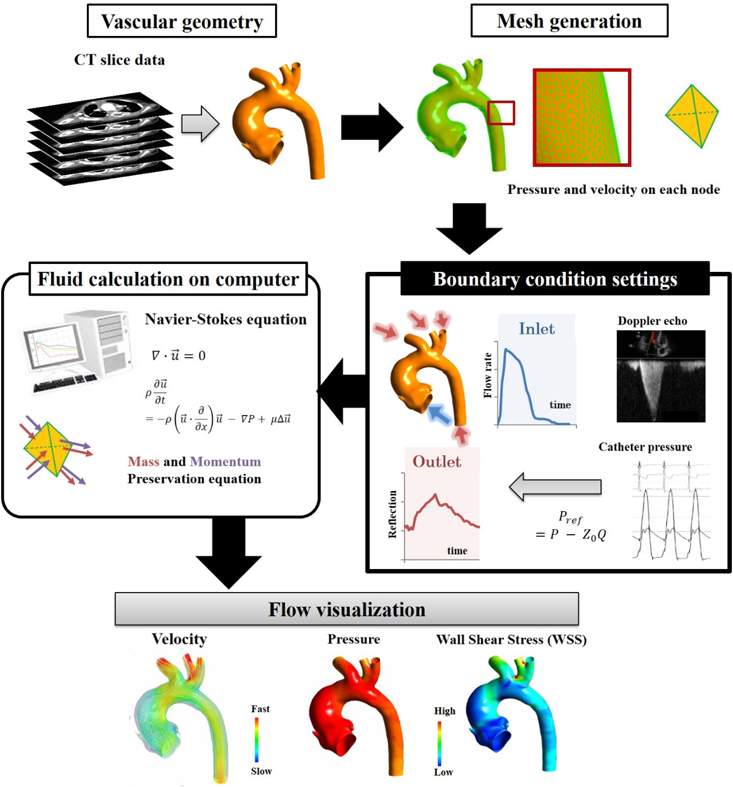
血流解析を含む画像診断の新技術を臨床応用する際に最も重要なことの一つは言うまでもなく再現性であり,血流解析技術が特殊な機械や装置に依存することは再現性の上で不利になりうる.今日では各装置メーカーや画像ワークステーションメーカーが競い合うように解析ソフトウェアを開発したり,クラウドベースの受託解析サービスを始めたりしており,普及に向かう産業の動きがある.我々は特に通常の保険診療で用いられる医療画像データのみからで解析を行うことを心掛けている.我々が構築してきた解析システムの概要をFig. 1に示す.
血流という物理現象を画像上で表現するためには画像情報を基に,物理法則に基づいて何かしらの演算処理をする必要がある.流体力学の考え方では,流れという物理現象を把握するためには,任意の時間での血流の速度と圧力の分布がわかることが必要だとされるが5),速度は大きさと向きを持つためベクトル量であり,圧力は血圧であるが,スカラー量である.流体力学では血液のような液体(非圧縮流体という)においては流量の保存則と運動量の保存則が適用される5).流量の保存則は空間の各微小領域で という方程式になるが,いずれにしてもこれは一次元の方程式である.流入,流出量は基本的には速度×(微小)断面積で算出されるためこれらは速度に関する方程式である.一方で運動量の保存則は力学の基礎方程式である, という関係式を各微小領域の流体に適用される計算式になるが,流体にとっての質量は単位体積当たりの質量,すなわち血液密度に相当する.一方加速度は血流速度の時間微分である.流体にかかる力は旋回に伴う力,圧較差,そして粘性に伴う摩擦力,その他重力などの外力である. これらは力の釣り合いの式であり,本質的にベクトルに関する3次元の恒等式である.この式をNavier–Stokes方程式という.血液物性値としては密度と粘性係数の物性値があれば成立する方程式である.上述のように速度ベクトル3成分と血圧スカラー量1成分の4つの未知数を支配する法則が,流量保存による1本の方程式と空間3方向での運動方程式(Navier–Stokes方程式)による3本の方程式で支配されるため数学的には必要十分である.しかしながら実際には粘性摩擦項が二回微分を含み,旋回力の項が非線形な構造を有し,未知数の一つである圧力が圧較差の項でのみ出現し極めて複雑な数学的な構造を有しており,古典的な微分方程式の解法では容易には答えのでない方程式であり,現在においてもNavier–Stokes方程式の解の性質については数学上の未解決問題の一つとされている6).
方程式は複雑であっても流れの計測そのものは可能なことがある.血流解析ではせめて速度の分布だけでもわかれば心臓の中の渦流や血管内での異常血流をとらえられるというモチベーションでなされているが,現在では2種類の血流解析手法がある.一つは超音波やMRIなどの血流計測画像に基づく血流解析,そしてもう一つはシミュレーションに基づく血流解析である(Table 1).計測画像に基づく血流解析としては代表的なものは,心臓MRIでの位相コントラストMRIにもとづく血流解析である.MRI位相コントラスト法では任意の磁場の方向でのプロトンの歳差運動の位相差が水分子の運動速度に比例するという原理に基づき,任意の方向での水の流れの速度分布を得ることができる7).これを多断層で前後・左右・上下の3方向の磁場で行えば,ベクトルとしての速度場を3次元的に時間的な変動を含め求めることができる.これを3D cine phase contrast MRIまたは4D flow MRIという.この方法では血流速度をベクトルとして任意の時間と空間で求めることができるが,血圧の情報は存在しない.
Table 1 Blood flow imaging modalities | Flow measurement | Numerical simulation |
|---|
| Phase-contrast MRI | Echocardiography | Computational fluid dynamics (CFD) |
|---|
| Characteristics | Velocity measurement from phase-contrast images | Color Doppler+numerical model | Computational calculation of the 3D Navier–Stokes equation |
| Dimension | 3D | 2D | 3D |
| Hemodynamics | Flow velocity vector | Flow velocity vector | Pressure and velocity vector |
| Temporal resolution | 10~30 frame/s | 20~40 frame/s | No limitation |
| Spatial resolution | 1.0~3.5 mm/pixel | 0.2~0.4 mm/pixel | Up to the limit of computer memory |
| Limit of velocity measurement | 3.0~5.0 m/s | 0.6~1.2 m/s | No upper limit |
| Time cost for analysis | Several minutes to hours | Several seconds to minutes | Several hours to days |
| Advantage | Full volume measurement | Easy to measure | Virtual surgery |
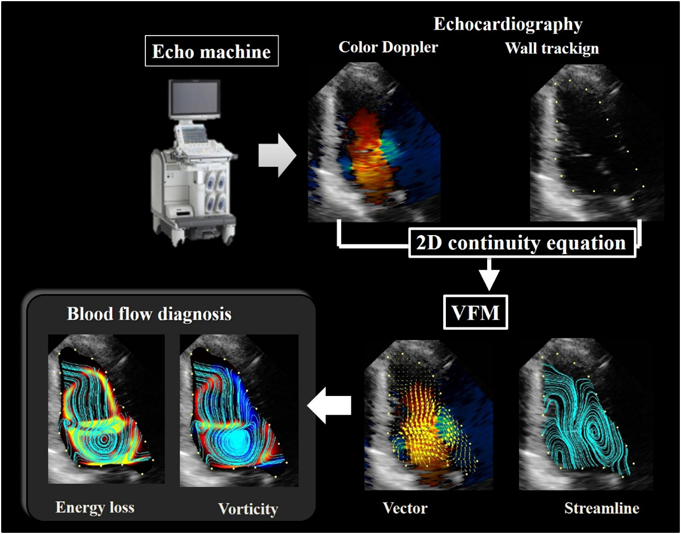
心臓超音波では近年VFM(Vector Flow Mapping)などの血流可視化ソフトウェアが台頭しつつある8).例えばVFMはカラードプラ情報にビームラインに直行する方向の速度ベクトルは局所での流量保存(連続の式)を仮定することで壁面の血流の移動速度を壁のspeckle trackingから算出する方法であるが9),この方法では任意の時間と計測断面上でのtrackingで囲まれた範囲内での血流速度をベクトルとして算出することが可能となるが,やはり血圧情報は存在しないことに留意しなくてはならない.4D flow MRIやVFMなどの速度ベクトル情報をもとに上述の運動量の方程式を積分して血圧を求めようとする研究成果も存在はするが,上述の方程式で現れる血流の加速度を算出するに際し,現状のMRIや超音波でのframe rateがあまりにも低く,血流加速度による寄与を過小評価し,渦流や旋回流を過度に強調したような圧力分布が得られる傾向にあることに留意を要する.さらに圧力の基準のない相対圧の情報であることにも留意されたい.つまり,空間のどこかに基準圧力(静水圧)の情報が必要となる.
もう一つのシミュレーションに基づく血流解析では上述のコンピュータを用いた流体シミュレーションCFDを用いて患者の医用画像での血管形状の出入口にそれらしい圧力(血圧)や速度(流量)などの情報を入力してNavier–Stokesをコンピュータで近似的に解くことにより血流を計算する方法である.この方法では流速に加え血圧の情報も得られるが,実測ではなく計算値に基づいているため計算の過程が大きく結果に影響するという弱点があることに留意が必要である.つまり,例えば心不全患者で健常人と同じ血流量を仮定して計算した場合には狭窄病変での圧較差などがずいぶん大きな値として計算されることになり,実測とは異なる値になってしまうことが十分にありうる.一方でCG(Computer Graphics)と組み合わせることで自由や血管形状や自由な生理学的な条件でシミュレーションをすることが可能であり,あたかも仮想手術のようなことが可能になることが利点の一つである9).
血流解析はその方法の開発のために流体力学や画像処理の専門知識を要するため欧米などの先進諸外国においては大学工学部や企業の開発者などのエンジニア主導で行われてきた.現在もなお発展途上である本手法には技術者による多大なる貢献を必要とすることは紛れのない事実であるが,美しいカラー動画を表示するだけでは研究業績を残すことは可能であっても,循環器診療を前進させる力としては不十分である.実際には,血流解析で得られる血流速度と血圧情報の情報は従来の画像診断やその他の検査では通常得られない情報であるが,その詳細な情報から疾患の治療方針を決定することの間には若干のギャップがあり,医療者・医学者と工学者・技術者との真摯でかつ密接な議論が必要となる作業である1).
このギャップを埋める方法の一つとして,我々は循環器疾患において発生する異常血流がもたらす力学的なストレスを定量化することを提唱している(Fig. 1).壁ずり応力WSSが血管内皮に及ぼす影響やその分子的なメカニズムに関しては,すでに多くの基礎実験データが発表されている10–13).WSSは壁面近傍の血流がどの程度強く壁を水平方向にこするかという指標であるが,血管壁近傍の血流の速度分布から壁の水平方向の速度の変化率から計算される.そのため壁面近傍での詳細な血流速度の情報が必要である.また,WSSは基本的にはベクトル量であり,大きさのほかに向きを持つ.近年の動脈硬化疾患に関する動物実験のEvidenceから低すぎるWSSは動脈硬化を進展させる作用があることが知られており11, 13),臨床上の実証も得られている14).一方でプラークなどをあまりに強くこするWSSが発生するとプラークが破たんすることが知られ12),程よいWSSが血管内皮を保つうえで必要であると考えられる.上述のようにWSSはベクトルであることからこする向きも重要であることが知られている10).一心拍の中でWSSの向きが大きく変動すると血管内皮細胞から活性酸素が出やすいことが知られる10).WSSに関する血管内皮の変性は動脈硬化疾患での知見が大半であるが,小児領域においても血管内皮の繊維瘢痕の増生など先天性心疾患の予後にかかわる病態との議論は存在する15).
また,血流のエネルギー損失は乱流に伴い発生する圧損であるが,これを非侵襲画像から可視化することを我々は提唱してきた(Fig. 1)1, 8, 16, 17).血流のエネルギー損失は従来,狭窄などの圧力損失で規定されてきた2).ここでの圧力損失は全圧の損失である.全圧とは, であるが,これは流れのエネルギー準位に相当し,静圧がポテンシャルエネルギー準位であり,動圧が運動エネルギー準位である.エネルギー損失は, として概念化されてきた.血圧と血流速度の同時計測が必要であるためこのエネルギー損失は特殊な装置を用いない限り臨床上で容易には計測は困難であった18).しかしながら圧力と流速の両方の情報が入手できる血流シミュレーションでは算出可能であり,特にFontan手術の術式の是非をめぐってシミュレーション上のエネルギー損失が繰り返し議論されてきた4, 19–23).Garciaらはこの概念を簡易に導出し,大動脈弁狭窄症などで有効弁口面積をエネルギー損失の概念で補正するような数式を提案し24),大動脈断面積を用いることで超音波でも簡易にエネルギー損失の代用品が求められる簡易式であるELCo(Energy Loss Coefficient)を提唱した.その後大動脈弁狭窄症においては圧較差が同等であってもELCoが生命予後にかかわっているというエビデンスが出され25),さらには弁置換後の心筋のmass regressionも人工弁の有効弁口面積ではなくELCoがかかわっているというエビデンスすら出されるようになり26),今日では心臓超音波の専門家たちの間では日常診療で用いる指標となっている.しかしながらこのELCoが提案されるよりも以前からFontan循環でのエネルギー損失が議論され,TCPCの術式が提唱されてから間もなくその合理性が立証されてきた19)ことは,先天性心疾患においてこの手の心負荷指標がいかに切望されてきていたかを物語っており,注目に値する.
しかしながらシミュレーション上のみでのエネルギー損失や大動脈弁狭窄症でのみ適用されるエネルギー損失では複雑な血行動態を呈する先天性心疾患での心負荷を計測することは困難である.そこで我々は超音波やMRIなどの無侵襲画像から得られた血流情報から粘性摩擦に伴う散逸項を計算し,これが生理的な拍動血流においては従来のエネルギー損失と数学的に同地であることを立証した1, 16).この方法により手軽に病的な血流がもたらす心負荷を定量することが可能になった8, 27).この方法は現在,心筋症28),心臓弁膜症29),不整脈30),先天性心疾患31, 32)と幅広い疾患で適用され,今後のエビデンスが待たれている.
WSSにしてもエネルギー損失にしてもこれら力学的な負荷を定量する指標は「現状の血管狭窄,動脈硬化」でもなく「現状の心機能」でもなく,「今後血管内皮を硬化させていくリスク因子や元凶」であったり「今後心機能を悪化させうる心負荷」であったりする指標である.その意味でこれらの血流指標は予後予測の指標ともいえる1, 27).血流解析は「現状診断」から「予測診断」へと診療を質的に変革しうる可能性があると我々は考えている.
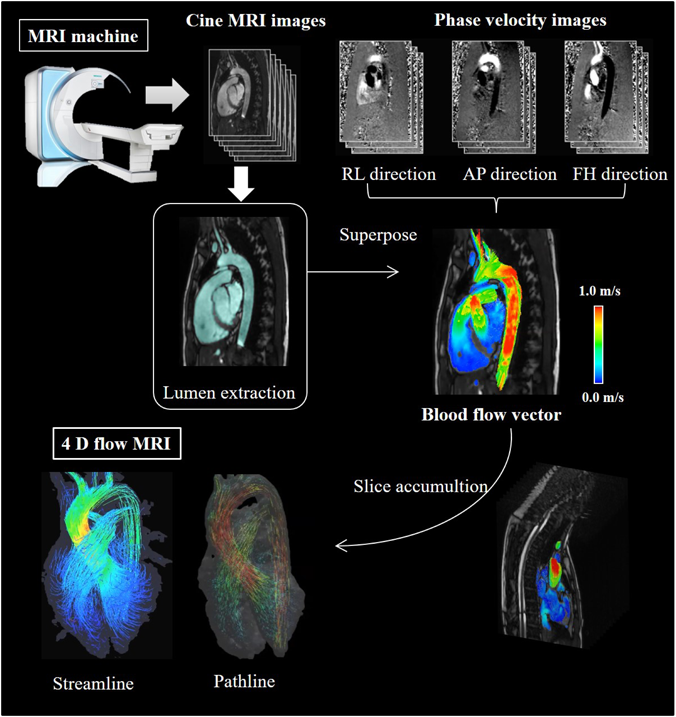
血流計測の代表的な手法は位相コントラストMRI(PC-MRI: Phase Contrast MRI)による血流計測,およびこれらを重ね合わせることにより血流をベクトル表示した可視化である.位相コントラスト法は上述のように任意の傾斜磁場方向でのプロトンの歳差運動位相差から計測される水分子移動速度の分布を画像で得る方法であり7),断面での流量を計算するなどに用いられてきた方法であるが,位相情報であるため,コントラストが不鮮明であり,肺内などの空気中のプロトンの位相などはほぼランダムな位相に近くノイズの多い白黒画像になる(Fig. 2).また位相が360度を超えると白黒反転してしまい,計測速度限界を超えた血流速度は反対向き方向に折れかえることが知られる.PC-MRIにおける計測速度限界をVenc(velocity encoding)という.位相コントラストMRIそのものは決して新しい計測方法ではなく,一般診療用の装置でも充分可能な計測法であるが,3方向で位相を計測し,多断面で積層し,3次元の血流動画として表現した4D flow MRIは画像処理の工程が複雑であり(Fig. 2),近年になってようやく商用のソフトウェアがリサーチツールとして販売され始めたところであり,心拍変動の追随の有無33)や造影剤を必要とするか否かなど28),解析ソフトウェアによって特徴が大きく異なる.
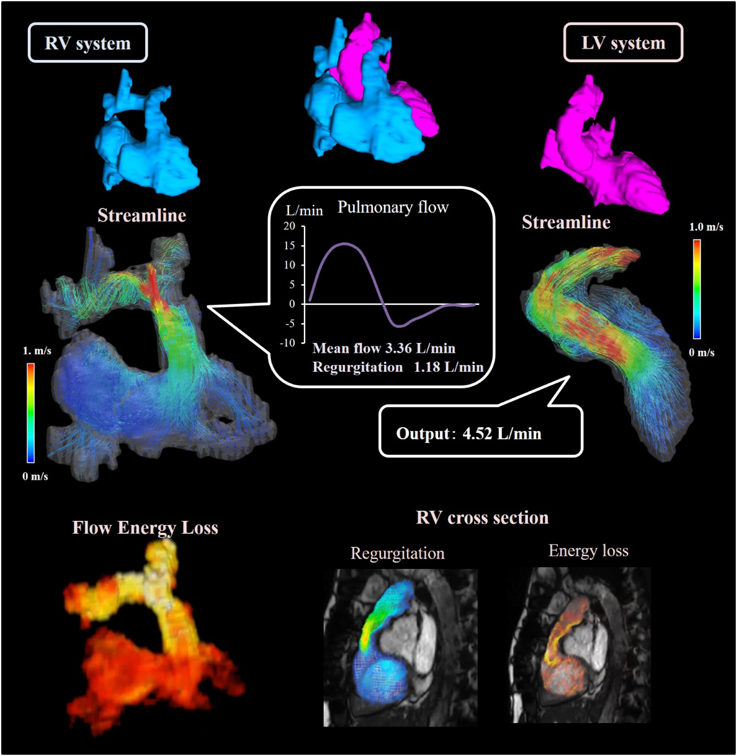
MRIの強みは超音波が到達しにくい部位では大きな力を発揮する.先天性心疾患の領域ではFontan吻合での血流の衝突や渦流などを観察するような研究や33, 34),大動脈縮窄やその術後を評価する研究などがこれまで多数報告されてきた35, 36).一方MRIの強みは右室容量などの右室を計測できることである.右室内では長軸断面内に大きな渦流が発生する左室と比べ,短軸断面内にあたかも自由壁を拡張させるかのような特有の渦流が発生していることが知られているが37),先天性心疾患ではファロー四徴症のように遠隔期,成人期にも右心系に異常をきたす疾患も多く,こういった疾患での4D flow MRIの知見に今後期待されている38).我々はFig. 3のように純系肺動脈閉鎖症に対してBlock手術後にOne and one half repairを行った極めて運動対応能の良い成人期の症例を4D flow MRIで評価した.4D flow MRIでは肺動脈弁狭窄,閉鎖不全などを加速血流や逆流量などを定量的に評価でき,本症例においては全身血流量の約7割が肺動脈弁を通過し,約3割がGlenn吻合を通過していることがわかった.さらに4D flow MRIでは3次元的に血流の流線を可視化することができ,その結果主肺動脈からの旋回流がGlenn吻合の血流ときれいに融合し,良好な血行動態を得ている所見が得られた(Fig. 3).このように4D flow MRIによる血流解析は複雑な解剖の疾患においてこそその力量を発揮すると考えられる.
超音波による血流解析は上述のようにカラードプラに基づくVFM法8)を中心として,コントラスト剤で心内腔を満たしたのちにspeckle trackingによって流れを可視化するEcho PIVなどが知られる39, 40).VFMという方法は古くは大槻らによって流れ場を渦と基本流れに分離する方法として提唱されたEchodynamography41)の商品名として知られたが,現在のVFMとは全く別物である.旧VFMでは十分な実験的検証を経ていたものの42),仮定している流れ関数の一意性や積分の境界条件の問題などの数学的な整合性が不十分な部分があった.Garciaらはこれらを矛盾なく解決する手法を独自に提示したが43),現在のVFMはGarciaらの方法を改良したものである44).Echo PIVは臨床応用も少なからずなされているが40, 45),ファントム実験での検証により42 cm/sec以上の流速は追跡精度が大きく落ちることが知られており,大きなlimitationの一つと考えれられている.Fig. 4にVFMの概要を記載する.
VFMは2次元での血流評価であるという限界を有するが,どこでも手軽に血流を評価できるという点では利便性は大きい.本田らはファロー四徴症術後の肺動脈狭窄症例で狭窄後拡張での渦流が大きなエネルギー損失を発生していることをとらえ,また交連切開により肺動脈弁狭窄を解除すると主肺動脈の血流が層流になりエネルギー損失が著しく低下することを報告している32).また秋山らは経胸壁の超音波では見えにくい部分などを経食道超音波でVFM解析をかけるなどしてより良質な血流解析を超音波で行っているが46),先天性心疾患では部分的ではあるが大きな期待がもたれる方法と考えられる.単心室右室などでは通り一遍ではない渦流を呈し,エネルギー損失を生んでいる可能性も示唆されている1).
超音波血流解析のもう一つの側面として,渦流や血流速度の計測とは異なるが,Color M modeに基づく心内圧較差(IVPG: Intraven-tricular Pressure Gradient)の算出方法がある47).上述のように非侵襲画像で血圧分布を得ることは一般に困難であり,相対圧のみが得られるが,その正確性はframe rateに依存している.Color M modeでは縦軸が空間,横軸が時間で血流速度の時間と空間の分布を提示してくれる.このためColor M modeの速度情報からNavier–Stokes方程式,もっというと粘性摩擦項を除去した運動量保存の式であるEulerの式を積分して圧較差を求めるというのがIVPGのコンセプトである47).この方法では速度が一次元であることに留意されたい.つまりColor M modeを計測するときのbeamlineに沿った血流,例えば心尖部viewからみた拡張早期の僧帽弁流入血流などにのみ適用され,相対圧力としての心内圧較差が算出可能である.この方法は心室のsucking forceとしての拡張機能を評価する方法として知られる48).
流体シミュレーション(CFD)は関心となる解析領域をメッシュと呼ばれる微小領域で分割し,その各領域の中で血流に関する流量と運動量の保存方程式を近似的にコンピュータに解かせ,メッシュの各点での血流速度ベクトルと血圧情報を得る数値計算の手法である49).血管の形状のみでは流れ場は発生しないので,境界面に物理学的な条件を代入しなければならず,これを境界条件という49).境界条件は数学的な要求から,各境界面で速度または圧力を代入するが,例えば血管壁表面では血管がほとんど動かないと仮定すると壁面に速度0という値を代入することになり,また例えば大動脈の入口部の断端面に心拍出量を血管断面積で除した流速を代入するとそれらしい生理学的な流量になり,また動脈の出口の断端面に計測された血圧値を代入すると生理学的な血行動態に近い血行動態がコンピュータ上で再現されることになる.上述のように流体力学の基礎方程式であるNavier–Stokes方程式の厳密解を求めることは容易ではないので,コンピュータで近似解を求め,方程式の左辺と右辺が限りなく小さな誤差に収まるよう,計算を繰り返す必要がある49).このため膨大な計算量を要し,大型のコンピュータが長時間かけて一心拍の計算をすることになるが,計算を繰り返しても必ずしも誤差が小さくなる方向に向かって行くとも限らず,計算誤差が次第に小さくなっていくことを収束,大きくなっていって計算が終わらなくなってしまうことを発散というが,「これ以下の誤差に収まったら収束とみなす」という条件を収束残差と言い任意に設定することができる.心臓血管系では通常1.0E−5(10の−5乗の意味)前後で設定することが通例であるが,これは例えば流量保存式に関していうならば5 L/minの心拍出量に対して,0.05 mL/min=3 mL/h程度の誤差しかないことを意味しており,不感蒸泄や尿量や水分補液量などと比して充分小さく,誤差の範囲とみなせるレベルであることを意味している.Fig. 5にCFD解析のプロセスを示す.
CFD,血流解析シミュレーションは上述のようにFontan手術術式をエネルギー損失の観点から合理化する上で重要な役割を担ってきた4, 19–23).Fontanという非生理学的に上下大静脈の血流が衝突する経路で流体力学者の興味を引く系であるからなのか,あるいは人工血管と癒着の強い肺動脈という比較的動きの少ない単純な系でモデル化がしやすかったからなのか,Fontan循環における血流解析はCFDが医療に適用されたものの中で最も歴史がある代表的な課題であると言っても過言ではない.1995年のVan Haesdockらの報告以来4)文献上はその後10年以上にわたって毎年のようにFontanのCFD解析の論文が発表され19–23, 50–64),今日でもその話題は尽きないが,当初は例えばGlenn吻合とTCPCの人工血管のoffsetをどれくらいにすればよいかといった一般的な命題を,パイプ管をつなぎ合わせたような単純なモデルで計算していたが50–54),次第にCG技術の発展とともに患者固有の形状をCT, MRIからとってきて両側Glenn後のTCPCなど患者固有の事情を加味したモデルを構築するようになっていった60).
その後FontanだけではなくNorwood手術などのより複雑な血行動態でのCFD解析を行われるようになり15, 65),今日では多岐にわたる先天性心疾患のCFDモデルが発表されつつある.今日においては,CFD解析は冠動脈疾患の領域では冠動脈CTから非侵襲に冠血流予備比(FFR: Fractional Flow Reserve)を流体解析によりシミュレーションで推定し,虚血診断をするツールとして知られつつある65, 66).FFR-CTとして知られるこの方法は,その後膨大な臨床研究でのエビデンスを輩出し,石灰化病変を有する症例での精度や67),急性冠動脈症候群における経済効果68)まで,データを出しており,今日最も臨床に近いCFDツールである.しかしながら繰り返しになるが,このFFR-CTが開発される10年以上も前からFontan循環でのCFDモデルが議論されており,それも「虚血か否か」や「血行再建が必要かどうか」というような診断にとどまる,あるいは診断補助のような用途の枠を超え,「心負荷の少ない単心室修復を行うためにどのような術式が適正か」などという遠隔期生命予後に直結する議論を行っていたことは,先天性心疾患の領域がいかにシミュレーション医学を渇望しているかの表れではないかと考えられる.
一方シミュレーションはあくまで計算解にすぎないため現実のものではない.計算仮定が結果に大きく影響をもたらし,特に出入口の境界条件は生理学的な血行動態を再現できるかどうか大きくかかわってくる.上述のように,各端面には流速か圧の分布を入れることが数学的に要求されているが,反復計算中に,圧と流速(あるいは流量)の関係式を解くことにより,血管インピーダンスなどを組み込むことも可能である70).冠動脈であろうとBTシャント後の並列循環であろうと,血管抵抗,末梢血管コンプライアンス,慣性力などを各々電気抵抗,静電容量,インダクタンスなどに見立ててCFDの境界条件に電気回路を組み合わせたような解析方法65, 66)は頻用されており,パラメータが多いことからlumped parameter modelなどと呼ばれる64).狭窄病変の末梢などで流量に応じて灌流圧が決まるような系の場合には,出口に圧や流速をあらかじめ与えるわけにはいかないのである程度生理学的な状況を勘案した良い方法ではあるが,電気回路パラメータはどのようにインピーダンス合成をしても,インピーダンスの複素位相が90度を超えることはないため,血流量と血圧の変動が反転するような系を再現することは不可能である.つまり,血流量が増加する時に血圧が下がっていたり,血圧が上昇する時に血流量が低下したりといった現象を再現することはできないことを意味している.生体内では実はこのような血流と血圧の変動が反転するような系は実際には少なくない.例えば,Fontan循環では呼吸にともない,吸気時に末梢肺動脈圧が低下して,肺血流量が増大するが71),このように位相が反転するような系は生体内には多々存在し,Fontan循環において呼吸は重要な駆動力71)であるようにしばしば極めて重大な役割を担っていたりする.また,冠動脈において拡張期に血圧は低下するが,弛緩した心筋が血流を引き込み血流量は増加するのも同様な現象の具体例である.そこで我々はより生理学の基礎にもどり,末梢からの反射応答を出口境界条件に組み込むことにして,Fontanの呼吸駆動力なども正確に表現できるようにシミュレーションシステムを構築している72).
4D flow MRIなどの計測系の血流解析と比して,画像の時間分解能が極めて高く,細い血管であってもコンピュータの精度の限界まで解像度を上げることができる一方で,実測ではないことがlimitationとなるが(Table 1),一方でCGと組み合わせることで仮想手術ができる9)ことは疾患や解剖にvariationの多い先天性心疾患では有利であると考えられる.
先天性心疾患における予測医療としての血流解析の役割
血流解析は疾患による異常血流がもたらす力学的なストレスを可視化,定量化することを通じ,疾患の予後予測につながる手法であり,その意味で予測医療としての役割を有すると考えられ,疾患の遠隔予後を考えるに適した手法であると期待される27).先天性心疾患は周術期管理などが洗練され,多くの診療エビデンスを構築しつつある今日において,新生児期や小児早期を乗り越える患児が日々増多の一途をたどり,成人期を迎える患者は少なくないが73),疾患の経過の長さに比して先天性心疾患の手術の歴史はそれほど長くはなく,その意味では成人先天性心疾患は統計エビデンスが不足しているが,現実的には対応に差し迫られる患者も少なくない.遠隔期先天性心疾患,成人先天性心疾患に関しては心臓MRIが大きな役割を担いうことがよく知られるが74),4D flow MRIでの血流解析を加え血行動態を明らかにすることができれば治療方針決定に際して更なる利点があると考えられる.ファロー四徴症術後の肺動脈弁狭窄/閉鎖不全に対する再手術介入は現在のところ右室容積を主体としているが75),ある程度以上拡大した右室は弁だけ置換してももとには戻らないことも同時に知られ75),4D flow MRIでの弁逆流などの定量評価に加え38),血流のエネルギー損失が遠隔期右心負荷に与える影響などは今後の検討課題と考えられる32).
先天性心疾患の中には血流解析でしか診断の困難な事態も存在しうる.Fig. 6に下大静脈欠損,奇静脈結合に対してTCPS(total cavopulmonary shunt)に加えて肝静脈から心外導管を用いてTCPCを行った症例でのFontan循環の4D flow MRIを提示するが,奇静脈/半奇静脈結合に伴いTCPC後にも肝因子の不均等分布に伴い,方肺の動静脈瘻の形成を伴うことはしばしばあるが,この場合,肝血流が両肺にどのくらい分布しているかを知るためには,カテーテルでは造影剤をinjectする際にかなりの圧をかけてしまうため,現状の臨床検査モダリティでは4D flow MRI以外に存在しない.また,こういった疾患においてもし不均等分布が発生している場合にどのような導管のConversionを行うと是正されるかを知るためにはCFDシミュレーションをおいてほかに手段がないであろうことも血流解析が担う役割である.
近年台頭してきた血流解析は循環器画像診断の様々なもダリティで適用され始めている.異常血流がもたらす力学的なストレスを可視化,定量化することで疾患の予後を予測する新しい医療を切り拓く可能性を有する.解剖学的にも生理学的にも複雑で,variationの多い先天性心疾患では3次元での血流の詳細がわかる血流解析は古くから多くの期待を担ってきたが,患児の多くが成人期を迎えるようになった今日,血流シミュレーションを含めた予測医療が可能な血流解析は先天性心疾患の遠隔期の治療に際して重要な役割を担う.
利益相反
日本小児循環器学会の利益相反(COI)に関する指針に基づき,以下を開示する.著者は,株式会社Cardio Flow Designの株式を開示義務のある一定数保有している.また,日本メドトロニックの寄付講座に所属している.
引用文献References
1) Itatani K: Advances in Hemodynamics Research. Nova Science Publisher, 2015
2) Sugawara M, Kajiya F, Kitabatake A, et al: Blood Flow in the Heart and Large Vessels. Springer-Verlag Tokyo, 1989
3) Richter Y, Edelman ER: Cardiology is flow. Circulation 2006; 113: 2679–2682
4) Van Haesdonck JM, Mertens L, Sizaire R, et al: Comparison by computerized numeric modeling of energy losses in different Fontan connections. Circulation 1995; 92 Suppl: 322–326
5) Landau LD, Lifshitz EM: Course of Theoretical Physics. Fluid Mechanics. 2nd edition, Butterworth Heinemann, 1987
6) 中村 亨:数学21世紀の7大難問.講談社,2004
7) Jones L, Pressdee DJ, Lamont PM, et al: A phase contrast (PC) rephase/dephase sequence of magnetic resonance angiography (MRA): A new technique for imaging distal run-off in the pre-operative evaluation of peripheral vascular disease. Clin Radiol 1998; 53: 333–337
8) Itatani K, Okada T, Uejima T, et al: Intraventricular flow velocity vector visualization based on the continuity equation and measurements of vorticity and wall shear stress. Jpn J Appl Phys 2013; 52 7S: 07HF16
9) Baretta A, Corsini C, Yang W, et al: Virtual surgeries in patients with congenital heart disease: A multi-scale modelling test case. Philos Transact A Math Phys. Eng Sci 2011; 369: 4316–4330
10) Hwang J, Saha A, Boo YC, et al: Oscillatory shear stress stimulates endothelial production of O2− from p47phox-dependent NAD(P)H oxidases, leading to monocyte adhesion. J Biol Chem 2003; 278: 47291–47298
11) Yiannis S, Ahmet UC, Michael J, et al: Role of endothelial shear stress in the natural history of coronary atherosclerosis and vascular remodeling. J Am Coll Cardiol 2007; 49: 2379–2393
12) Fukumoto Y, Hiro T, Fujii T, et al: Localized elevation of shear stress is related to coronary plaque rupture: A 3-dimensional intravascular ultrasound study with in-vivo color mapping of shear stress distribution. J Am Coll Cardiol 2008; 51: 645–650
13) Chatzizisis YS, Jonas M, Coskun AU, et al: Prediction of the localization of high-risk coronary atherosclerotic plaques on the basis of low endothelial shear stress: An intravascular ultrasound and histopathology natural history study. Circulation 2008; 117: 993–1002
14) Samady H, Eshtehardi P, McDaniel MC, et al: Coronary artery wall shear stress is associated with progression and transformation of atherosclerotic plaque and arterial remodeling in patients with coronary artery disease. Circulation 2011; 124: 779–788
15) Itatani K, Miyaji K, Qian Y, et al: Influence of surgical arch reconstruction methods on single ventricle workload in the Norwood procedure. J Thorac Cardiovasc Surg 2012; 144: 130–138
16) Itatani K: Fluid dynamical considerations on the single ventricular physiology: Energetic optimization of the Norwood and Fontan procedures. PhD Thesis, the University of Tokyo, 2011
17) Itatani K, Ono M: Blood flow visualiziong diagnostic device. Patent WO2013077013 A1 PCT/JP2012/063484 2013-05-30
18) Honda T, Itatani K, Takanashi M, et al: Quantitative evaluation of hemodynamics in the Fontan circulation: A cross-sectional study measuring energy loss in vivo. Pediatr Cardiol 2014; 35: 361–367
19) de Leval MR, Dubini G, Migliavacca F, et al: Use of computational fluid dynamics in the design of surgical procedures: Application to the study of competitive flows in cavo-pulmonary connections. J Thorac Cardiovasc Surg 1996; 111: 502–513
20) Bove EL, de Leval MR, Migliavacca F, et al: Computational fluid dynamics in the evaluation of hemodynamic performance of cavopulmonary connections after the Norwood procedure for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2003; 126: 1040–1047
21) Whitehead KK, Pekkan K, Kitajima HD, et al: Nonlinear power loss during exercise in single-ventricle patients after the Fontan: Insights from computational fluid dynamics. Circulation 2007; 116 Suppl: I165–I171
22) Dasi LP, Rema RK, Kitajima HD, et al: Fontan hemodynamics: Importance of artery diameter. J Thorac Cardiovasc Surg 2009; 137: 560–564
23) Itatani K, Miyaji K, Tomoyasu T, et al: Optimal conduit size of the extracardiac Fontan operation based on energy loss and flow stagnation. Ann Thorac Surg 2009; 88: 565–572, discussion, 572–573
24) Garcia D, Pibarot P, Dumesnil JG, et al: Assessment of aortic valve stenosis severity: A new index based on the energy loss concept. Circulation 2000; 101: 765–771
25) Bahlmann E, Gerdts E, Cramariuc D, et al: Prognostic value of energy loss index in asymptomatic aortic stenosis. Circulation 2013; 127: 1149–1156
26) Kume T, Okura H, Kawamoto T, et al: Impact of energy loss coefficient on left ventricular mass regression in patients undergoing aortic valve replacement: Preliminary observation. J Am Soc Echocardiogr 2009; 22: 454–457
27) Itatani K: When the blood flow becomes bright. Intraventricular flow patterns: From normality to pathology. Eur Heart J 2014; 35: 747–752
28) Nabeta T, Itatani K, Miyaji K, et al: Vortex flow energy loss reflects therapeutic effect in dilated cardiomyopathy. Eur Heart J 2015; 36: 637
29) Stugaard M, Koriyama H, Katsuki K, et al: Energy loss in the left ventricle obtained by vector flow mapping as a new quantitative measure of severity of aortic regurgitation: A combined experimental and clinical study. Eur Heart J Cardiovasc Imaging 2015; 16: 723–730
30) Kakizaki R, Nabeta T, Ishii S, et al: Cardiac resynchronization therapy reduces left ventricular energy loss. Int J Cardiol 2016; 221: 546–548
31) Hayashi T, Itatani K, Inuzuka R, et al: Dissipative energy loss within the left ventricle detected by vector flow mapping in children: Normal values and effects of age and heart rate. J Cardiol 2015; 66: 403–410
32) Honda T, Itatani K, Miyaji K, et al: Assessment of the vortex flow in the post-stenotic dilatation above the pulmonary valve stenosis in an infant using echocardiography vector flow mapping. Eur Heart J 2014; 35: 306
33) Vasanawala SS, Hanneman K, Alley MT, et al: Congenital heart disease assessment with 4D flow MRI. J Magn Reson Imaging 2015; 42: 870–886
34) Haggerty CM, Restrepo M, Tang E, et al: Fontan hemodynamics from 100 patient-specific cardiac magnetic resonance studies: A computational fluid dynamics analysis. J Thorac Cardiovasc Surg 2014; 148: 1481–1489
35) Riesenkampff E, Fernandes JF, Meier S, et al: Pressure fields by flow-sensitive, 4D, velocity-encoded CMR in patients with aortic coarctation. JACC Cardiovasc Imaging 2014; 7: 920–926
36) Casas B, Lantz J, Dyverfeldt P, et al: 4D Flow MRI-based pressure loss estimation in stenotic flows: Evaluation using numerical simulations. Magn Reson Med 2016; 75: 1808–1821
37) 柿崎良太,本田 崇,宮崎翔平,ほか:右心機能を考えるうえで知っておくべき基本とは?Heart View 2015; 19(3): 36–43
38) Hirtler D, Garcia J, Barker AJ, et al: Assessment of intracardiac flow and vorticity in the right heart of patients after repair of tetralogy of Fallot by flow-sensitive 4D MRI. Eur Radiol 2016; 26: 3598–3607
39) Kim HB, Hertzberg JR, Shandas R: Development and validation of echo PIV. Exp Fluids 2004; 36: 455–462
40) Hong GR, Pedrizzetti G, Tonti G, et al: Characterization and quantification of vortex flow in the human left ventricle by contrast echocardiography using vector particle image velocimetry. JACC Cardiovasc Imaging 2008; 1: 705–717
41) Ohtsuki S, Tanaka M: The flow velocity distribution from the Doppler information on a plane in three-dimensional flow. J Vis 2006; 9: 69–82
42) Uejima T, Koike A, Sawada H, et al: A new echocardiography method for identifying vortex flow in the left ventricle: Numerical study. Ultrasound Med Biol 2010; 36: 772–778
43) Garcia D, Del Almano JC, Tanne D, et al: Two-dimensional intraventricular flow mapping by digital processing conventional color-Doppler echocardiography images. IEEE Trans Med Imaging 2010; 29: 1701–1713
44) Itatani K, Ono M, Okada T: Ultrasonic diagnostic device. Patent WO2015151743A1 PCT/JP2015/057151 PCT/JP2015/057151
45) Prinz C, Faludi R, Walker A, et al: Can echocardiographic particle image velocimetry correctly detect motion patterns as they occur in blood inside heart chambers? A validation study using moving phantoms. Cardiovasc Ultrasound 2012; 10: 24
46) Akiyama K, Itatani K, Naito Y, et al: Vector flow mapping and impaired left ventricular flow by Alfieri stitch. J Cardiothorac Vasc Anesth 2017; 31: 211–214
47) Greenberg NL, Vandervoort PM, Firstenberg MS, et al: Estimation of diastolic intraventricular pressure gradients by Doppler M-mode echocardiography. Am J Physiol Heart Circ Physiol 2001; 280: H2507–H2515
48) Iwano H, Kamimura D, Fox E, et al: Altered spatial distribution of the diastolic left ventricular pressure difference in heart failure. J Am Soc Echocardiogr 2015; 28: 597–605
49) Adrian RJ: Particle-image technique for experimental fluid mechanics. Annu Rev Fluid Mech 1991; 23: 261–304
50) Dubini G, de Leval MR, Pietrabissa R, et al: A numerical fluid mechanical study of repaired congenital heart defects. Application to the total cavopulmonary connection. J Biomech 1996; 29: 111–121
51) Migliavacca F, de Leval RM, Dubini G, et al: Computational fluid dynamic simulation of cavopulmonary connections with an extracardiac lateral conduit. Med Eng Phys 1999; 21: 187–193
52) Ryu K, Healy TM, Ensley AE, et al: Importance of accurate geometry in the study of the total cavopulmonary connection: Computational simulations and in vitro experiments. Ann Biomed Eng 2001; 29: 844–853
53) Khunatorn Y, Mahalingam S, DeGroff CG, et al: Influence of connection geometry and SVC-IVC flow rate ratio on flow structures within the total cavopulmonary connection: A numerical study. J Biomech Eng 2002; 124: 364–377
54) Grigioni M, Daniele C, Gaudio CD, et al: Numerical simulation of a realistic total cavo-pulmonary connection: Effect of unbalanced pulmonary resistances on hydrodynamic performance. Int J Artif Organs 2003; 26: 1005–1014
55) Hsia TY, Migliavacca F, Pittaccio S, et al: Computational fluid dynamics study of flow optimization in realistic models of the total cavopulmonary connections. J Surg Res 2004; 116: 305–313
56) Masters JC, Ketner M, Bleiweis MS, et al: The effect of incorporating vessel compliance in a computational model of blood flow in a total cavopulmonary connection with caval centerline offset. J Biomech Eng 2004; 126: 709–713
57) Pekkan K, de Zelcourt D, Ge L, et al: Physics-driven CFD modeling of complex anatomical cardiovascular flows—A TCPC case study. Ann Biomed Eng 2005; 33: 284–300
58) DeGroff C, Birnbaum B, Shandas R, et al: Computational simulations of the total cavo-pulmonary connection: Insights in optimizing numerical solutions. Med Eng Phys 2005; 27: 135–146
59) Pekkan K, Kitajima HD, de Zelicourt D, et al: Total cavopulmonary connection flow with functional left pulmonary artery stenosis angioplasty and fenestration in vitro. Circulation 2005; 112: 3264–3271
60) de Zelicourt DA, Pekkan K, Park J, et al: Flow study of an extracardiac connection with persistent left superior vena cava. J Thorac Cardiovasc Surg 2006; 131: 785–791
61) Marsden AL, Vignon-Clementel IE, Chan FP, et al: Effects of exercise and respiration on hemodynamic efficiency in CFD simulations of the total cavopulmonary connection. Ann Biomed Eng 2007; 35: 250–263
62) Wang C, Pekkan K, de Zelicourt D, et al: Progress in the CFD modeling of flow instabilities in anatomical total cavopulmonary connections. Ann Biomed Eng 2007; 35: 1840–1856
63) Marsden AL, Bermstein AJ, Reddy M, et al: Evaluation of a novel Y-shaped extracariac Fontan baffle using computational fluid dynamics. J Thorac Cardiovasc Surg 2009; 137: 394–403
64) 板谷慶一,宮地 鑑,小原邦義,ほか:Fontan循環の流体シミュレーション—現状と展望—.日小児循環器会誌2010; 26(1): 39–48
65) Hsia TY, Cosentino D, Corsini C, et al: Modeling of Congenital Hearts Alliance (MOCHA) Investigators: Use of mathematical modeling to compare and predict hemodynamic effects between hybrid and surgical Norwood palliations for hypoplastic left heart syndrome. Circulation 2011; 124 Suppl: S204–S210
66) Taylor CA, Fonte TA, Min JK: Computational fluid dynamics applied to cardiac computed tomography for noninvasive quantification of fractional flow reserve: Scientific basis. J Am Coll Cardiol 2013; 61: 2233–2241
67) Koo BK, Erglis A, Doh JH, et al: Diagnosis of ischemia-causing coronary stenoses by noninvasive fractional flow reserve computed from coronary computed tomographic angiograms. Results from the prospective multicenter DISCOVER-FLOW (Diagnosis of Ischemia-Causing Stenoses Obtained Via Noninvasive Fractional Flow Reserve) study. J Am Coll Cardiol 2011; 58: 1989–1997
68) Nørgaard BL, Leipsic J, Gaur S, et al: NXT Trial Study Group: Diagnostic performance of noninvasive fractional flow reserve derived from coronary computed tomography angiography in suspected coronary artery disease: the NXT trial (Analysis of Coronary Blood Flow Using CT Angiography: Next Steps). J Am Coll Cardiol 2014; 63: 1145–1155
69) Douglas PS, De Bruyne B, Pontone G, et al: 1-Year outcomes of FFRCT-Guided care in patients with suspected coronary disease: The PLATFORM Study. J Am Coll Cardiol 2016; 68: 435–445
70) Vignon-Clementel IE, Figueroa CA, Jansen KE, et al: Outflow boundary conditions for 3D simulations of non-periodic blood flow and pressure fields in deformable arteries. Comput Methods Biomech Biomed Engin 2010; 13: 625–640
71) Honda T, Itatani K, Takanashi M, et al: Contributions of respiration and heartbeat to the pulmonary blood flow in the Fontan circulation. Ann Thorac Surg 2016; 102: 1596–1606
72) Goto S, Nakamura M, Itatani K, et al: Synchronization of the flow and pressure waves obtained with non-simultaneous multipoint measurements. Int Heart J 2016; 57: 449–455
73) 白石 公:成人先天性心疾患の診療体系の確立に関する研究.厚生労働省科学研究費補助金 循環器疾患・糖尿病生活習慣病対策総合研究事業 総括・分担研究報告書.2015
74) Kathiria NN, Higgins CB, Ordovas KG: Advances in MR imaging assessment of adults with congenital heart disease. Magn Reson Imaging Clin N Am 2015; 23: 35–40
75) 成人先天性心疾患診療ガイドライン(2010年度合同研究班報告)—循環器病の診断と治療に関するガイドライン—