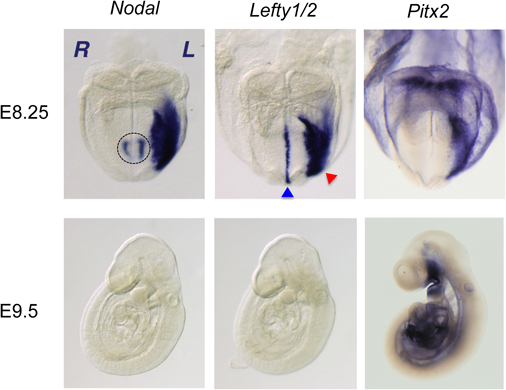
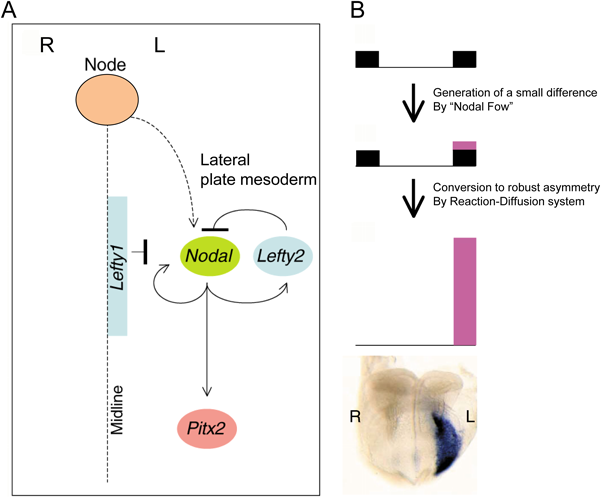
臓器錯位症候群は,遺伝学的左右軸情報の異常に基づく発生異常であり,出生数約1万人に一人に生じる先天奇形である.その予後は合併した先天性心疾患の重症度に因るところが大きい.ヒトとマウスの遺伝学から,脊椎動物の内臓の左右非対称性は動物種間で高度に保存された遺伝情報によって制御されることが強く疑われていたが,その本態は長年にわたり不明のままであった1).1995年から1996年にかけてNodal遺伝子(TGFβスーパーファミリーに属する分泌蛋白)及びLefty1/2遺伝子(NODALのアンタゴニストである分泌蛋白)の胚における左右非対称な発現が発見され(Fig. 1),これを契機に背後にある分子生物学的機構の解析が大きく前進し,約20年余の研究により我々の理解は飛躍的に深まった2–6).この総説では,ほ乳類における内臓配置の左右非対称性を司る分子生物学的なコア・モデュールに焦点を絞り,小児循環器学的視点にも留意しながら概説を試みたい.更に詳細かつ他の脊椎動物の左右軸獲得の分子機構に関心があれば,優れた総説があるので参照していただけると幸いである7–10).
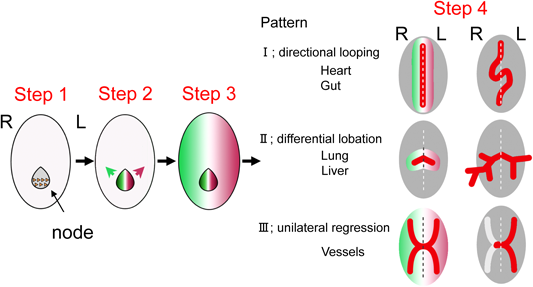
今日までの基礎医学的研究によれば,脊椎動物の左右非対称性が生み出される過程は,4つのステップに分けて考えることができる(Fig. 2)11).最初に対称性が破れ非対称性が生じるのは,原始線条の先端部にあるノードと呼ばれる構造体(ニワトリにおけるヘンゼン結節に相当する)においてである.次にステップ2で,ここで生じた「非対称の情報」が,胚の外側に位置する側板中胚葉へと伝達される.3つ目のステップで,この側板中胚葉へと伝達された非対称の情報に従い,左の側板中胚葉でのみNodalの発現が排他的に誘導される.最後のステップ4で,このNodalシグナルがビコイド型ホメオドメインを持つ転写因子Pitx2の発現を左の側板中胚葉でのみ誘導し,Pitx2とその下流にある遺伝子群が左側臓器の形態的特徴を形作る9).
以下では,この4つのステップの順に,左右軸に関わる遺伝学的情報が臓器の左右非対称な情報と心臓の形態に転換されていく機構を,順を追って解説する.
脊椎動物の発生で最初に解剖学的左右非対称性が明らかになる現象は,心円筒の右方へのループ形成であり,それまで胚は形態的には左右対称である.脊椎動物の左右非対称性に関する分子基盤が全く不明だった時代には,心円筒のルーピング以前にすでにノードにて対称性が破られているのではないかと強く疑われていた(Fig. 3A).なぜならば,ノードは胚発生の際の体軸構成に大きな活性を有する構造体であり,古典的発生生物学で有名な概念「シュペーマンのオーガナイザー」に相当すると考えられていたからである12).予測通り,ニワトリ胚のヘンゼン結節にて分子の局在に左右非対称性が出現することが1995年の秋にハーバード大学Tabin教授の研究室より示された2).この報告で,Nodalがヘンゼン結節で左右非対称に発現し,この非対称性が側板中胚葉の左側特異的なNodalの発現を誘導し,かつ,このNodalの非対称性が心円筒のルーピングの方向を上流で制御していることが示されたのである.まさに臓器の左右性に関する分子生物学的研究の幕開けであった.
翌年の1996年に,二つの研究グループから,マウスでも(1)ノードでNodalが左右非対称に発現すること,(2)側板中胚葉でNodalは胚の左側のみで非対称に発現すること,(3)臓器錯位モデルマウスであるivマウス(このマウスでは臓器の左右性が全くランダムになる)では,ノードと側板中胚葉におけるNodal発現の左右性がランダムになること,かつ,(4)前年のニワトリに関する報告と矛盾せず,そのNodalの非対称性と心円筒のルーピングの方向性は相関することが報告された(Fig. 1, Fig. 3D)3, 4, 11, 13).このようにして,解剖学的な構造の非対称性が明らかになる以前に,最初の「対称性の破れ」は確かに当初疑われていたように遺伝子の発現の非対称性としてノードで生じることが示されたのである.
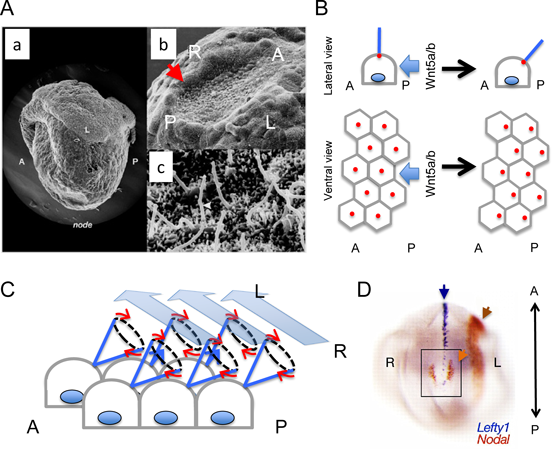
それでは,マウスのノードでこのような分子生物学的な非対称性を生み出す機構はどのようなものであろうか.この疑問に対するブレーク・スルーは,1998年にモーター蛋白キネシン・ファミリーに属するKif3b遺伝子変異マウスの報告によりもたらされた14).この変異マウスでは,KIF3B蛋白機能が失われた結果,ノード腹側の上皮細胞の頂側に存在する繊毛(Fig. 3)が消失する.その結果,ノードの繊毛の回転運動が生み出す胚の右から左に向かったノード表面に生じる一方向性の水流(ノード流;Nodal Flow)が消失してしまう.ノード流が失われた状態では,左右の決定がランダムになる.一方,人為的にノード流を逆転させると左右が逆転し,ノード流の失われてしまっているivマウス(後述)に人為的にノード流を作り出すと,ノード流の向きに胚の左右性が完全に一致したことから,左右性に対するノード流の十分性が証明された15).1970年代から,線毛不動症候群(Immotile Cilia Syndrome)の症例に対して電子顕微鏡による繊毛の観察を行った結果,微細管のDYNEIN armの欠損が報告されており,臨床的見地からも繊毛の機能的異常と左右軸の関与は既に指摘されていたが,このKif3b遺伝子変異マウスの研究によって繊毛がどのように左右非対称性に関与するのかが明白になったのである16).このノード(もしくはそれに相当する胚の構造)の上皮細胞における繊毛運動と,その繊毛運動が生み出す一方向性の水流が左右軸を決定する過程は,脊椎動物の種間で高度に保存されていることがわかっている7, 17).
一方,1959年に報告された代表的な臓器錯位モデルのivマウスに対し長年にわたる原因遺伝子の探索が行われた結果,ivの原因は繊毛の運動に必要なモーター蛋白遺伝子Dyneinの一つが変異で機能できないためである事が1997年にようやく突き止められた.この遺伝子は,left-right dynein(lrd)と命名された18).この分子の機能異常のために,ivマウスではノードの繊毛は形成されるが全く回転運動できず,ノード流が生じない19).その結果,ノードに左右性が全く生じず,ivマウスは各臓器のsitusが全くのランダムに決まるのである14).更に,多嚢胞腎と関連する繊毛関連蛋白の異常による臓器錯位マウスも相次いで報告され,ノードの繊毛の機能異常と臓器錯位との関係はもはや疑いようがなくなった20–24).臨床的に臓器錯位症候群に多嚢胞腎合併症例をあまり経験しないのは,表現型が重篤過ぎて多くは流・死産の転機をたどった結果ではないかと推定される.
それでは,ノードの繊毛によって右→左の一方向性の水流がどのように生み出されるのであろうか.詳細な解析の結果,ノードの繊毛は後方に向かって傾いており,この傾きにより水流を生み出すことが判明している(Fig. 3B, C)25, 26).この繊毛の傾きは,前後(頭尾)軸の情報を基盤とした胚の尾側からもたらされるWnt5によって形成される上皮細胞シートの「平面内極性」から生み出される27, 28).モーター蛋白そのものが元来不斉性を有し逆向きには動くことができないことから,上皮頂側端にある繊毛の回転方向は平面内極性より決まってしまうので,前後方向の情報と上皮細胞の細胞頂-底側端極性(背腹軸情報と言い換えることもできる)の情報さえあれば,胚の左右軸の方向は決まってしまうと言える.
次に,この一方向性のノード流が,ノードでの左右差を持ったNodal遺伝子の発現へと転換されるわけであるが(Fig. 1, Fig. 3D, Fig. 4A),その分子機構は実は未だ論争になっている.劣性遺伝型多嚢胞腎の原因遺伝子であるPkd2がマウスで異常になると,左右性の異常を生じる29).この蛋白はノードの繊毛に局在しており,力学的ストレスや熱といった物理的エネルギーを検知する受容体として知られるTRPファミリーに属するカルシウムイオンチャンネルであるので,PKD2蛋白がメカノセンサーとしてノード流による流体剪断応力を検知し,ノードのカルシウム・シグナルに非対称性が生じ,次いでこれがノードのNodalの左右非対称な発現を生み出すと信じられている一方で,そのモデルに対して否定的な見解もあり,更なる検討が必要である30, 31).一方でFGF, Hedgehog(Hh)やレチノイン酸の関与も指摘されており,ノード流がこのようなシグナル因子を胚の一方向(つまり左側)へと運搬した結果,左右性がノードで生じるという仮説も提唱されている2, 32–35).残念ながら,例えばSonic Hhはニワトリではノードで非対称に発現することでNodalのノードでの非対称な発現を誘導するのであるが,マウスでは左右非対称なHhシグナルの証拠は見いだされていない.FGFシグナルもマウスでは非対称である事実は見いだされておらず,したがって,このモデルも広く支持されているとは言い難い.各実験動物モデルで明らかになった事実から言えることは,繊毛が生み出すノード流は種間で保存されているが,ノード流の情報を非対称性の遺伝学的情報に転換する分子機構は,進化の過程で大きな多様性を生じ,動物種毎に異なるシステムが採用されているらしいということである7).
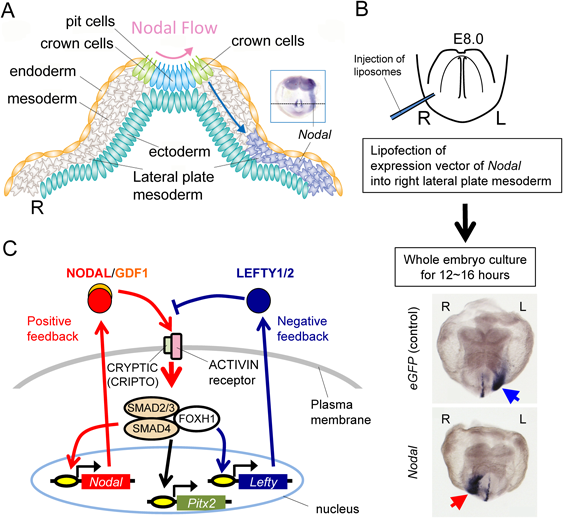
ノードで生じた非対称性の情報は,つぎに胚の外側の側板中胚葉へと伝達される(Fig. 4A).残念ながらこの伝搬の分子機構に関しても未だすべてが明らかになったとは言い難い.ノードでの非対称性が左右非対称なカルシウム・シグナルを生み出し,ギャップ・ジャンクションを通じて左側の側板中胚葉にリレーされるとの仮説も提唱されているが,NODAL蛋白は基底膜成分のコンドロイチン硫酸と相互作用することで遠隔に拡散でき,コンドロイチン硫酸が左の側板中胚葉にNodalが発現するために必須であること,NODAL蛋白は基底膜側に分泌されていること,Nodalを側板中胚葉に異所発現させると,左右にかかわらず側板中胚葉でのNodal発現を誘導できることなどから(Fig. 4B;後述),ノードで分泌されたNODAL自身が側方へ拡散し,側板中胚葉にNodalの発現を直接に誘導・確立する説が最も有力である32, 36–39).NODAL蛋白はホモ二量体を形成できるが,ノードから距離的に離れた側板中胚葉へのシグナル伝達には同じくTGFβスーパーファミリーであるGDF1とヘテロ二量体を形成する必要がある40).
左の側板中胚葉特異的な一過的Nodal発現の確立(ステップ3)
ノードでは発現強度に左右差があるもののNodalが左右双方に発現するのに対し,側板中胚葉でのNodalの発現は左側特異的で右には発現しない.この「all or none」の発現パターンを作り上げるのに,NODAL蛋白に拮抗阻害作用を有し,Nodalシグナルの発現範囲とシグナル強度が拡大しすぎぬよう微調整する役割を果たすLEFTY1/2分子とNODAL分子の間にある相互の物性的および遺伝学的関係が極めて重要である(Fig. 4C, Fig. 5A)6, 41–43).NODAL/GDF1へテロ二量体は,GPIアンカー型膜蛋白のCRYPTIC(神経底板ではファミリー分子であるCRIPTO)に依存してACTIVIN受容体を活性化する9, 44).活性化された受容体はSMAD2/3をリン酸化し,リン酸化SMAD2/3はSMAD4と複合体を形成して核移行し,転写因子FOXH1とともに下流遺伝子を活性化する.Nodalの直接の下流遺伝子には,Nodal自身と,NODALの受容体に対して拮抗阻害作用を持つLefty1/2があり,Lefty1/2遺伝子も左側のみで「all or none」の形で発現する45).すなわち,NODAL分子を中心に,自身の発現を活性化するポジティブ・フィードバックと,自身の発現を抑制するネガティブ・フィードバックの二つが同時に成立しているのである.この二つのフィードバック・ループの組み合わせと,LEFTY1/2とNODAL蛋白の持つ物性によって,かの有名なチューリングの数理モデルである反応拡散波モデルが成立し,ノードから左右不均衡なNodalシグナルが左右に分かれた「場(ここでは側板中胚葉)」にインプットされると,野生型ではやや強いシグナルの入った左がNodal発現を獲得し,右側はNodalの発現が確立できないことが数学的にシミュレートできる(Fig. 5B)41, 46).つまり,片側の「場」が活性化すると,反対側の「場」はそれによって完全に抑制されてしまう事態が生じるのである.これは単に数学モデル上の話だけではなく,実際に人為的に野生型マウス胚の右側に,左側でNodalの発現が生じる前に強制的にNodalのシグナルを強くインプットすると,予想通りに右にNodalの発現が確立され,本来はNodalが発現せねばならない左では発現が抑制されてしまう(Fig. 4B).しかも,この発現は数学モデル上,一過的で発現量がピークに達した後に漸減し消失してしまうことが予測されるが,実際の胚でもNodalの左側板中胚葉での発現は数時間で消失してしまう.したがって,ノードからのNodalシグナルが何らかの形で胚の「左側」にやや強く伝わり側板中胚葉でNodalの発現を促すと,側板中胚葉がもつ「場」としての性質と,NODALとLEFTY1/2分子が持つ拡散速度や分解速度を含めた物性,そして下流で働く転写制御の分子機構によって,発現パターンが規定されてしまうのである.さらに,シミュレーション上も実際の胚でも,ノードでNodalシグナルが非対称でありさえすればよく,ノードから側板中胚葉へ伝達されるインプットの量があまり多くなくても左右性の確立には十分であることも実証されている41, 47).
左右決定に胚の中軸構造も重要な役割を担う(Fig. 5A).実際に胚の中軸構造の異常によって左右決定が攪乱されることは指摘されていたが,なぜそうなるのか,その本態はMenoらの左側相同(left isomerism)を呈するLefty1変異マウスの解析で明らかとなった48).Isomerism(相同)とは,左右非対称であるはずの内臓の形態及び配置が,左右両側とも「右」もしくは「左」の形態となった状態を指す.左側相同は左側の,右側相同は右側の特徴を持つ状態である.Lefty1/2遺伝子はLefty1と2と二つの分子がゲノム上タンデムに並んでコードされており,Lefty1が中軸構造の神経底板で,Lefty2は主に側板中胚葉で発現・機能する(Fig. 1).側板中胚葉で発現したNODAL蛋白が中軸まで拡散すると,神経底板の左側でLefty1の発現が誘導され,そこでNODAL蛋白の活性を阻害する49).つまり中軸で左側の情報が右側に及ばぬように障壁(midline barrier; Fig. 5A)の役割を果たしているのである.この障壁がなくなってしまうとノード以外の場所から右の側板中胚葉に向かって左からリークしたNodalシグナルが伝達されてしまう.その結果,拡散反応波モデルに従えなくなり,発現が抑制されるはずの右側でも結果としてNodalが発現してしまうため,胚両側がNodalによって左側化し多脾症を伴う「左側相同」になるのである41).Lefty1変異マウスは,現在でも左側相同の唯一のモデル動物である.心房左側相同以外の心臓の形態は多様であるが,DORV, Fallot四徴,AVSDなどを含む,ヒトの症例で経験される先天性心疾患のスペクトラムと矛盾しない.
転写因子Pitx2の発現と左右非対称な形態形成(ステップ4)
側板中胚葉に確立された左側特異的なNodalシグナルは,その下流の転写因子Pitx2を直接誘導する(Fig. 1, Fig. 4C, Fig. 5A)26, 50).Pitx2はビコイドタイプのホメオドメインを持った転写因子で,もともとはAxenfeld-Rieger症候群の原因遺伝子として同定されたものであった.NodalやLefty1/2といった他の左右非対称に発現する遺伝子と違い,一度発現が誘導されると持続的に発現する51, 52).
遺伝子改変により側板中胚葉でのPitx2の左側発現を特異的に消失させると,無脾症と右側相同を生じることから,Nodalシグナルによってもたらされる「左側化」を実際に実行するのは,概ねPitx2及びその直接の標的遺伝子であると考えられる50).つまり,正常の胚発生では,「左側の構造の決定因子」はNodal下流の一連のシグナル・カスケードであり,このインプットがないデフォールトの状態は右側の形態だということになる.興味深いことに,Pitx2のヌル変異及び側板中胚葉特異的欠失変異マウスでは,心円筒のルーピングの方向には異常を生じない50, 53–55).Pitx2の上流にあるNodalシグナルに異常を生じる場合(例;Nodalそのもののヌル変異やNodalシグナル確立に必要な転写因子FoxH1の変異など)は共にルーピングの方向性に異常を生じさせる事実と考え合わせると,心円筒のルーピングの左右性だけはPitx2に依存せず,おそらくはNodalシグナルを受けて転写因子FoxH1が直接その役割を果たしていると推測される(Fig. 4C).臓器錯位症候群では臨床的に脾臓の形態に関心が集まるが,脾臓の形態形成の研究成果は未だに乏しい.上述してきた左右軸異常のマウスの表現型では,右側相同には無脾症が,左側相同には多脾症が必ず伴っていることから,脾臓の発生にNodal→Pitx2のシグナル経路が関与していることは疑いがない.脾臓が生じるには,転写因子Nkx2-3が必要で,Nkx2-3が左右非対称に発現することも報告されているが,Nkx2-3の発現をPitx2が直接制御しているのか,間接的なのかは不明である56).Pitx2変異マウスの心臓の形態に目を向けると,実にヒトの右側相同にて経験する先天性心疾患のスペクトラムによく合う.Pitx2変異マウスのマクロ解剖学的な表現型はかなりステレオタイプで,TGA, DORV, AVSD,無脾,腸回転異常が必発であり,時に右側大動脈弓や重複大動脈弓を観察する.もちろん,心房の左右性はPitx2に依存するので,心房右側相同を伴う.一方で,ヒトの症例での右側相同ではこのような表現系の均一性は認めない.これは,右側相同の原因はPitx2の機能異常だけではないであろうことは容易に想像できる上,マウスの実験では再現性の観点から遺伝学的背景が均一な集団で解析が行われている一方で,ヒトの場合は遺伝学的背景が全く均一ではないことから表現型の遺伝浸透度は100%とは限らず,加えて機能的ヌルなアレルだけではなく低形質アレルが原因の症例もあり得るためと思われる.そのような多様な原因や母集団の遺伝学的不均一さに依存して,胸腔内(胚の前方)と腹腔内(胚の後方)でsitusが一致しないことも含むヒトの症例における表現型の複雑さを生むのであろう.しかし,Pitx2変異マウスで観察される上述のようなスペクトラムを診断時に意識することは,私見ながら決して無駄ではないように思う.
Pitx2はAxenfeld-Rieger症候群の原因として同定された分子であるにもかかわらず,Axenfeld-Rieger症候群で臓器錯位症候群は典型的な表現型とは言い難い57).おそらくこれは,多嚢胞腎の場合と同じく,Pitx2が機能的にヌルに近い場合は胚性致死であり,かつ臓器の形態形成の正常/異常はPitx2の発現量に依存することから,我々が経験できるPitx2変異のヒトの症例は低形質アレルの場合のみで,その場合は左右非対称な臓器の形態形成に多くは問題が生じないか,もしくはAxenfeld-Rieger症候群としてのスペクトラムが出そろわないからではないかと考えられる50, 54, 58).
左右非対称な形態形成の分子生物学的機構の理解に関しては,実はPitx2の発現が確立された後,この遺伝学的な情報が具体的にどのように形態に結びつくのかに関する研究が一番遅れていると言ってよい.そのような状況であるが,具体的にメカニズムがイメージできるところまで解析が進んだ例を以下に二つ紹介したい.
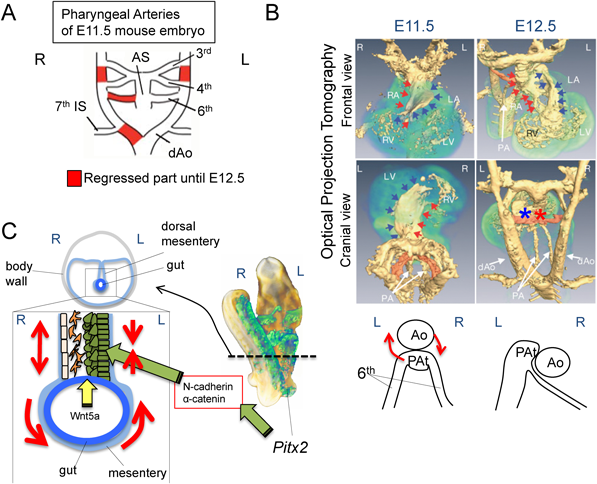
一つは,左側大動脈弓の形成である(Fig. 6A, B)59).発生学で学んだように,大動脈弓は,一度は左右対称に形作られる鰓弓動脈のシステムに由来する.この鰓弓動脈が左右非対称なリモデリングを生じることで左側大動脈が完成するのであるが,よく観察すると非対称に消褪する部分は2カ所しかなく,その消褪する部位の左右性はほぼ一致する.しかも,実はこの二つの血管を構成する細胞には,Pitx2を発現する(すなわちNODALシグナルの制御を直接受ける)細胞は全く寄与しない.したがって左側大動脈弓の形成は「左右軸の遺伝学的情報」で直接制御されてはいない.しかしながら,一見矛盾するように見えるが,臓器錯位症候群で右側大動脈弓などの動脈弓の左右性に異常を生じ得る事実は,左右軸の情報が大動脈弓の左右性に大きな影響を及ぼすことを明示している.詳しい解析の結果,まずPitx2に直接形態形成が担われているのは心臓流出路の形態で,Pitx2の影響に拠ってダイナミックに形を変える.流出路はE11.5から12.5にかけて約90度の回旋運動を行い,この動きにより右の第6鰓弓動脈を大きく引っ張り,右第6鰓弓動脈が細長くなる(Fig. 6B).内径が狭くなった右第6鰓弓動脈の血管抵抗が急激に上昇した結果,血流は左側に奪われ右第6鰓弓動脈の血流が消失する.この血流の消失によりPDGFとVEGFのシグナルの活性化を保てなくなり,右側で廃用性の退縮を起こす.更に,この右第6鰓弓動脈の血流の消失に伴って胚の右側背側大動脈への血流も急激に失われ,第7体節間動脈(将来の鎖骨下動脈)以遠の背側大動脈も廃用性の退縮を起こし,結果として左側大動脈弓が完成することが判明した.この流出路のPitx2に拠る形態変化が失われた場合,流出路の漏斗部における螺旋構造が構成されず,その螺旋構造を作り上げる際に生じる第6鰓弓動脈を「引っぱる」流出路の回旋運動が起こらないため,胚の左右に供給される血流が両側で保たれたり(重複大動脈弓),偶発的に左右のどちらかで減少したり(正常の左側大動脈弓,または右側大動脈弓)することになる.第6鰓弓動脈のリモデリングとリンクをしないリモデリング部位は,おそらくはリンクする部分と構成する内皮や平滑筋などの性質が前後軸情報等を基に大きく異なるからであろうと推測されるが,現時点ではどのような違いが本質的なのかは全く不明である.
二つ目のPitx2による左右非対称な臓器形成の例は,腸管の回転である(Fig. 6C)60).腸管の回転は,腸間膜中皮上皮と腸管の間に存在する間質細胞の挙動により生み出されることが報告されている.この間質細胞は側板中胚葉,即ちNodalが左右非対称に発現する中胚葉成分由来で,左側のこの間質細胞がPitx2を発現する.Pitx2を発現したこの間質細胞と間膜上皮において,Wnt5aのシグナルと協調して左側でαカテニン/Nカドヘリンを介したシグナルが活性化し,腸間膜上皮と間質細胞のサイズが小さく,また細胞同士が密に接着して構造が緻密になる.一方,胚の右側の間質細胞にはPitx2が発現しないため,細胞同士の関係も組織構造そのものも粗なままであるため,結果的に腸間膜の左右で組織の伸張に差が生じ回転するのである.
最後に,ヒト臓器錯位症候群について,若干の考察を加えたい.ヒトでは今まで多くの臓器錯位症候群に関連した遺伝子変異が報告されてきた61, 62).紙面の関係でそのすべてをここで網羅することは難しいので,総論的な考察にとどめたいと思うが,基本的には左右軸獲得の「4つのステップ」に異常を来すような遺伝子変異が生じると,上述してきた中核的なモデュールを直接構成する分子でなくても臓器錯位症候群を発症し得る.例えば,核蛋白ZIC3はモデュールの直接の構成分子ではない.ヒト臓器錯位症候群で変異が同定され,多くは生じた変異により転写因子としての活性を著しく損なっている63).ホモ変異マウスでも臓器錯位症候群が生じるが,どうやらZIC3蛋白はノードを含む中軸中胚葉と原始線条で細胞の機能異常を生じさせ,その結果としてノードでのNodalの非対称性が作り出せなくなることがZIC3の機能異常による臓器錯位症候群の原因の本態のようだ64).ヒト症例の遺伝学を考える際に注意したいことは,変異が左右性をランダム化する場合は,ivマウスで観察されるように一定の確立で「正常の個体が出現しうる」ことであろう.そのような遺伝子変異を伴うが臓器の形態が正常な症例は一見すると遺伝子異常と表現型が矛盾しているように見えてしまう.何かの遺伝子に変異を見つけただけではなくて,その変異によって蛋白に「どのような機能異常が生じ」,その結果「4つのステップのどこにどのような影響が生じるのか」をきちんと解析し解釈することが,病理病態を理解する上で重要である.多くの報告論文でこの作業を欠いていることは誠に残念なことである.加えて,上述してきたコア・モデュールの構成分子に対するヒト臓器錯位症候群例における臨床的解析データも不足していると言わざるを得ず,動物モデルで得られた知見とヒトの臓器錯位症候群症例で得られる遺伝子変異の情報を如何にして有機的に統合していくのかは,今後の大きな課題である.次世代シークエンサーが登場して以来,ヒトの臨床遺伝学解析が新たにエキサイティングな展開を見せている昨今,今後の知見の蓄積には大いに期待したい.
興味深い例として,米国で先に行われたヒトの先天性心疾患における網羅的ゲノム変異探索プロジェクトで,Nodalシグナルに関わる因子が多く検出されている65).このことは,左右軸とは独立したまだ知られていないNodalの心臓形態形成に果たす機能の可能性を示唆する.実際に,Nodalシグナルの低形質アレル・マウスの解析でも,左右性の異常は生じないがVSD等の心奇形が観察されている47).一方で,実は臓器錯位症候群を発生する素地(Nodalシグナルの異常)が存在するが,左右性は大きな影響を運良く受けず心臓の形態形成のみに異常が生じた症例は,我々が思っている以上に多いのかもしれない.議論してきた通り,我々が臨床で経験できる症例は胚性致死のケースがほぼ除外されているため,バイアスがかかっている.モデル動物で得られた知見を,ヒト症例に即して解釈するには,このことも念頭においておくべきであろう.もちろん,ヒトにおいては遺伝学的バックグラウンドの多様性が事態を更に複雑にすることに加え,ヒトと齧歯類における本質的な違いが潜んでいる可能性もあり,ヒトとマウスの結果が必ずしも一致するとも限らないことにもあえて言及しておきたい.
マウスでのNodalとLefty1/2の非対称性の発見から今年で21年が経ったが,まだまだ臓器錯位の背後にある病理病態機構と生理学的意義に関して不明な点が多い.今までは基礎生物学者たちがこの分野の発展の中心を担ってきたが,実際の症例を経験してきた医師たちが,もっと基礎科学的研究に参画し,臨床的視点よりモデル動物から得られたデータと臨床遺伝学的データを吟味し実際の症例を検討する作業が,より病理病態の理解を深めるのに今後はますます重要である.上述した如く,ゲノム研究が花盛りの今こそ,臨床遺伝学的解析を更に発展させる必要がある.本稿に拠って,多くの循環器小児科医や心臓血管外科医が刺激を受け,臓器錯位症候群の基礎研究に参入してくだされば幸いである.今後の研究により,更に私たちの理解が深まることを祈念したい.最後に,濱田博司教授(現理研神戸CDBセンター長)が率いる我が国の研究グループが,世界的にこの分野を牽引してきたことを申し添えたい.
利益相反
本論文について,開示すべき利益相反(COI)はない.
引用文献References
1) Hummel KP, Chapman DB: Visceral inversion and associated anomalies in the mouse. J Hered 1959; 50: 9–13
2) Levin M, Johnson RL, Stern CD, et al: A molecular pathway determining left-right asymmetry in chick embryogenesis. Cell 1995; 82: 803–814
3) Collignon J, Varlet I, Robertson EJ: Relationship between asymmetric nodal expression and the direction of embryonic turning. Nature 1996; 381: 155–158
4) Lowe LA, Supp DM, Sampath K, et al: Conserved left-right asymmetry of nodal expression and alterations in murine situs inversus. Nature 1996; 381: 158–161
5) Meno C, Saijoh Y, Fujii H, et al: Left-right asymmetric expression of the TGF beta-family member lefty in mouse embryos. Nature 1996; 381: 151–155
6) Meno C, Ito Y, Saijoh Y, et al: Two closely-related left-right asymmetrically expressed genes, lefty-1 and lefty-2: Their distinct expression domains, chromosomal linkage and direct neuralizing activity in Xenopus embryos. Genes Cells 1997; 2: 513–524
7) Nakamura T, Hamada H: Left-right patterning: Conserved and divergent mechanisms. Development 2012; 139: 3257–3262
8) Hamada H, Tam PP: Mechanisms of left-right asymmetry and patterning: Driver, mediator and responder. F1000Prime Rep 2014; 6: 110
9) Shiratori H, Hamada H: TGFbeta signaling in establishing left-right asymmetry. Semin Cell Dev Biol 2014; 32: 80–84
10) Yoshiba S, Hamada H: Roles of cilia, fluid flow, and Ca2+ signaling in breaking of left-right symmetry. Trends Genet 2014; 30: 10–17
11) Hamada H, Meno C, Watanabe D, et al: Establishment of vertebrate left-right asymmetry. Nat Rev Genet 2002; 3: 103–113
12) Smith JL, Schoenwolf GC: Getting organized: New insights into the organizer of higher vertebrates. Curr Top Dev Biol 1998; 40: 79–110
13) Oki S, Kitajima K, Marques S, et al: Reversal of left-right asymmetry induced by aberrant Nodal signaling in the node of mouse embryos. Development 2009; 136: 3917–3925
14) Nonaka S, Tanaka Y, Okada Y, et al: Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein. Cell 1998; 95: 829–837
15) Nonaka S, Shiratori H, Saijoh Y, et al: Determination of left-right patterning of the mouse embryo by artificial nodal flow. Nature 2002; 418: 96–99
16) Afzelius BA: A human syndrome caused by immotile cilia. Science 1976; 193: 317–319
17) Essner JJ, Vogan KJ, Wagner MK, et al: Conserved function for embryonic nodal cilia. Nature 2002; 418: 37–38
18) Supp DM, Witte DP, Potter SS, et al: Mutation of an axonemal dynein affects left-right asymmetry in inversus viscerum mice. Nature 1997; 389: 963–966
19) Supp DM, Brueckner M, Kuehn MR, et al: Targeted deletion of the ATP binding domain of left-right dynein confirms its role in specifying development of left-right asymmetries. Development 1999; 126: 5495–5504
20) Murcia NS, Richards WG, Yoder BK, et al: The Oak Ridge Polycystic Kidney (orpk) disease gene is required for left-right axis determination. Development 2000; 127: 2347–2355
21) Vogel P, Read R, Hansen GM, et al: Situs inversus in Dpcd/Poll−/−, Nme7−/−, and Pkd1l1−/− mice. Vet Pathol 2010; 47: 120–131
22) Bataille S, Demoulin N, Devuyst O, et al: Association of PKD2 (polycystin 2) mutations with left-right laterality defects. Am J Kidney Dis 2011; 58: 456–460
23) Manning DK, Sergeev M, van Heesbeen RG, et al: Loss of the ciliary kinase Nek8 causes left-right asymmetry defects. J Am Soc Nephrol 2013; 24: 100–112
24) Semmo M, Kottgen M, Hofherr A: The TRPP subfamily and polycystin-1 proteins. Handb Exp Pharmacol 2014; 222: 675–711
25) Nonaka S, Yoshiba S, Watanabe D, et al: De novo formation of left-right asymmetry by posterior tilt of nodal cilia. PLoS Biol 2005; 3: e268
26) Shiratori H, Hamada H: The left-right axis in the mouse: From origin to morphology. Development 2006; 133: 2095–2104
27) Hashimoto M, Shinohara K, Wang J, et al: Planar polarization of node cells determines the rotational axis of node cilia. Nat Cell Biol 2010; 12: 170–176
28) Minegishi K, Hashimoto M, Ajima R, et al: A Wnt5 activity asymmetry and intercellular signaling via PCP proteins polarize node cells for left-right symmetry breaking. Dev Cell 2017; 40: 439–452
29) Bisgrove BW, Snarr BS, Emrazian A, et al: Polaris and Polycystin-2 in dorsal forerunner cells and Kupffer’s vesicle are required for specification of the zebrafish left-right axis. Dev Biol 2005; 287: 274–288
30) Yoshiba S, Shiratori H, Kuo IY, et al: Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2. Science 2012; 338: 226–231
31) Delling M, Indzhykulian AA, Liu X, et al: Primary cilia are not calcium-responsive mechanosensors. Nature 2016; 531: 656–660
32) Tanaka Y, Okada Y, Hirokawa N: FGF-induced vesicular release of Sonic hedgehog and retinoic acid in leftward nodal flow is critical for left-right determination. Nature 2005; 435: 172–177
33) Rodriguez Esteban C, Capdevila J, Economides AN, et al: The novel Cer-like protein Caronte mediates the establishment of embryonic left-right asymmetry. Nature 1999; 401: 243–251
34) Zhang XM, Ramalho-Santos M, McMahon AP: Smoothened mutants reveal redundant roles for Shh and Ihh signaling including regulation of L/R asymmetry by the mouse node. Cell 2001; 105: 781–792
35) Chazaud C, Chambon P, Dolle P: Retinoic acid is required in the mouse embryo for left-right asymmetry determination and heart morphogenesis. Development 1999; 126: 2589–2596
36) McGrath J, Somlo S, Makova S, et al: Two populations of node monocilia initiate left-right asymmetry in the mouse. Cell 2003; 114: 61–73
37) Levin M, Mercola M: Gap junction-mediated transfer of left-right patterning signals in the early chick blastoderm is upstream of Shh asymmetry in the node. Development 1999; 126: 4703–4714
38) Saijoh Y, Oki S, Ohishi S, et al: Left-right patterning of the mouse lateral plate requires nodal produced in the node. Dev Biol 2003; 256: 160–172
39) Oki S, Hashimoto R, Okui Y, et al: Sulfated glycosaminoglycans are necessary for Nodal signal transmission from the node to the left lateral plate in the mouse embryo. Development 2007; 134: 3893–3904
40) Tanaka C, Sakuma R, Nakamura T, et al: Long-range action of Nodal requires interaction with GDF1. Genes Dev 2007; 21: 3272–3282
41) Nakamura T, Mine N, Nakaguchi E, et al: Generation of robust left-right asymmetry in the mouse embryo requires a self-enhancement and lateral-inhibition system. Dev Cell 2006; 11: 495–504
42) Meno C, Takeuchi J, Sakuma R, et al: Diffusion of nodal signaling activity in the absence of the feedback inhibitor Lefty2. Dev Cell 2001; 1: 127–138
43) Sakuma R, Ohnishi Y, Meno C, et al: Inhibition of Nodal signalling by lefty mediated through interaction with common receptors and efficient diffusion. Genes Cells 2002; 7: 401–412
44) Shen MM: Nodal signaling: Developmental roles and regulation. Development 2007; 134: 1023–1034
45) Saijoh Y, Adachi H, Sakuma R, et al: Left-right asymmetric expression of lefty2 and nodal is induced by a signaling pathway that includes the transcription factor FAST2. Mol Cell 2000; 5: 35–47
46) Davies J: Using synthetic biology to explore principles of development. Development 2017; 144: 1146–1158
47) Vincent SD, Norris DP, Le Good JA, et al: Asymmetric Nodal expression in the mouse is governed by the combinatorial activities of two distinct regulatory elements. Mech Dev 2004; 121: 1403–1415
48) Meno C, Shimono A, Saijoh Y, et al: lefty-1 is required for left-right determination as a regulator of lefty-2 and nodal. Cell 1998; 94: 287–297
49) Yamamoto M, Mine N, Mochida K, et al: Nodal signaling induces the midline barrier by activating Nodal expression in the lateral plate. Development 2003; 130: 1795–1804
50) Shiratori H, Yashiro K, Shen MM, et al: Conserved regulation and role of Pitx2 in situs-specific morphogenesis of visceral organs. Development 2006; 133: 3015–3025
51) Hamada H, Meno C, Saijoh Y, et al: Role of asymmetric signals in left-right patterning in the mouse. Am J Med Genet 2001; 101: 324–327
52) Shiratori H, Sakuma R, Watanabe M, et al: Two-step regulation of left-right asymmetric expression of Pitx2: Initiation by nodal signaling and maintenance by Nkx2. Mol Cell 2001; 7: 137–149
53) Ai D, Liu W, Ma L, et al: Pitx2 regulates cardiac left-right asymmetry by patterning second cardiac lineage-derived myocardium. Dev Biol 2006; 296: 437–449
54) Kitamura K, Miura H, Miyagawa-Tomita S, et al: Mouse Pitx2 deficiency leads to anomalies of the ventral body wall, heart, extra- and periocular mesoderm and right pulmonary isomerism. Development 1999; 126: 5749–5758
55) Lin CR, Kioussi C, O’Connell S, et al: Pitx2 regulates lung asymmetry, cardiac positioning and pituitary and tooth morphogenesis. Nature 1999; 401: 279–282
56) Hecksher-Sorensen J, Watson RP, Lettice LA, et al: The splanchnic mesodermal plate directs spleen and pancreatic laterality, and is regulated by Bapx1/Nkx3.2. Development 2004; 131: 4665–4675
57) Shields MB, Buckley E, Klintworth GK, et al: Axenfeld-Rieger syndrome: A spectrum of developmental disorders. Surv Ophthalmol 1985; 29: 387–409
58) Gage PJ, Suh H, Camper SA: Dosage requirement of Pitx2 for development of multiple organs. Development 1999; 126: 4643–4651
59) Yashiro K, Shiratori H, Hamada H: Haemodynamics determined by a genetic programme govern asymmetric development of the aortic arch. Nature 2007; 450: 285–288
60) Welsh IC, Thomsen M, Gludish DW, et al: Integration of left-right Pitx2 transcription and Wnt signaling drives asymmetric gut morphogenesis via Daam2. Dev Cell 2013; 26: 629–644
61) Leigh MW, Pittman JE, Carson JL, et al: Clinical and genetic aspects of primary ciliary dyskinesia/Kartagener syndrome. Genet Med 2009; 11: 473–487
62) Andersen TA, Troelsen Kde L, Larsen LA: Of mice and men: Molecular genetics of congenital heart disease. Cell Mol Life Sci 2014; 71: 1327–1352
63) Ware SM, Peng J, Zhu L, et al: Identification and functional analysis of ZIC3 mutations in heterotaxy and related congenital heart defects. Am J Hum Genet 2004; 74: 93–105
64) Purandare SM, Ware SM, Kwan KM, et al: A complex syndrome of left-right axis, central nervous system and axial skeleton defects in Zic3 mutant mice. Development 2002; 129: 2293–2302
65) Zaidi S, Choi M, Wakimoto H, et al: De novo mutations in histone-modifying genes in congenital heart disease. Nature 2013; 498: 220–223