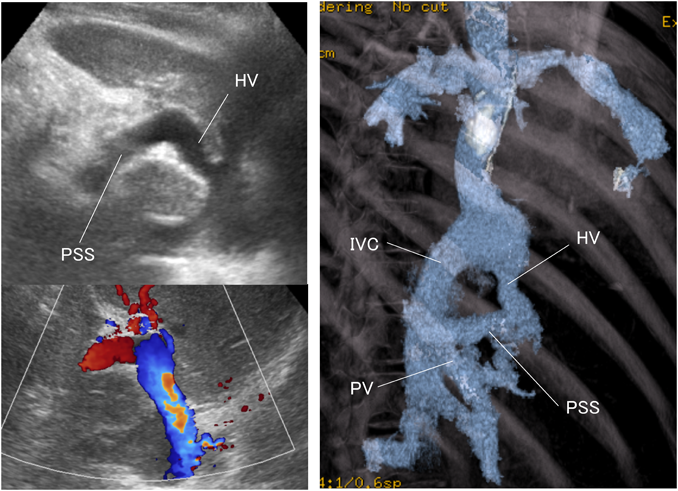
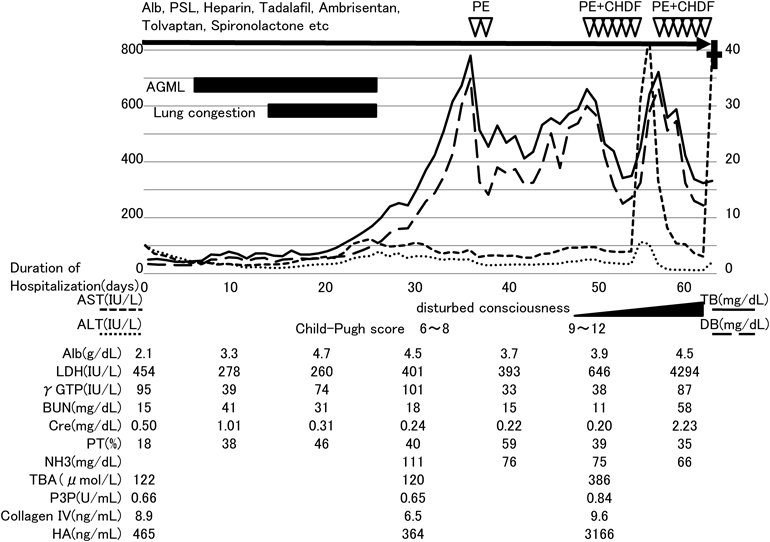
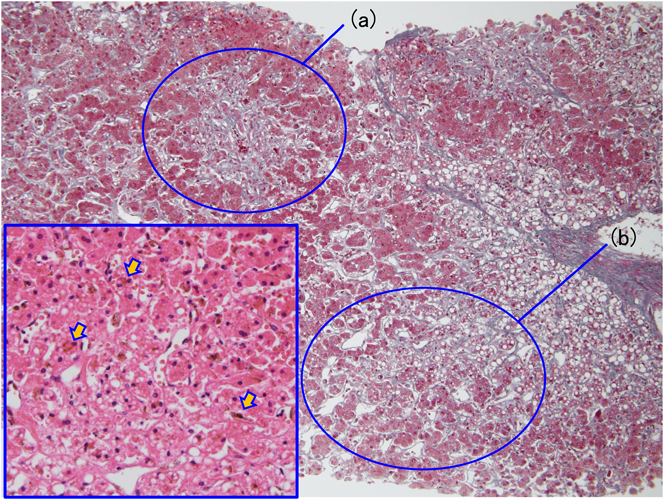
Fontan循環に併発したショック肝Shock Liver in Fontan Circulation
1 あかね会土谷総合病院小児科The Department of Pediatrics, Tsuchiya General Hospital ◇ Hiroshima, Japan
2 あかね会土谷総合病院心臓血管外科The Department of Cardiovascular Surgery, Tsuchiya General Hospital ◇ Hiroshima, Japan
3 済生会横浜市東部病院小児肝臓消化器科The Department of Pediatric Hepatology and Gastroenterology, Saiseikai Yokohama City Tobu Hospital ◇ Kanagawa, Japan