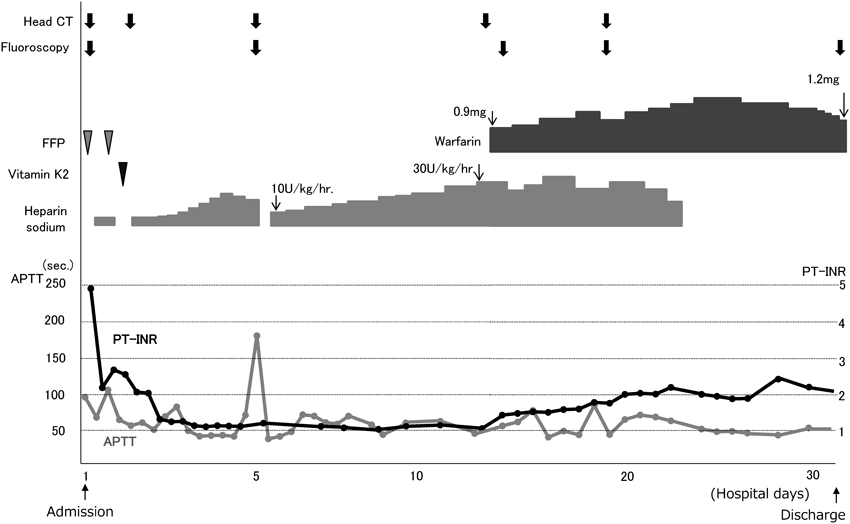
Warfarinを用いた経口抗凝固薬療法(OAT: oral anticoagulant therapy)は血栓形成の予防を目的に施行される.小児ではOATの対象となる人工機械弁挿入や心房性不整脈の有病率は高くないが,成人と同様にOAT適応の重要な位置を占めている1).一方,小児循環器領域特有の対象としてはFontan循環,Kawasaki病後巨大瘤が挙げられ,Fontan循環に関しては,OAT適応患者の20%を占めるという報告も見られる1).近年では手術技術や管理の向上によりFontan型手術に到達する単心室患者が増加していることから,今後対象患者数が増加する可能性が考えられる.
OAT施行患者においては,不完全な抗凝固による血栓症や人工機械弁の血栓弁は大きな合併症であるが,一方で出血性合併症も非常に大きな問題となる.中でも頭蓋内出血(ICH: intracranial hemorrhage)は致命的になり得るため,発生時には適切かつ速やかに対処し,血腫の増大を最小限に抑えなければならない.またいったんICHの止血に成功した後には,再出血させない安全性を図りつつ,本来の目的である血栓形成予防を再開していかなければならない.さらにこれらを同時に発症した際には凝固と抗凝固という,相反する作用要求を如何にコントロールするか熟考を迫られる.
ここではOAT施行中のICH,血栓弁の管理と,ICH後のOAT再開,およびICHと血栓弁を併発した際の管理について考察する.
頭蓋内出血(ICH)
我が国の4000例の成人を対象とした研究によると,ICHの発症率は抗血小板薬単独で0.27%/年,抗血小板薬複数で0.93%/年,Warfarin療法で0.62%/年,Warfarinと抗血小板薬併用で0.94%/年であった.複数の抗血小板薬投与もしくはWarfarinと抗血小板薬の併用で有意にリスクが増大するとされている2).この発症率はこれまでの欧米からの報告とほぼ同等で,成人でのICH自然発症リスクは0.1%/年であることを踏まえると,抗凝固療法下ではそのリスクが8~10倍に上ると考えられる3).小児ではOATの対象者が成人に比して少ないため,成人のような大規模研究は困難であるが,複数の報告によると小児患者のOAT関連ICHの発症リスクは0.63~1.46%/年となる4–6).
Warfarin内服中のICHでは,Prothrombin time international normalized ratio(PT-INR)の延長とICHの発症率に直接的な関連があるとする報告がある3, 7, 8).しかし一方でICHの多くが目標値領域(PT-INR 2.0–3.5)に管理されている状況下で生じていると指摘する報告もみられることから9–12),PT-INRが適切に管理されている場合でもICHのリスクを看過してはならない.
ICH発症から24~48時間以内に危急的状況に陥る率は,Warfarin投与群では47%と,非投与群の33%に比較して高かった3).またICH発症後3ヶ月以内の死亡率は,Warfarin投与群では52%と,非投与群の25.8%の2倍にのぼり13),Warfarin投与下のICHは非常に重篤であることが示されている.発症後の血腫の増大が予後と強く関連するとされており9, 11, 14),血腫の増大が見られた率は,非投与群の17%に対してWarfarin投与群では50%と非常に高かった9).かつWarfarin投与群においては,血腫の増大とPT-INRの延長の程度に明らかな関連が見られること11, 13, 15, 16),より早期にWarfarinが拮抗されていた例で血腫増大が少なかったこと14)から,PT-INR延長の程度がWarfarin投与下で発症したICHの予後に関連すると考えられる.したがってPT-INRを適正域に管理することはICHを発症した際の予後を不良にしないためにも重要であり,かつ発症後の予後改善には,血腫を増大させないよう早急にPT-INRを2.0未満に低下させる13–15)ことが必須である.また開頭手術は,PT-INRを1.5以下に低下させた後に施行すべきとされており9),これを踏まえても早急なWarfarin拮抗が不可欠である.Warfarinの半減期は36時間と長く,PT-INRが5以上であった場合,Warfarinの中止のみでは1.5まで低下するのに3日を要するため12),早急なWarfarin拮抗には積極的な介入が必須である.
以上は成人のデータを中心に述べられた見解である.小児においては,Warfarin関連ICHは各報告で1,2例と非常に少ないため,成人のように予後不良因子を見出すことは困難である.また,小児のWarfarin関連ICHは硬膜下血腫がほとんどであり4–6, 18, 19),脳実質出血も多くみられる成人とは様相が異なる面もあると考えられる.しかしながら血腫増大が予後不良につながること,Warfarinの拮抗が遅ければ血腫が増大することなどにおいて成人との差異があるとは考えにくく,成人と同様に早急かつ積極的介入を行うべきであろう.
Vitamin K
我が国の「循環器疾患における抗凝固・抗血小板療法に関するガイドライン」20)ではclass Iの治療になっているが(Table 1),早くても2~6時間,通常で12~24時間と作用に時間を要するため,血腫の増大阻止に効果的でなく,単独投与は適さない9, 14).
Table 1 How to manage hemorrhagic complications. Guidelines for the management of anticoagulant and antiplatelet therapy in cardiovascular disease (JSC, 2009)| Class I |
| 1. General emergency treatment for hemorrhagic complications. |
| 2. Under warfarin control: Stop or decrease the administration of warfarin, depending on the severity (moderate to severe) of the hemorrhagic complication, followed by administration of Vitamin K. |
| 3. Under heparin control: Stop or decrease the administration of heparin, depending on the severity of the hemorrhagic complication, followed by administration of protamine sulfate. |
| Class IIa |
| 1. In cases of immediate warfarin reversal: administer fresh-frozen plasma (FFP) or prothrombin complex concentrate (PCC). Although PCC is more effective than FFP, this is an unlabeled indication. |
| 2. Concomitant use of Vitamin K to avoid the rebound effect of warfarin that is reversed by PCC. |
| Class IIb |
| 1. In cases with immediate reversal of the warfarin’s effect: recombinant activated factor VII. |
| FFP: fresh-frozen plasma, JSC: Japanese Society of Cardiology, PCC: prothrombin complex concentrate. |
新鮮凍結血漿(FFP: fresh frozen plasma)
我が国のガイドラインではclass IIaの治療に該当する(Table 1)20).FFPの単独投与でも,2時間以内にプロトロンビン製剤複合体(PCC: prothrombin complex concentrate)投与時と同様のレベルまでWarfarinが拮抗された症例では,血腫の増大はPCCと同様に抑えられるが14),確実にWarfarinを拮抗するところまで十分量投与されることが必須である.FFPの投与量は発症時のPT-INRに応じて,Functional prothrombin complexの値を予測し目標値との差から体重あたりの量を計算する方法と,PT-INR≦2.0で15 mL/kg,2.0以上で15–30 mL/kgと設定する方法が提唱されている(Table 2)9, 16).しかしながらFFPではVitamin K依存性凝固因子の含有量が各製剤により大きく異なるため,FFP投与後にPT-INRをどのレベルまで低下させられるかを一概に予測できないという側面を有しており3),これらの計算方法によって割り出した投与量が十分量であるとは限らないということを認識しておく必要がある.実際には投与終了時にPT-INRを再検し,十分に低下していなければ速やかに追加することが必要である15).また早急なWarfarin拮抗のためには,短時間で目標量のFFPを投与することが要求されるが,十分量のFFPは必然的に容量が大きい.このため特に心負荷を基礎に有する患者や,不安定な血行動態に陥っている患者などでは,心血管系への容量負荷による血行動態の悪化,及びそれに起因する肺水腫などを招く恐れがあることに十分な注意を要する9, 16, 21).
Table 2 How to choose the dose of PCC or FFP for urgent warfarin reversal: calculated or fixed dose[13, 18)]| Calculated dose |
|---|
| INR value | Estimated functional PC | |
|---|
| ≧5 | 5% | |
| 4.0–4.9 | 10% | |
| 2.6–3.2 | 15% | |
| 2.2–2.5 | 20% | |
| 1.9–2.1 | 25% | |
| 1.7–1.8 | 30% | |
| 1.4–1.6 | 40% | |
| 1.0–1.3 | 100% | |
| Fixed dose |
|---|
| INR value | PCC dose (IU/kg) | FFP dose (mL/kg) |
|---|
| 1.5–2.0 | 20 | 15 |
| 2.0–4.0 | 30–40 | 15–30 |
| ≧4.0 | 50 | 15–30 |
INR: international normalized ratio, FFP: fresh-frozen plasma, PC: prothrombin complex, PCC: prothrombin complex concentrate.
Calculation of the dose: IU of PCC or mL of FFP needed to be infused = (Target % of PC to be reached−current estimated % of PC)×body weight (kg).
Example: Present INR 4.5 corresponding to estimated functional PC 10%. Target INR 1.4 corresponding to estimated functional PC 40%. Body weight 70 kg. IU needed to be infused=(40−10)×70=2100 IU of PCC or 2800 mL of FFP.
Example: Present INR 4.5. Body weight 70 kg. IU needed to be infused = 3500 IU of PCC or 1050−2100 mL of FF. |
プロトロンビン製剤複合体(PCC)
即効性があり,10~15分程度で効果が発現するため,Vitamin KやFFPより早急にWarfarinを拮抗することができる14, 22).我が国のガイドラインでも乾燥ヒト血液凝固第IX因子複合体(PCCと同等)(クリスマシン®)はclass IIaの治療に該当し,FFPより有効であるとされている(Table 1)20).また欧米各国のガイドラインでもFirst choiceの治療とされている(Table 3).成人に対して500単位を投与すると,2.0–10以上のPT-INRが10分以内に通常の正常範囲内まで低下される20).より確実を期すには15分後にPT-INRを再検し,不十分であれば追加する22).Warfarin拮抗に要する容量はFFPに比して格段に少ないため(500単位で5 mL),心血管系への負荷を懸念する必要がほとんどなく,心不全を有する症例にとっては大きな利点となる21).ただしPCCのみを投与した場合,いったん低下していたPT-INRは,凝固因子の半減期に応じて12~24時間後に再上昇する.これを抑制するために,Vitamin Kの同時投与が勧められている9, 20).しかしながら我が国では乾燥ヒト血液凝固第IX因子複合体の適応疾患は血液凝固第IX因子欠乏症のみであり,OATに関連するICHでは適応外使用となる.かつ,血液製剤であり,投与後の血栓・塞栓症の発生を懸念する報告もあるため20, 23, 24),投与にあたっては十分な注意を要する.
Table 3 Summary of recommendations for oral anticoagulant therapy reversal from the main international scientific societies[13)]| Scientific society | First choice (always in association with intravenous vitamin K1) | Second choice | Levels of evidence | Grade of recommendation |
|---|
| AHA | PCC or FFP | / | IIa | B |
| ACCP | PCC or FFP or rFVIIa | / | I | C |
| BSH | PCC | FFP | III | B |
| ASTH | PCC+FFP | / | Expert consensus | / |
| ESO | PCC | FFP | IV | / |
| FCSA | PCC | FFP | Expert consensus | / |
| SIMTI | PCC | FFP | II | C+ |
| ACCP: American Collage of Chest Physician, AHA: American Heart Association, ASTH: Australasian Society of Thrombosis and Haemostasis, BSH: British Society of Hematology, ESO: European Stroke Organization, FCSA: Federation of Centers for the Diagnosis of Thrombosis and the Surveillance of Antithrombotic Therapies, FFP: fresh-frozen plasma, PCC: prothrombin complex concentrate, rFVIIa: recombinant activated factor VII, SIMTI: Italian Society of Transfusion Medicine. |
また血液凝固第IX因子欠乏症の患者を診療していない施設では常備していない可能性もあるため,事前に施設内での備蓄状況を把握しておくことが望ましい.
遺伝子組み換え血液凝固第VII因子製剤(rFVIIa: recombinant activated factor VII)(ノボセブン®)
即効性があり,我が国のガイドラインではclass IIbの治療になっている20).投与量は10–50 µg/kg(0.01–0.05 mL/kg)で,容量負荷はPCCよりさらに少ない16, 20).しかし,rFVIIaはWarfarinによって抑制された第VII因子のみを補充するものであり,他の凝固因子は補正されないため,rFVIIaにより低下したPT-INRの値が,総凝固能をどれだけ正確に反映しているか定かではない16)点で注意を要する.また半減期は2.5時間と短く,PT-INRが早期に再上昇しやすいため,Vitamin KおよびFFPを併用するか,もしくはrFVIIaの反復投与が必要である16).rFVIIaは血栓塞栓症発症リスク増大因子とはならないとする主張もあるが21),一方で動脈性血栓塞栓症の発生率が上昇するという報告もあり25, 26),かつFood and Drug Administration(FDA)で認可されていないこと,さらには我が国では適応外使用(適応は先天性血友病の一部,後天性血友病,グラツマン血小板無力症)となること,高価であることを踏まえて適否を判断することが必要であろう.
なお遺伝子組み換え血液凝固第IX因子(ベネフィクス®)に関してのエビデンスは出ていない.
血圧コントロール
成人領域ではICH発症時にしばしば高血圧がみられ,予後に悪影響を与える可能性が指摘されている16, 27).これに基づきAmerican Heart Association(AHA)のガイドラインでは,自然発症のICHに関して,①収縮期血圧>200 mmHgまたは平均血圧>150 mmHgでは持続点滴による積極的な降圧,②収縮期血圧>180 mmHgまたは平均血圧>130 mmHgで頭蓋内圧上昇が疑われる場合には,頭蓋内圧をモニタリングし脳環流圧を>60–80 mmHgに維持するよう降圧,③収縮期血圧>180 mmHgまたは平均血圧>130 mmHgで頭蓋内圧上昇がない場合には,平均血圧110 mmHgもしくは収縮期/拡張期血圧160/90 mmHgを目標に緩徐に降圧することが提唱されている28).我が国のガイドラインでも収縮期血圧>180 mmHg,平均血圧>130 mmHgのいずれかが20分以上続く場合,降圧が勧められている29).いずれも成人を対象としたガイドラインであり,小児に関する明確な指針はない.小児では成人と異なり高血圧そのものがICH発症のリスク因子には挙げられていないが28),ICH発症時には高血圧を呈する症例が存在することが指摘されており18, 30),明らかな高血圧を認める場合には降圧を考慮すべきと考えられる.
肝機能障害
肝機能障害,特に肝硬変がある場合,それに起因する血液凝固因子低下を呈していることがあり,ICHの際に頭蓋内血腫増大のリスク因子になり得るとの指摘がある31, 32).この場合,より積極的なWarfarin拮抗が必要になる.循環器小児科領域のOAT対象疾患で,肝機能障害が問題になる疾患としてはFontan循環が代表的であるが,Fontan循環に見られる血液凝固能異常は血小板機能亢進,プロトロンビン活性亢進,フィブリン溶解低下などによる血栓形成促進が報告されている33).すなわち凝固作用低下よりむしろ凝固作用亢進が問題視される状態であり,これまでのところではFontan循環がICHの増悪因子になるとの指摘は見られない.
血栓弁
人工機械弁置換術後の血栓弁発症リスクは,術後1年以内が最も高く,弁位にかかわらず13%にのぼり34),決して低い数字ではない.
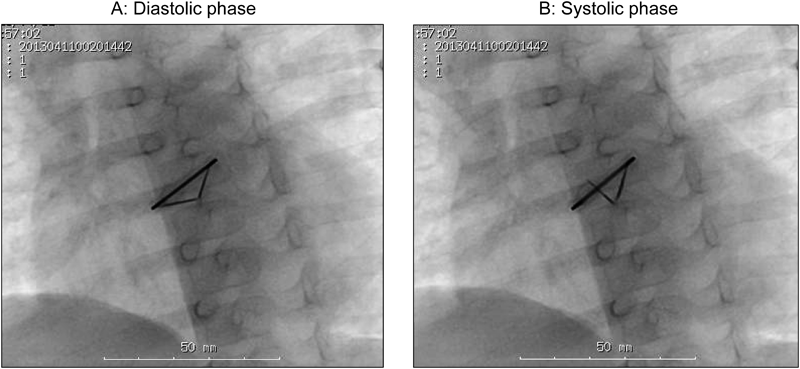
体格の小さい幼小児に対して機械弁置換を施行する場合,その後の成長により弁輪径は必然的に相対的狭小化をきたすため,手術時には可能な限り大きい径の機械弁を挿入することが想定される.先天性心疾患で,小児期に大動脈弁位への機械弁置換の対象となる疾患としては,重症大動脈弁狭窄症に加えて総動脈幹症が考えられるが,総動脈幹症では,大動脈弁として機能する弁輪の径が,正常の大動脈弁輪径より大きい.これは先述の成長の要素を考えるときには有利に思われる点であるが,機械弁では体格に対する弁輪径が大きいほど通過血流速度が遅くなり,血栓弁もしくは血栓症の頻度は高くなることが指摘されている35, 36).かつ,総動脈幹症では大動脈弁位が両心室にまたがる形態となり,左心室からの血流の方向が複雑で,それにより弁葉の開きが悪くなる可能性があり,これも血栓弁のリスクを増加させる一因となり得る.したがって総動脈幹症に対して大動脈弁位に機械弁を挿入した小児においては,血栓弁により注意を払う必要があると考えられる(Fig. 1).
人工弁機能不全が生じた場合,原因はパンヌス形成,血栓形成,パンヌスと血栓の混在が考えられるが,このうちOATが不適切であったことによる血栓弁が人工弁機能不全の主因を占めることから34),適切なOATが重要であることは言うまでもない.しかしながら現実には適切なOATを行っていたにもかかわらず血栓症・血栓弁を起こすことがある.血栓弁既往患者群では正常対象群に比して血小板の機能亢進が有意に認められたことから,血栓弁既往患者では抗血小板薬の併用を勧める報告もある37).我が国のガイドラインではPT-INR 2.0–3.0のWarfarin管理,およびAspirinまたはdipyridamoleの併用が勧められている(class II)20).
人工弁機能不全の原因が血栓形成である場合には,血栓溶解療法もしくは手術が適応となるが,パンヌス形成の場合には血栓溶解療法は全く無効であり,かつ血栓溶解療法に伴う重症出血が17~25%38, 39)にのぼることを考慮すると,血栓溶解療法を行うか否かの判断にはこれらの鑑別が重要である.発症前の抗凝固療法が不適切であった場合,弁挿入から短期間で発症した場合,狭窄による症状を有する場合には血栓が原因であることが多いとされている40).また,血栓弁の患者で血中Fibrinogenレベルが有意に高かったことが指摘されており,この点も人工弁機能不全の原因が血栓形成か否かを判断するうえで役に立つ指標になり得る41).一方パンヌスは機械弁のリングの上流側に線維性組織が増殖することによって形成されるため,血流の障害は生じても弁葉の開放に影響を与えない.つまり弁葉の開放制限があれば血栓の存在を疑う必要がある40).
左心系の機械弁で血栓弁を生じた際,手術介入と血栓溶解療法のいずれが優れているかに関しては,これまでのところ無作為試験は行われておらず,一定の結論は出ていない42).血栓弁解除の成功率は血栓溶解療法の約70~80%に対し,開心手術ではほぼ全例と,手術の方が明らかに成功率が高く,十分な機械弁の手術経験を持つ施設においては,緊急手術の成績は速やかな血栓溶解療法に引けを取らないとする意見がある42).しかしながら死亡率も開心手術の方が約2倍高いことから,手術のハイリスク患者には血栓溶解療法の導入を勧める向きも見られる34).
機械弁挿入患者おけるICHの管理
ICHにおいては前述の通り,早急なWarfarin中止および拮抗が必須であるが,Warfarin中止中に懸念される重大な合併症が血栓塞栓症,血栓弁であり,これを避ける管理も同時に要求される.Warfarin中止と積極的な拮抗に関連する短期的な血栓塞栓症リスクに関しては,その発生率が0~7%で16, 43, 44),成人でのOATに関連しないICHの脳梗塞発生率2~7%と有意差はないという報告がある43).しかしながら機械弁挿入の小児患者においては,OATを行わない場合の血栓塞栓症発生リスク5.7~27.3%/年に対し,OAT下では0~5.3%/年であることから,OAT非施行での血栓弁,血栓症のリスク増大は看過できないと考えられる45).成人では,総合的に見て早期にヘパリン導入を勧める意見が多い.Bertrumらは,いったん止血に成功した後にはOAT再開で再出血を来すことがなかったが,OAT中止中のヘパリンコントロールが不十分であった症例で血栓塞栓症を認めたことから,いったんWarfarinが拮抗されたのちには十分なヘパリン化,すなわちAPTTを基礎値の1.5~2倍に延長させることが必要であるとしている46).Butlerらは平均3日でヘパリンコントロールを開始し47),LekerらはPT-INRが1.5を下回った時点で,可及的速やかにAPTTを基礎値の1.5に延長させるようヘパリンコントロールを開始すべきとしている48).ただし,heparin-induced thrombocytopenia(HIT)を発症し,これにより新規の血栓弁を生じた報告も見られることから49),ヘパリンコントロールに際しては十分な注意が必要である.HITの発生は未分化ヘパリン投与例の約3%に見られ,特に心臓手術,整形外科手術例での発症が多い50, 51).一方,低分子ヘパリンではHITの発症が0.2~0.3%と有意に低く50, 51),海外では機械弁挿入後患者に対するWarfarin Bridgingとしての低分子ヘパリンの有用性も示されている52).また,機械弁挿入の小児における周術期管理に関する91施設の調査によると,「入院下で未分化ヘパリンを投与する」とした施設と,「外来で低分子ヘパリンを投与する」とした施設はほぼ半数ずつを占めていた53).ただし我が国ではいずれの低分子ヘパリンも,機械弁における血栓塞栓症の予防は適応外使用となる.
長期的にみて,ICH既往患者にOATを再開すべきか否かに関する明確な指針はこれまでのところ示されていない.しかしながら成人ではOAT中止による血栓塞栓症リスクは非弁性心房細動患者に比して,機械弁挿入患者では明らかに高いため,機械弁挿入患者ではOATを再開することの有益性はICH再発リスクを上回るとされ11, 16),目下のところいつ再開すべきかが論点となっている54).早期の再開を勧める意見はKawamataらによるもので,27例中12例(うち9例は開頭術後)に対して中止から3日以内にOATを再開したところ,再出血を1/12例,血栓塞栓症を1/12例に認め,3日後からの再開が可能であるとしている55).続いて1週間以内とするもの46, 47),1~2週間とするもの44, 56, 57),2~3週間以上とするもの58, 59)など,多岐にわたっているが,これらの報告の総覧に基づくと,ICHに対する早急な介入によりICHが十分制御されているという前提のもとで,1~2週間の中止後,再開を考慮することが妥当であるとされている3, 16, 54).なお,小児例ではヘパリンコントロールからWarfarinを導入する場合には,ヘパリンなしで導入する場合に比較して目標PT-INR値に達するまでの時間を要するとする報告もあるため19)留意を要する.
また,ICH既往患者に対してOATとAspirinもしくは他の抗血小板薬を併用するか否かに関しては,ICH再発を増大させる傾向にあり,一律に行うべきではないという見解がある16, 60).血栓弁既往など,血栓塞栓症のハイリスク患者に限って導入するなどの配慮が必要であろう.
ICHを有する患者の血栓弁管理
血栓弁に対する血栓溶解療法に関して,ICH既往患者に対する明らかなガイドラインはない.しかし我が国の急性冠症候群に関するガイドラインでは,ICHの既往(時期を問わず)は血栓溶解療法の絶対的禁忌/除外となっていることを考慮すると61),血栓弁に関してもICH既往例に対する血栓溶解療法は適当でないと考えることが妥当であろう.この場合,血栓弁が臨床的に血行動態に影響を及ぼしている症例では必然的に開心手術が要求される.開心手術では体外循環に伴う全身の積極的ヘパリン化が不可欠であるため,ICH後,どのくらいの期間をおくことが必要かが問題となる.AHAをはじめとした大規模グループのガイドラインによると,感染性心内膜炎にICHを合併した症例における体外循環下手術については,2週間以上の待機期間を設けることが薦められている62).一方で,出血性脳梗塞の発症後6日で体外循環下手術を施行し,ICHの拡大をきたさなかった報告もある63).当然のことながらICHに対しては待機期間が長い方が安全であるが,最終的には循環動態が待機可能な状態であるか否かを含めて決定する必要があろう.
引用文献References
1) Murray JM, Hellinger A, Dionne R, et al: Utility of a dedicated pediatric cardiac anticoagulation program: The Boston children’s hospital experience. Pediatr Cardiol 2015; 36: 842–850
2) Toyoda K, Yasaka M, Iwade K, et al: Dual Antithrombotic therapy increases severe bleeding events in patients with stroke and cardiovascular disease; A prospective, multicenter observational study. Stroke 2008; 39: 1740–1745
3) Thompson A: Management of intracranial bleeding in anticoagulated patients. Br J Med 2009; 70: 336–339
4) Tait RC, Ladusans EJ, El-Metaal M, et al: Oral anticoagulantion in pediatric patients: Dose requirementsand complications. Arch Dis Child 1996; 74: 228–231
5) Streif BW, Andrew M, Marzinotto V, et al: Analysis of warfarin therapy in pediatric patients: A prospective Cohort study of 319 patients. Blood 1999; 94: 3007–3014
6) Massiocotte P, Marzinotto V, Vegh P, et al: Home monitoring of warfarin therapy in children with a whole vlood prothrombin time monitor. J Pediatr 1995; 127: 389–394
7) Hart RG, Boop BS, Anderson DC: Oral anticoagulants and intracranial hemorrhage: Facts and hypotheses. Stroke 1995; 26: 1471–1477
8) Go AS, Hylek EM, Chang Y, et al: Anticoagulation therapy for stroke prevention in atrial fibrillation: How well do randomized trials translate into clinic practice? JAMA 2003; 280: 2685–2692
9) Masotti L, Napoli MD, Godoy DA, et al: The practical management of intracerebral hemorrhage associated with oral anticoagulant therapy. Int J Stroke 2011; 6: 228–240
10) Sjoblom L, Hardemark HG, Lindgren A, et al: Management and prognostic features of intracerebral hemorrhage during anticoagulant therapy: A Swedish multicenter study. Stroke 2001; 32: 2567–2574
11) Eckman MH, Rosand J, Knudsen KA, et al: Can patients be anticoagulated after intracerebral hemorrhage? A decision analysis. Stroke 2003; 34: 1710–171
12) Hylek EM, Go AS, Chang Y, et al: Effect of intensity of oral anticoagulation on stroke and mortality in atrial fibrillation. N Engl J Med 2003; 349: 1019–1026
13) Rosando J, Eckman MH, Knudsen KA, et al: The effect of warfarin and intensity of anticoagulation on outcome of intracranial hemorrhage. Arch Intern Med 2004; 164: 880–884
14) Huttner HB, Schellinger PD, Hartmannn M, et al: Haematoma growth and outcome in treated neurocritical care patients with intracerebral hemorrhage related to oral anticoagulation therapy. Stroke 2006; 37: 1465–1470
15) Yasaka M, Minematsu K, Naritomi H, et al: Predisposing factors for enlargement of intracerebral hemorrhage in patients treated with warfarin. Thromb Haemost 2003; 89: 278–283
16) Aguilar MI, Hart RG, Kase CS, et al: Treatment of warfarin-associated intracranial hemorrhage: Literature review and expert opinion. Mayo Clin Proc 2007; 82: 82–92
17) 河田幸波:経口抗凝固療法中の頭蓋内出血の治療.脳卒中の外科2003; 31: 54–60
18) Lo WD, Lee J, Rusin J, et al: Intracranial hemorrhage in children. Arch Neurol 2008; 65: 1629–1633
19) Lowry AW, Moffett BS, Moodie D, et al: Warfarin anticoagulation after congenital heart surgery at a large children’s hospital. Pediatr Cardiol 2012; 33: 1377–1382
20) 2008年度合同研究班(班長:堀 正二):循環器病の診断と治療に関するガイドライン:循環器疾患における抗凝固・抗血小板療法に関するガイドライン(2009年改訂版)http://www.jsts.gr.jp/guideline/contents00.pdf
21) Robinson MT, Rabinstein AA, Meschia JF, et al: Safety of recombinant activated factor VII in patients with warfarin0associated hemorrhages of the central nervous system. Stroke 2010; 41: 1459–1463
22) 吉田雄樹,大間々真一,枡一 毅,ほか:ワルファリン内服中の脳出血患者における急性期血腫増大と血液凝固第IX因子複合体投与の効果.The Mt.Fuji Workshop on CVD 2010; 28: 88–91
23) Fredriksson K, Norrving B, Stromblad LG: Emergency reversal of anticoagulation after intracerebral hemorrhage. Stroke 1992; 23: 972–977
24) Hellstern P, Halbmayer WM, Kohler M, et al: Prothrombin complex concentrates: indications, contraindications, and risks: A task force summary. Thromb Res 1999; 95 Suppl 1: S3–S6
25) Levi M, Levy JH, Anderson HF, et al: Safety of recombinant activated factor VII in randomized clinical trials. N Engl J Med 2010; 363: 1791–1800
26) Mayer SA, Burn NC, Begtrup K, et al: Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med 2008; 358: 2127–2137
27) Kuramatsu JB, Gerner ST, Schellinger PD, et al: Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracranial hemorrhage. JAMA 2015; 313: 824–836
28) Broderick JP, Adams HP Jr, Barsan W, et al: Guidelines for the management of spontaneous intravenous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke 1999; 30: 905–915
29) 脳卒中合同ガイドライン委員会(委員長:篠原幸人):1.脳梗塞急性期1-1.血栓溶解療法(静脈内投与).脳卒中ガイドライン2009; 48–50(ア)http://www.jsts.gr.jp/guideline/contents00.pdf
30) Al-Jarallah A, Al-Rifai MT, Riela AR, et al: Nontraumatic brain hemorrhage in children: Etiology and presentation. J Child Neurol 2000; 15: 284–289
31) Fujii Y, Takeuchi S, Tanaka R, et al: Liver dysfunction in spontaneous intracranial hemorrhage. Neurosurg 1994; 35: 592–596
32) Niizuma H, Suzuki J, Yonemitsu T, et al: Spontaneous intracerebral hemorrhage and liver dysfunction. Stroke 1988; 19: 852–856
33) Tomkiewicz-Pajak L, Hoffman P, Trojnarska O, et al: Abnormalities in blood coagulation, fibrinolysis, and platelet activation in adult patients after the Fontan procedure. J Thorac Cardiovasc Surg 2014; 147: 1284–1290
34) Charokopos N, Antonitsis P, Artemiou P, et al: Acute mechanical prosthetic valve thrombosis after initiating oral anticoagulation therapy. Is bridging anticoagulation with heparin required? Interact Cardiovasc Thorac Surg 2009; 9: 685–687
35) Tirilomis T: Acute thrombosis of mechanical bi-leaflet aortic valve prosthesis. J Cardiovasc Dis Res 2012; 3: 228–230
36) Fernandez J, Laub GW, Adikins MS: Early an dlate-phase events after valve replacement with the St. Jude Medical prosthesis in 1200 patients. J Thorac Cardiovasc Surg 1994; 107: 394–406
37) Bouganim T, Shapira Y, Sagie A, et al; Platelet reactivity in patients with a history of obstructive prosthetic valve thrombosis. Am J Cardiol 2009; 103: 1760–1763
38) Roudaut R, Lafitte S, Roudaut MF, et al: Fibrinolysis of mechanical prosthetic valve thrombosis a single-center study of 127 cases. J Am Coll Cardiol 2003; 4: 653–658
39) Tong AT, Roudaut R, Ozkan M, et al; Prosthetic Valve Thrombolysis-Role of Transesophageal Echocardiography (PRO-TEE) Registry Investigators: Transesophageal echocardiography improves risk assessment of thrombolysis of prosthetic valve thrombosis: Result of the international PRO-TEE registry. J Am Coll Cardiol 2004; 43: 77–84
40) Tanis W, Habets J, Brink RBA, et al: Differentiation of thrombus from pannus as the cause of acquired mechanical prosthetic heart valve obstruction by non-invasive imaging: A review of the literature. Eur Heart J 2014; 15: 119–129
41) Aykan AC, Gokdeniz T, Gunduz S, et al: Value of serum fibrinogen levels in the assessment of mechanical prosthetic valve thrombosis. J Heart Valve Dis 2014; 23: 222–227
42) Karthikeyan G, Senguttuvan NB, Joseph J, et al: Urgent surgery compared with fibrinolytic therapy for the treatment of left-sided prosthetic heart valve thrombosis: A systematic review and meta-analysis of observational studies. Eur Heart J 2013; 34: 1557–1566
43) Goldstein JN, Fazen LE, Wendell L, et al: Risk of thromboembolism following acute intracranial hemorrhage. Neurocrit Care 2009; 10: 28–34
44) Phan TG, Koh M, Wijdicks EF: Safety of discontinuation of anticoagulation in patients with intracranial hemorrhage athigh thrombolic risk. Arch Neurol 2000; 57: 1710–1713
45) Monagle P, Chan A, Massicotte P, et al: Antithrombic therapy in children. Chest 2004; 126 Suppl: S645–S687
46) Bertram M, Bonsant M, Hacke W, et al: Managing the therapeutic dilemma: Patients with spontaneous intracranial hemorrhage and urgent need for anticoagulation. J Neurol 2000; 247: 109–214
47) Butler AC, Tait RC: Restarting anticoagulation in prosthetic heart valve patients after intracranial haemorrhage: A 2-year folloe-up. Br J Haematol 1998; 103: 1064–1066
48) Leker RR, Abramsky O: Early anticoagulation in patients with prosthetic heart valves and intracerebral hematoma. Neurol (Tokyo) 1998; 50: 1489–1491
49) Higa T, Okura H, Tanemoto K, et al: Prosthetic valve thrombosis caused by heparin-indused thrombocytopenia thrombosis during pregnancy. Circ J 2014; 78: 1004–1005
50) Girolami B, Prandinii P, Stefani PM, et al: The incidence of heparin-induced thrombocytopenia in hospitalized medical patients treated with subcutaneous unfractionated heparin: A prospective cohort study. Blood 2003; 101: 2955–2959
51) Martel N, Lee J, Wells PS: Risk for heparin-induced thrombocytopenia with unfractionated and low-molecular-weight heparin thromboprophylaxis: A meta-analysis. Blood 2005; 106: 2710–2715
52) Fanikos J, Tsilimingras K, Kucher N, et al: Comparison of efficacy, safety, and cost of low-molecular-weight heparin with continuous–infusion unfractionated heparin for initiation of anticoagulation after mechanical prosthetic valve implantation. Am J Cardiol 2004; 93: 247–250
53) Nguyen N, Sharathkumar A: Current perioperative anticoagulation practices in children with prosthetic mechanical heart valves. Congenit Heart Dis 2015; 10: E210–E215
54) Chandra D, Gupta A, Grover V, et al: When should you restart anticoagulation in patients who suffer an intracranial bleed who also have a prosthetic valve? Interact Cardiovasc Thorac Surg 2013; 16: 520–524
55) Kawamata T, Takeshita M, Kubo O, et al: Management of intracranial hemorrhage associated with anticoagulant therapy. Surg Neurol 1995; 44: 438–443
56) Wijdicks EFM, Schievink WI, Brown RD, et al: The dilemma of discontinuation of anticoagulation therapy for patients with intracranial hemorrhage and mechanical heart valves. Neurosurg 1998; 42: 769–773
57) Punthakee X, Doobay J, Anand SS: Oral-anticoagulant-related intracerebral hemorrhage. Thromb Res 2002; 108: 31–36
58) Ananthasubramaniam K, Beattie JN, Rosman HS, et al: How safely and how long can Warfarin therapy be withheld in prosthetic heart valve patients hospitalized with a major hemorrhage? Chest 2001; 119: 478–484
59) Babikian VL, Kase CS, Pessin MS, et al: Resumption of anticoagulation after intracranial bleeding in patients with prosthetic heart valves. Stroke 1988; 19: 407–408
60) Hart RG, Benabente O, Pearce LA, et al: Increased risk of intracranial hemorrhage when aspirin is combined with warfarin: A meta-analysis and hypothesis. Cerebrovasc Dis 1999; 9: 215–217
61) 2012年度合同研究班(班長:木村一雄):循環器病の診断と治療に関するガイドライン:ST上昇型急性心筋梗塞の診療に関するガイドライン(2013年改訂版)http://www.j-circ.or.jp/guideline/pdf/JCS2013_kimura_h.pdf
62) Baddour LM, Wilson CW, Bayer AS, et al: AHA scientific statement. Infective endocarditis. Diagnosis, antimicrobial therapy, and management of complications. A statement for healthcare professionals from the committee on rheumatic fever, endocarditis, and Kawasaki disease, council on cardiovascular disease in the young, and councils on clinical cardiology, stroke, and cardiovascular surgery and anesthesia, American Heart Association. Circulation 2005; 111: e394–e433
63) 朴 昌禧,武田崇秀,坂口仁寿:出血性脳梗塞を合併した三尖弁感染性心内膜炎に対する弁置換術.胸部外科 2014; 67: 211–214
64) The Joint Commission: National Patient Safety Goals Effective January 1, 2014. http://www.visimobile.com/wp-content/uploads/2014/05/2014-National-Patient-Safety-Goals.pdf
65) Jones S, Newall F, Manias E, et al: Assessing outcome measures of oral anticoagulation management in children. Thromb Res 2011; 127: 75–80
66) Mahle WT, Simpson SA, Fye P, et al: management of warfarin in children with heart disease. Pediatr Cardiol 2011; 32: 1115–1119

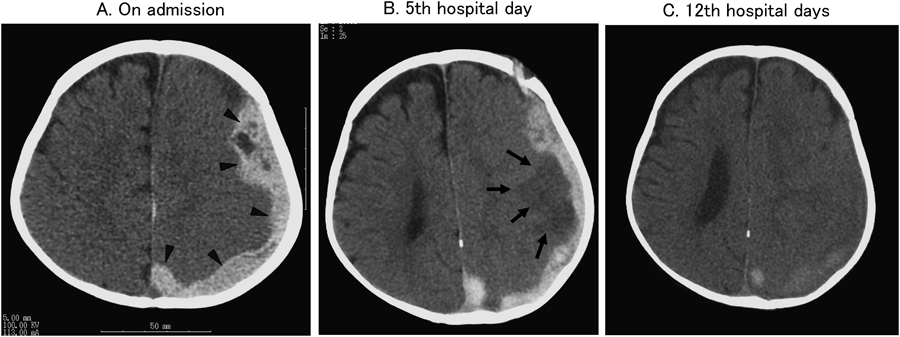
 ). Mild midline shift and disappearance of the sulcus were observed. B: Although subdural hematoma diminished, a new cerebral infarction was found (
). Mild midline shift and disappearance of the sulcus were observed. B: Although subdural hematoma diminished, a new cerebral infarction was found ( ). C: The subdural hematoma was almost completely absorbed.
). C: The subdural hematoma was almost completely absorbed.