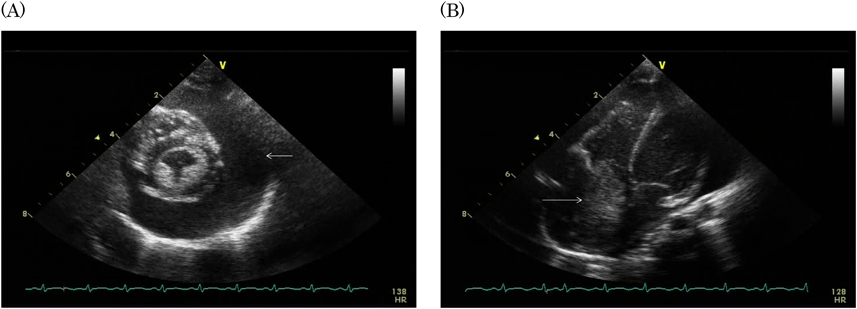
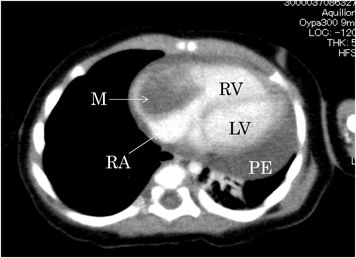
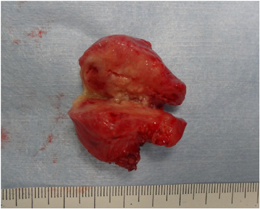
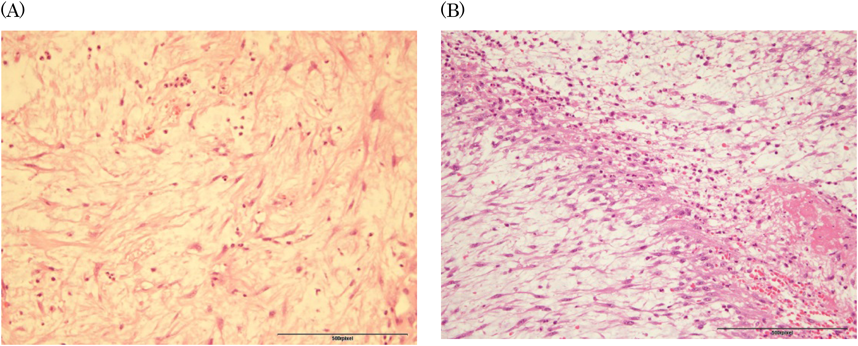
右房内に発生した炎症性筋線維芽細胞腫の乳児例Inflammatory Myofibroblastic Tumor of the Right Atrium in an Infant
若宮 卓也1,志水 直1,中野 裕介1,鉾碕 竜範1,岩本 眞理1,合田 真海2,町田 大輔2,磯松 幸尚2,益田 宗孝2Takuya Wakamiya1, Nao Shimizu1, Yusuke Nakano1, Tatsunori Hokosaki1, Mari Iwamoto1, Masami Gouda2, Daisuke Machida2, Yukihisa Isomatsu2, Munetaka Masuda2
1 横浜市立大学附属病院小児循環器科Department of Pediatric Cardiology, Yokohama City University School of Medicine ◇ Kanagawa, Japan
2 横浜市立大学附属病院心臓血管外科Cardiovascular Surgery, Yokohama City University School of Medicine ◇ Kanagawa, Japan
受付日:2016年3月3日Received: March 3, 2016
受理日:2016年5月12日Accepted: May 12, 2016
発行日:2016年7月1日Published: July 1, 2016