単心室血行動態の最終修復であるフォンタン手術後患児が増加し,その多くは成人期を迎えようとしている.その特異な血行動態に由来する病態は循環器疾患領域を超え,肝腎,消化器,代謝,内分泌異常といった多臓器障害を伴うことは明らかとなってきている.手術後早期の小児期と術後遠隔期の成人期では,その病態が刻々と変化し,したがって,その管理法もこれら病態に沿った対応,戦略でなければならない.これら患者では非心臓関連の臨床事故発生の頻度が他の先天性心疾患術後患者に比較し高いことが明らかとなりつつあるが,その病態の詳細はいまだ不明な点が多い.したがって,患者の最終的な生活QOL向上には,この特異な循環に関連する心血管系に加えて,多臓器システムを含んだ複雑な病態の把握することが重要となってきている.
フォンタン術後成績の変遷:フォンタン患者の増加
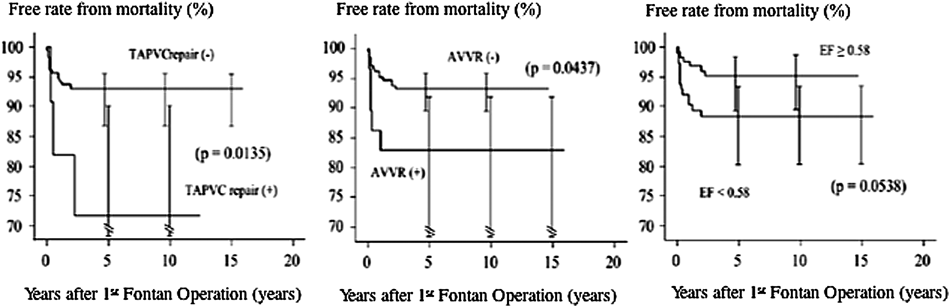
フォンタンの術後成績は世界的に著明に改善しており1),当院での成績も例外ではない2).術式の工夫や周術期の管理向上といった医療水準の向上がフォンタン術後の生命予後改善に大きく寄与している(Fig. 1).しかしながら,総肺静脈還流異常,房室弁閉鎖不全,心機能低下などはいまだに予後悪化の危険因子であるが,臓器錯位症候群の成績も向上しもはや危険因子とならない時代となっている(Fig. 2).さらに,APCの遠隔期の不利な点を除くべくTCPC転換術が施行されてきた.しかしながら,最近では術後30年を超える症例が増加しつつあり,当初は予測しなかった様々なフォンタン循環の不都合な側面が目立つ症例が増加している現状に直面している.
フォンタン患者の身体活動能力:運動負荷試験との出会い
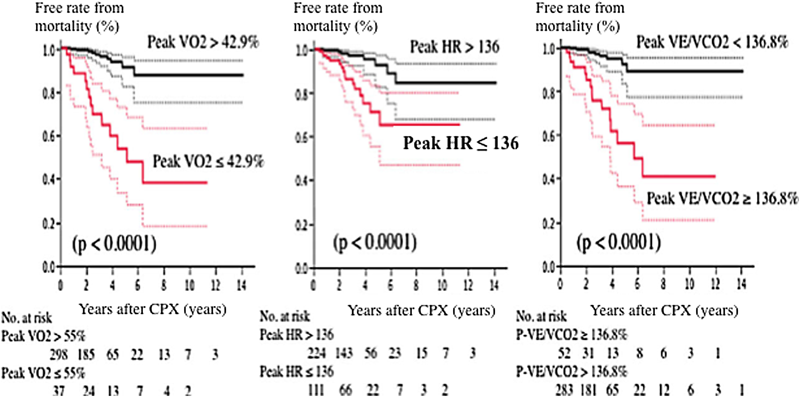
心肺機能の維持は術後QOL向上に極めて重要である.心肺運動負荷試験(CPX)は,この総合的な心肺機能評価法として極めて優れている.心肺機能は生体の様々なシステムを動員した結果であり,心血管の重症度評価に優れ,予後と密接に関わっている3)(Fig. 3).
CPXが心肺能力評価に有用であることの一つに最高酸素摂取量(peak VO2)を測定することが含まれる.自覚的最大負荷が必要であり,重症患者での最大負荷の懸念から亜最大で心肺能力を知る指標が求められた.この指標の一つが嫌気性代謝閾値(AT)であり,この決定に有用な運動負荷プロトコールの開発を試み臨床的有用性を報告した4).このプロトコールは重症患者や小児にも適用可能でATの検出率も高い.生体ではATの運動強度以上で代謝性アシドーシスの進行により乳酸やカテコラミンが上昇することから持続した運動が困難とされている.したがって,AT時の運動強度以下での運動が心不全悪化や不整脈誘発が少ないとされ,この運動強度でのいわゆる心臓リハビリテーションが推奨されている.実際にはCPXでATレベルの心拍数を求め運動処方することとなる.我々はこのようなATレベルの運動強度による心臓リハビリテーションの有効性を報告している5).
はたして,このCPXが他の二心室修復後CHD患者とフォンタン術後患者との大きな相違を特色づけ,どのようにその評価,診療に情報を提供できるだろうか?
他のCHD患者の心不全との類似性:心不全患者でのCPX指標の異常の共通点は心拍数応答低下,血圧上昇異常,peak VO2低下,そして換気応答異常が主である.これらに疾患特異性はなく,心不全病態に依存し,したがってこれら指標はフォンタン患者と他のCHD術後患者を区別しない.特異なフォンタン患者でのCPXの予後推定の役割に一定の限界が報告された6).しかし,これらCPX指標はフォンタン循環の心不全病態と強く関連し,したがって予後予測因子としての役割は大きく,フォンタンでも同様であることを我々が初めて示した7)(Fig. 3).
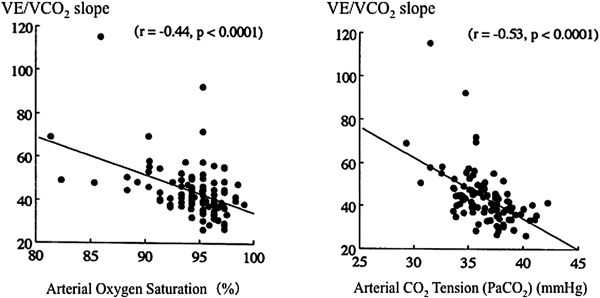
他のCHD患者の心不全との違い:フォンタン循環を特色づける病態として高い中心静脈圧(CVP),低心拍出量に加えて,軽度な低酸素血症がある8).低酸素血症は通常の心不全患者には見られない病態でフォンタン患者を特色づける一つと言える.二酸化炭素換気当量(VE/VCO2)上昇や換気量と二酸化炭素排泄量(VCO2)の傾き(VE/VCO2 slope)で表現される換気亢進は心不全患者で見られる共通の病態であるが,一般の二心室修復での換気亢進の機序は肺鬱血を反映した肺コンプライアンスの低下に起因するrapid-and-shallow呼吸による死腔率増加に加えて中枢性の二酸化炭素感受性亢進によるとされる9).フォンタン患者でも一般心不全患者と同様に換気亢進はみとめられるが10),これら患者との大きな相違は低酸素血症が換気亢進に大きく関与していることにある8)(Fig. 4).したがって,フォンタン術後患者でのVE/VCO2 slopeの心不全重症度との関連はpeak VO2に比べ劣るのが一般的と言える.換気量とVO2の関係を示すOxygen uptake efficiency slope(OUES)などのフォンタン術後患者の換気指標の解釈についても同様に十分に注意する必要がある11).
フォンタン術後の経過:何故事故が多い?
他のCHD術後患者に比べ術後死亡を含めた合併症が多く,術後経過に伴いその頻度は増加することが多く報告されている12–14).これらの事実はフォンタン循環の限界を示すものであるが,その原因は明確でないのが現状である.限界の原因について以下の病態について検討してきた.
1)心室形態の影響
左室と右室の差については多くの研究がある.我々は心肺機能の側面から体心室形態の差の運動耐容能への検討を行った結果,体心室として右室は不利で,peak VO2が低いことに加えて,右室が体心室である患者では経時的な運動耐容能の低下が観察された15).しかしながら,手術年齢も大きく運動耐容能に影響することも明らかで,低酸素の解除に加えて,体心室の容量負荷軽減が早いほど運動耐容能が高い可能性が示唆されている.最近の我々の検討ではこの手術の低年齢化のためか,早期の容量負荷軽減により体心室形態による運動耐容能の差は大きくない可能性が示唆されている.一方,運動耐容能から見た手術の最適年齢については2歳までの手術が良いとされるが15, 16),さらに低年齢化が良いのかはいまだ議論のあるところである.
2)呼吸の影響
肺駆出ポンプのない肺循環のガス交換への影響を検討した報告は多い.当初より肺駆出ポンプの欠如により換気に見合う血流供給が不足し換気血流不均等が注目された17, 18).一般心不全患者では鬱血肺のため一回換気量が充分でないいわゆるrapid-and-shallow呼吸を呈するが,この減少はフォンタン患者では観察されないことから,この死腔効果のみでフォンタン患者の換気亢進を説明するのは困難と考えた19).欧米からの報告では呼気ガスのみの解析で異常な肺循環のガス交換の検討には限界があった.そこで我々は直接,運動中の動脈ガス分析と呼気ガス分析を同時に解析することでその病態を明らかとした.すなわち,運動中の死腔率改善は対照より明らかに悪く,確かにフォンタン術後患者の換気亢進の一因であることは確認した.しかし,我々は軽度ではあるが明らかに低酸素血症を認めこれが換気亢進の大きな原因となっていることを初めて示した.この恒常的な換気亢進は軽度の動脈二酸化炭素分圧低下の原因であり,この低下は運動中の換気亢進の持続に密接に関わっていることを示した8).したがって,VE/VCO2 slopeのフォンタン患者での重症度評価には限界があるのは当然と考えられる.しかしながら,慢性心不全の病態を併せ持つことから,成人で重要とされる中枢性の換気亢進機序も働いている可能性がある.そこで我々は二酸化炭素再呼吸法により二酸化炭素感受性を測定したところ約25%の患者,特に成人フォンタン患者で感受性亢進が確認された10).すなわち,フォンタン患者の呼吸病態を知るには,一般的慢性心不全病態と特殊なフォンタン循環の組み合わせから十分に注意した解釈が必要であることを示すものであった.最近ではさらに体静脈肺静脈短絡や肝疾患の影響を考慮する必要がありさらに複雑な病態であると言える.我々はVE/VCO2 slopeと同等の意味を持つ最高負荷時のVE/VCO2がフォンタン患者の予後推定に有用であることを示した7).このことは,フォンタン患者でのVE/VCO2上昇(換気効率低下)は肺内ガス交換異常に加えて低酸素血症をきたす病態がこの特異な循環の重症度と密接に関わっていることを示すものと考えている.
3)術式の影響
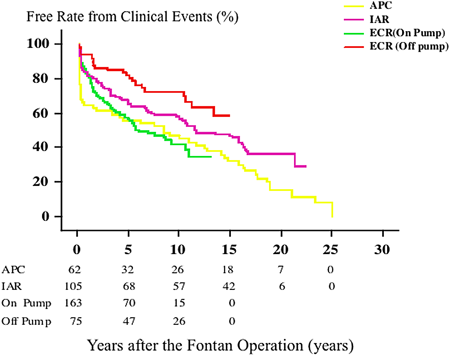
APCがTCPCに比べその不整脈の頻度や血栓形成の面から明らかに劣り,またECRがIARよりその術後予後は良い傾向にある20).しかし,IARとECRの優劣は必ずしも明確でない.我々の検討では運動耐容能の面ではAPCとTCPCに差はなく,また,IARとECRにも明らかな差がないと言える15, 21).最近では心臓MRIより流体力学的な評価が可能となりフォンタンルートのデザインと運動耐容能との関連が報告されている22).運動耐容能に対し明らかに良い影響があればそのデザインはフォンタン患者の予後に影響する可能性があり今後の発展が期待できるかもしれない.ただ,我々の施設で試みているoff-pumpフォンタン術は術後の臨床事故が少ない.これは,off-pumpが可能であることが,房室弁操作等を必要としない元来条件の良い病態にあるのか,あるいはやはりoff-pumpによる周術期の心筋障害の軽減が予後改善に繋がっているかは現時点では不明である.しかしながら,各術式の周術期を除いた遠隔期の成績ではその臨床事故の頻度にほとんど差がないのはやはりフォンタン循環の限界を示していると考えられる(Fig. 5).
4)心臓自律神経の影響:俊敏な心拍応答の欠如
一般に成人の非CHD患者での心臓自律神経活動(CANA)の異常,すなわち,副交感神経活動低下と交感神経活動亢進は心不全患者の病態や重症度と密接に関連し,強力に予後と関連している23, 24).しかし,これらの事実や概念がCHD術後患者に適用可能か否かについては不明であった.我々の検討から多くのCHD患者では術後のCANAは異常であり,心不全の病態に加えて手術侵襲による除神経の影響が大きいことを明らかとした25, 26).特に手術回数の多い重症患者では心拍変動(HRV),動脈圧受容体反射感受性(BRS)そして心臓交換神経を評価したMIBG所見などのCANA指標が異常であった.これらのCANA異常,特にHRVやBRSは副交感神経活動と密接に関連し,これら異常(低下)は心拍応答低下に大きく影響していることを明らかとした27).したがって,心不全の重症度に加えて心拍応答が低下しており,無症状であるものの,これらのCANA異常が運動耐容能低下の大きな要因となっている.さらには,洞機能異常と相まって27),これら患者の本来であれば頻拍で対応しなければならない脱水や低心拍出量の病態に対する循環維持機構が破綻しやすいことが推察される.
この事実はフォンタン術後にも当てはまるが,手術侵襲以上に心不全病態に加え,フォンタン循環そのものがCANA異常の原因となっていることが推察された28).このフォンタン患者でのCANA異常の程度は大きく,興味深いことにこれら異常が,二心室修復されたCHD患者とは異なりフォンタン患者の臨床症状とあまり関連しないことである.例えば,HRVの高周波成分がほとんどないにもかかわらず患児は全く無症状であることはよく経験される.このような患者では何らかの病態管理で心拍数上昇が必要な場合にはアトロピンによる心拍上昇は見込めず,イソプロテレノロールやペーシング法に頼らざるを得ない.さらに,CANA異常が強いため(例えばHRVが極端に少ないなど),これらCANA指標の値の幅が小さくフォンタン患者の重症度を鋭敏に反映できない可能性がある.このCANA異常と臨床状態の乖離はこれらCANA指標の予後との関連を見ても明らかである.二心室修復患者ではHRVやBRSが成人非CHD患者と同様に予後推定に役立つのに比べ,フォンタン患者でのこれら指標の予後との関連はない29).しかし,これらの著明な異常はフォンタン循環を特色づけるものであることからさらに遠隔期での病態への関与を明らかにすることが必要と考える.
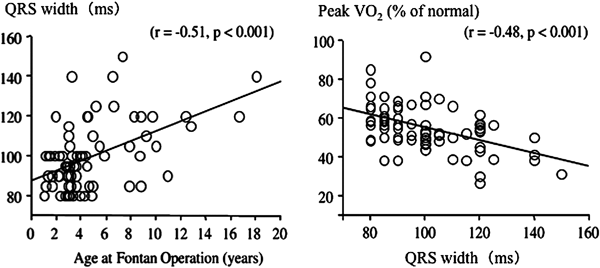
5)心室同期性の影響:幅広いQRSは要注意
最近の心不全診療における不全心室の電気解剖学的同期性の重要性が強調されている.実際に非同期が予後悪化と関連し,再同期療法は心不全患者の予後を改善することが報告されている30).これらの概念は単心室患者でも同様である可能性が報告されている31).我々は,体心室形態別のQRS間隔の推移を調べたところ,左室型のQRS幅が最も狭く,次いで右室,両心室型の順で拡大していることが示され,このQRS幅は,対照ほど程度は強くないが,心室容積と密接に関連していた32).しかし,興味深いことに術後早期のQRS幅は術前から狭くならず不変で,更に,術後10年目のQRS幅は手術年齢と関連していた.また,QRS幅はpeak VO2を規定している要因であることが明らかとなり32, 33)(Fig. 6),術後遠隔期の心室同期性の維持には早期の心室容量負荷軽減が重要であることを示唆していた.また,QRS幅が不整脈時の血行動態破綻との関連が強く示唆された34).特に,成人フォンタン患者で体心室の収縮性が低下した場合には,頻拍中の血圧低下が著しく,CVP上昇や交感神経賦活と強く関わっており,フォンタン患者での体心室同期性の重要性が明らかとなった.
6)難解な合併症
術後予後に密接に影響する合併症として,不整脈,蛋白漏出性胃腸症(PLE),血栓形成,肺動静脈瘻(PAVF),鋳型肺炎,肝機能障害,腎機能障害などがある.ここでは,その代表的な中で,PLEと血栓形成の合併症について述べたい.
a)PLE:低心拍出量ではなく高CVPが発症の原因術後遠隔期の4~13%に発症し,経年的に増加し,術後10および20年でPLE発症回避率は92および86%とされている35).我々の施設では2012年終了時に406例中26例(6.4%)のPLEを経験した36).PLE発症の明確な機序は不明であるが,これまでに高CVP,炎症,そして低心拍出量がその原因と推察されてきた.また,腸管血流の低下とPLE発症との関連も注目されている.しかし,我々の術後の経時的な血行動態評価の結果から非左室型体心室に加え,術後早期の高CVP,特に12(mmHg)以上が唯一のPLE発症危険要因であり,また,術前の機能的片肺循環も将来のPLE発症に密接に関わっていた.しかしながら,心拍出量と将来のPLE時発症には関連がなかった.さらに,PLE発症後の血行動態では低血圧が唯一のPLE血行動態の特色であった.これらの事実から,高い危険因子をもつ患者では,例えば片肺循環の患者へのフォンタン手術の適用は極力避けるべきであること,また,術後の高CVP,特に12(mmHg)を超えた患者ではたとえ無症状であってもあらゆる戦略でCVP低下に務めるべきであることを示唆する.また,PLE患者では高いCVPかつ低い体血圧であることから必然的に腸管貫流圧は低下し抵抗指標(resistive index)は悪化するのは必然の結果であり腸管動脈抵抗上昇がPLEの原因であるという可能性には疑問を残す37).さらに,以前から指摘されているように,我々の検討からPLE患者では不整脈(約30%)や血栓症(約20%)等他の合併症を併発し,発症前のフォンタン循環に問題を抱える場合が多いことが再確認された35, 36).また,CVPが上昇する原因としてPAVFの存在を新たに呈示した.PAVFの存在は低酸素血症に加え,前負荷増大に繋がり,高心拍出量状態からCVP上昇をきたしPLEの原因となっている可能性を初めて示した.
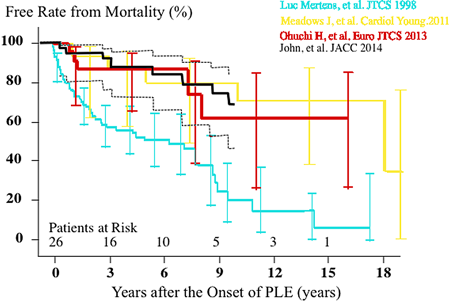
PLEの予後は5年生存率が50%と極めて不良であることが報告されて以降,様々な治療法が試行されてきた.その結果,我々の成績も含め世界的にPLE発症後の予後は改善してきている.最近の血管拡張薬の進歩による発症後予後は発症後5年の死亡回避率は80%以上と改善している38, 39).我々の5年生存率も約9割で10年生存率も約6割である36)(Fig. 7).このことは,以前はPLE発症後寛解の得られない症例では心臓移植の対象とされたが40, 41),現在では,これらの基準に再検討が必要で,加えてこのような重症な患者の遠隔期での管理が重要な課題となってきている.
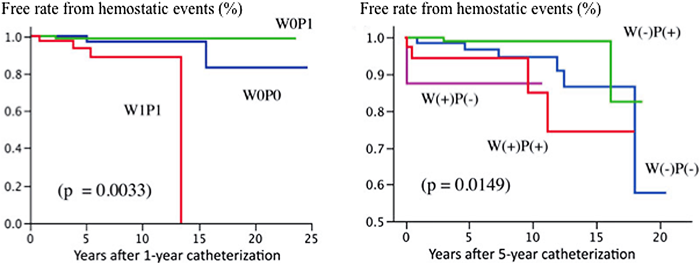
b)血栓形成:ストレス時の抗凝固が肝要フォンタン術後患者の血栓形成はその対策を含め未解決な大きな問題である.一般的には,フォンタン循環での血栓は術後急性期や慢性期にかかわらず生じ42, 43)経過とともにそのリスクは増加し12, 43),抗凝固剤非投与例で血栓関連の心事故が多いとされている12).一般に血栓形成の危険因子を有する場合(血栓の存在,高CVP,低心拍出量,VV-shuntや開窓による右左短絡の存在,中等度以上の心室収縮性低下,APCでの拡大した右房,フォンタンルートに狭窄等),心房頻拍性不整脈の既往がある場合等は積極的に抗凝固剤の投与を考慮するとされている42).フォンタン術後の血栓形成に関する病態を考えるうえでVirchowの3徴を考慮することは重要である.すなわち,血栓形成要因として血液組成(血栓凝固亢進),血管壁性状(内皮機能),そして血流性状(鬱血,乱流)である44).一般に,フォンタン患者では止血凝固系ではアンチスロンビンやプロテインCなどの内因性抗凝固因子を含め多くの凝固因子は低下し45),内皮機能障害を反映しvon Willebrand因子は上昇し,また,血小板機能は亢進している46).加えて,フォンタン循環特有の右心系の血液鬱滞していることから血栓形成傾向にある.また,心不全病態もこれらVirchowの3徴に合致し,フォンタン患者では元来心不全を伴うことから常に念頭に置いた管理が求められる.我々の検討では,これまでと同様に術後早期と遠隔期に増加する傾向があった43).しかしながら,東洋系フォンタン患者では凝固系異常は西洋人と異なり出血の頻度も少なくないことが指摘されており47),このことは我々の症例にも当てはまる可能性がある.すなわち,血栓形成に比べ,喀血や脳出血の事故が比較的多く,抗凝固剤を中心とした治療には疑問の余地を残すと言える.
我々のフォンタン患者術後の抗凝固療法は原則的に心血行動態不良を含めた危険因子(右左短絡遺残など)を考慮した抗凝固治療となっている.したがって,必ずしもワーファリン投与がこれら血栓形成の合併症低下に結びついていない結果であった.むしろ,ワーファリン使用例では止血関連の事故が多く,死亡率も高かった43)(Fig. 8).
我々の検討から,止血凝固線溶系は普段は豊富な関連因子の予備能力で異常な血栓事故が起きないように調整されていると考えられる.しかし,肝硬変患者と同様に48),感染,不整脈や手術などのストレス時にはこれらの微妙な止血機構のバランスが崩れ,血栓形成や出血といった合併症を起こすと考えられる.したがって,今後のフォンタン術後患者の止血関連の合併症予防には患者選択と同様に患者の置かれた環境を考慮した流動的な綿密な戦略が欠かせないことを提唱した.
7)良好なフォンタン:低CVP,高酸素飽和度と良好な房室弁機能
フォンタン術後患者での合併症や併発する病態の割合が高いことは多く報告されてきている12–14).したがって,これらの危険因子の解析結果が多く報告されているが,逆に,術後長期にわたりこれらの合併症を併発していないいわゆる“良好なフォンタン患者”が存在するのも事実である.これら患者の特色を明らかにすることでフォンタン患者の治療管理戦略の構築に有用な情報を含むと考えられる.
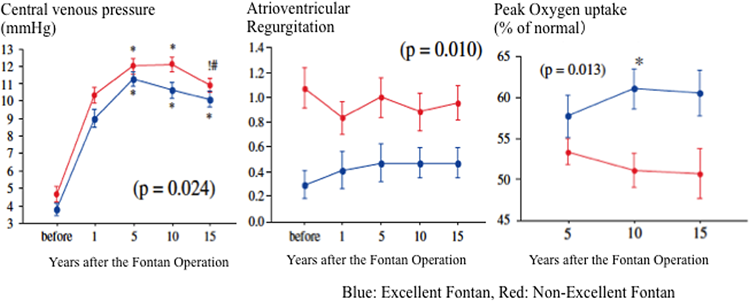
我々の施設ではフォンタン術後1年以降,5年ごとに心臓カテーテル検査やCPXを含めた総合的術後評価を行い,その遠隔期成績向上を目指している.術後15年(術後12.6年以上経過)経過した201例中,165例が生存していた.その内91例で何らかの事故が発生し入院を要していた,すなわち,74例が事故に遭遇していなかった.その中で,我々の定義した良好なフォンタン循環の患者は47例(23%)であった49).これらの中で術後15年間すべて連続的に血行動態が評価された18例の特色は,CVPは術後5年の平均11.3±1.7を最高に以降低下し,体心室駆出率は53~56%と不変で,房室弁閉鎖不全がほとんどなく,動脈酸素飽和度は92~94%で推移し,Peak VO2は58~61%と良好に維持されていた.抗血小板療薬の使用頻度は約39~60%と不変であったが,利尿剤の使用頻度は低下していた.
良好でないフォンタン患者に比較すると,良好フォンタン患者の特色は,一貫してCVPが低く,房室弁閉鎖不全がなく,運動耐容能が良好である特色を有していた(Fig. 9).また,興味深いことに,心拍出量,肺および体血管抵抗,体心室収縮率に差がなかった.また,臨床事故の発生しなかった唯一の独立予測因子が高い酸素飽和度,すなわち,低酸素血症がないことであった.これらから見えてくることは,術後長期にわたってQOLの高い良好フォンタン患者である条件は,房室弁機能が良く,術後早期のCVPが低く,そして低酸素血症がないことである.したがって,現時点では,これらを3つの要因に焦点を当てることで良好な長期術後経過が期待できることを示唆している.注目したいのは,体心室収縮性や肺血管抵抗がこれら良好フォンタン患者の規定要因となっていない事実である.これらの結果を念頭においた長期戦略の重要性を示唆している.
8)新たな病態の認識
a)耐糖能異常心血管事故予防を意識した心血管危険因としての内蔵肥満を主体とし,高血圧と糖,脂質代謝異常を併せ持つ病態であるメタボリック症候群(MS)の重要性が認識されている50).MSでは,将来の心事故発生が約2倍高い51).生活習慣に加えて,出世前の胎内環境,さらには出生後の成長様式がこの病態と密接に関連する52).すなわち,胎内発育に問題があり出生体重が小さいことが,将来の代謝異常と関連し,さらには有意に高い心事故と関連することが示唆されている.実際に低出生児体重児の小児期のインスリン感受性は低下している53).加えて,出生体重が小さい児が出生後早い時期の急速な体重増加,いわゆる“catch-up”は,むしろ将来の心事故増加に寄与する可能性が指摘されている54, 55).これら一連の関連はBarker仮説として提唱され56),多くの疫学研究がこの仮説を支持している.これらの背景は多臓器機能異常を有するフォンタン術後遠隔期の病態把握の一助になる可能性を示唆する.これまでに,出生体重,姑息術あるいは心室形態などの成長異常への影響に関心が向けられてきた57).体内発育異常や出生後の段階的姑息術の後に観察される手術関連や特異な循環に伴う成長異常とフォンタン手術後の“catch-up”はこれら患者の糖脂質代謝異常の背景を併せ持つことを意味する.
これらの背景を基に,我々はACHD患者,特に心不全病態に加えて肝腎機能障害の頻度の高いフォンタン術後患者の糖脂質代謝異常の有無とその臨床的意義を検討してきた.我々の成績では,フォンタン術後患者,二腔心修復術後とも対照群に比べ,高インスリン血症を示し,HbA1cは高い.しかしながら空腹時血糖はむしろ低めである58, 59).空腹時低血糖の頻度が健常者に比べ有意に高く,低酸素を有する未修復のチアノーゼ性ACHD患者に次いで多い.しかもACHD全体の検討ではこの低血糖は死亡を含め入院を要する臨床事故と密接に関連していた59)(Fig. 10).高頻度の低血糖による交感神経賦活やエネルギー供給不足は不整脈や心不全発症のリスクを高めることになり,これら病態の解明と対策が望まれる.一方,簡易なインスリン抵抗性の指標であるHOMA-IRは軽度上昇している.また,経口糖負荷試験(75 g OGTT)ではフォンタン術後患者の約4割が耐糖能異常を示していた58, 59).この頻度は成人心不全患者の頻度と同等である60).さらに約15%の患者で糖尿病型を示し,これらの患者の予後不良と関連していることが示唆された58).成人心疾患に比較しフォンタン術後患者の年齢が極めて若年であることを考慮すれば,極めて高い頻度であり,今後,ますます増大するフォンタン術後患者の生活管理や治療においては着目すべき課題の一つと言える.
一方,MSに伴う耐糖能異常は脂質代謝とも密接に関わる.すなわち,過剰なブドウ糖やFFAといった中性脂肪の基質が大量に肝臓に流入し,VLDLが過剰に産生される.また,食後高血糖は,インスリン抵抗性と共にリポプロテインリパーゼ(LPL)活性を低下させ中性脂肪の異化を低下させる61).一方,インスリン抵抗性によるVLDL分解が阻害され,中性脂肪に富むリポプロテインからHDL分画へのアポ蛋白やコレステロールエステルの転送が障害されHDLが減少する62).
成人心疾患では血清脂質異常と心事故の関連は明らかで,低HDLは高LDLとは独立した予後規定因子である63).興味深いことに,耐糖能異常では比較的低いLDLであっても70 mg/dl以上では冠動脈疾患の有意な危険因子である64).一方,我々の検討では,チアノーゼ性CHD患者の血清脂質は低く,特にチアノーゼを有する患者やフォンタン術後患者でその低下は著明である58).この脂質異常は小児フォンタン患者でも観察されている65).したがって,何らかの内因性のコレステロール代謝異常の存在を示唆する.以前より,チアノーゼ性心疾患患者の脂質異常,特に低脂質血症が指摘され冠動脈硬化の進行は少ないことが示唆されている66).したがって,フォンタン術後患者での虚血性心疾患の発症のリスクは少ない可能性がある.しかしながら,低脂質血症と心不全の予後不良との関連が示唆されることから67),これらの背景はフォンタン術後患者の栄養,免疫異常,心不全との関連も今後の重要な課題かも知れない.
b)フォンタン関連肝疾患最近,フォンタン術後遠隔期での様々なこの特異な循環と関連した病態が明らかとなってきている.その中で最も重要な合併症が肝疾患である68).肝鬱血の長期化に伴い肝硬変やさらには肝臓癌が報告されるようになってきている69).肝臓実質の線維化の指標は確立しておらず,ウイルス性肝炎後と同様な手法での限界が示されており,特にフォンタン患者での肝臓線維化の血液学的手法を含め非侵襲的な評価は困難とされている70).したがって,現時点では肝臓癌発症に関してもその発症予測に関する知見が全くないのが現状である.また,肝硬変やそれに伴う門脈高血圧は様々に心筋や血行動態に影響し循環不全を引き起こすことが知られている71).特に肝硬変を伴った患者では全身血管拡張に伴う高心拍出量を伴う心不全の存在が明らかとなりこれまでとは異なった心不全治療の構築が望まれる72, 73).
小児と成人フォンタン患者の相違
最近の世界的な動向として,成人先天性心疾患(ACHD)患者,特に複雑CHD術後患者が増加している.これまでの小児期フォンタン患者の臨床像がそのまま成人期のフォンタン患者に当てはまるか否かは不明であり,小児期の治療,管理戦略が成人フォンタン患者で適用か否かは重要な問題である.我々の検討から成人フォンタン患者の予後規定要因は小児フォンタン患者と同様な指標と差のある指標の存在が明らかとなった74).すなわち,高CVP,CPX指標,液性因子や低ナトリウム血症などは小児と成人フォンタン患者で臨床的意義は同様であった.しかし,心室形態(非左室型)や低酸素血症は小児期では重要な予後規定要因であったが,成人ではこれらの要因の予後との関連は消失していたが,腎機能や呼吸機能が大きく予後に関わる要因であることが明らかとなった.また,成人フォンタン患者では男性で予後が悪いという性差が明らかとなった.さらに,興味深いのは成人フォンタン患者では高インスリン血症が予後不良と関連したが,小児では予後と関連なく,むしろ,高インスリン血症の小児で予後が良い傾向にあった.
これら臨床指標の臨床的意義がフォンタン術後経過とともに絶えず変化していくことは,フォンタン術後患者を含め他のCHD患者においても,心臓以外の他の臓器との関連も常に考慮しながら長期管理しなければならないことの重要性を示唆する.したがって,最近の胎児および成人先天性心疾患領域の発展を鑑みると,総合的な先天性心疾患医として大きな視野に立った医療を実践することが望まれている.