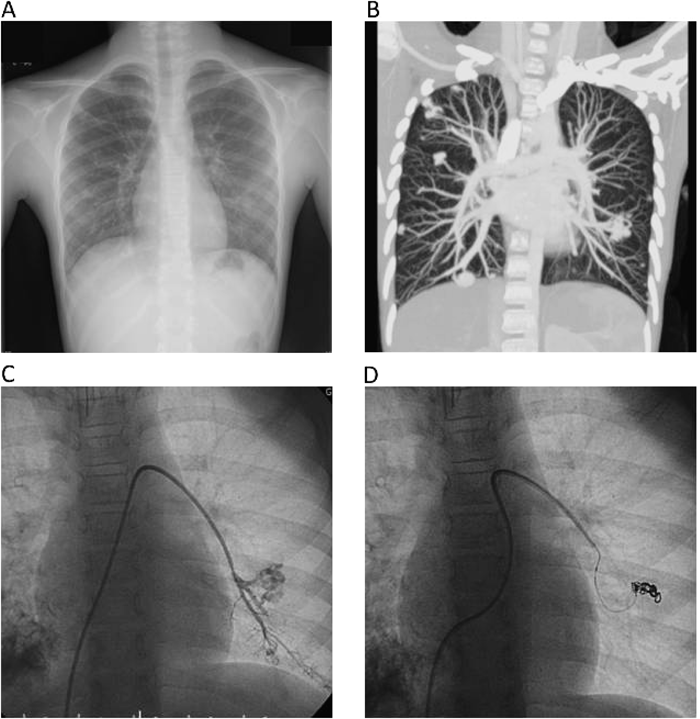
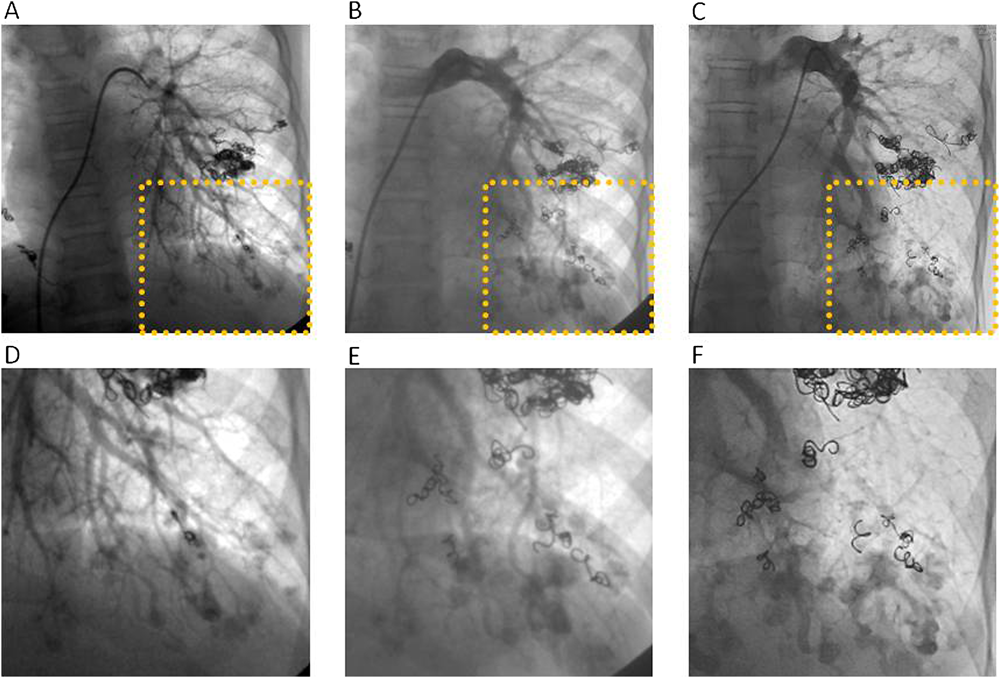
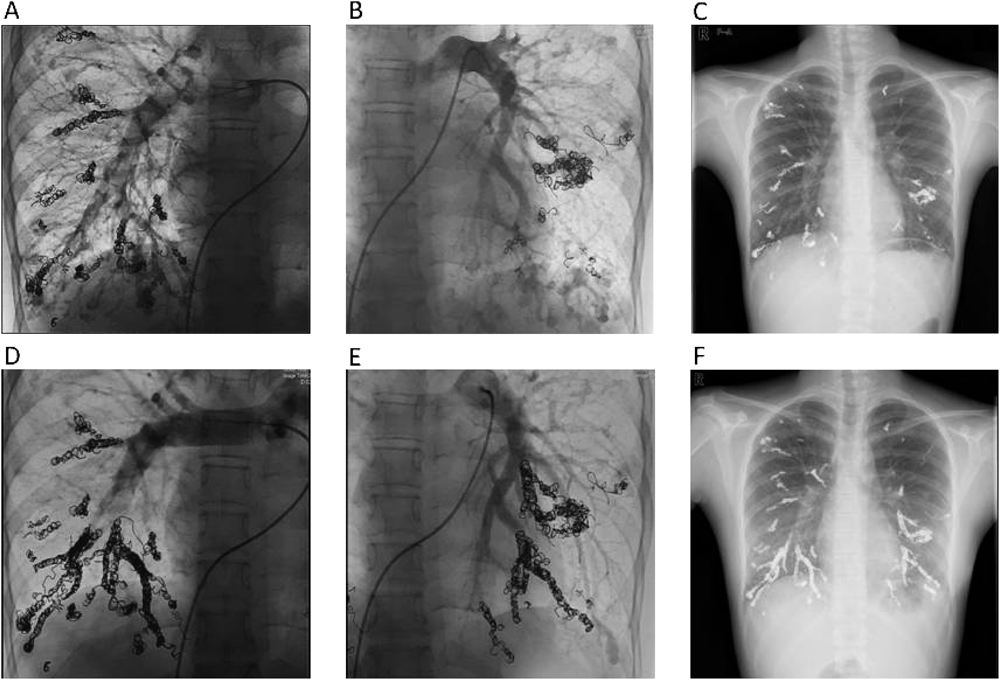
正常肺組織を犠牲にすることを前提としてコイル塞栓術を施行した両側肺全区域びまん性肺動静脈瘻の1例A Case of Diffuse Pulmonary Arteriovenous Malformationss Successfully Treated by Percutaneous Transcatheter Embolization with Sacrifice of Normal Pulmonary Arteries
徳島大学大学院ヘルスバイオサイエンス研究部小児科学分野Department of Pediatrics, Institute of Health Biosciences, The University of Tokushima ◇ 〒770-8503 徳島県徳島市蔵本町三丁目18番地の15Kuramoto-cho 3-18-15, Tokushima-shi, Tokushima 770-8503, Japan