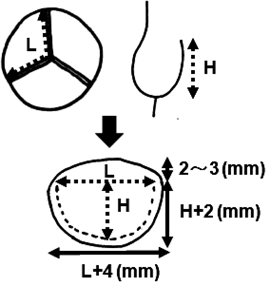
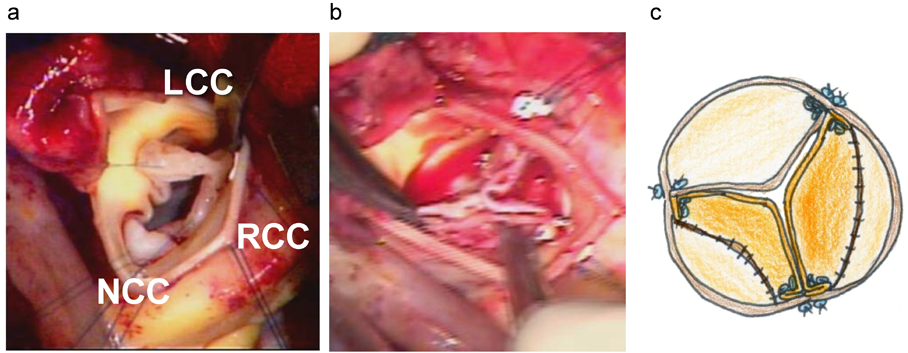
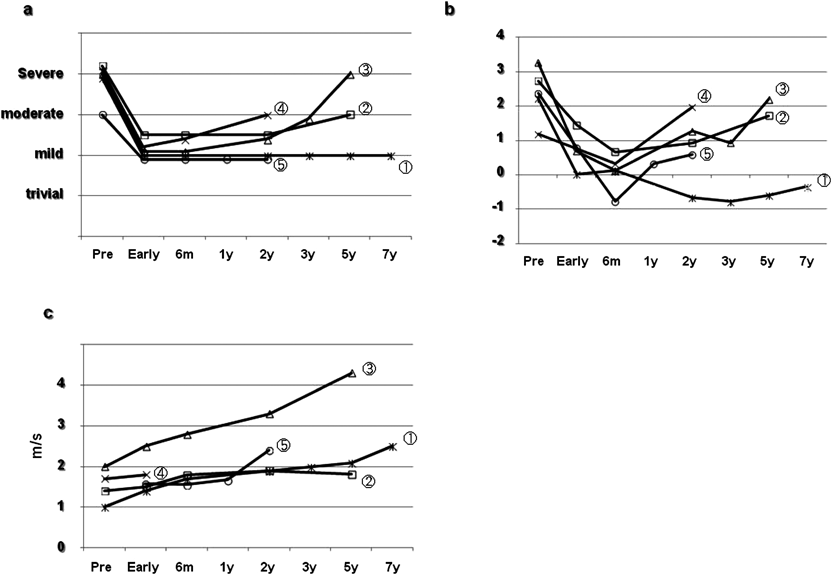
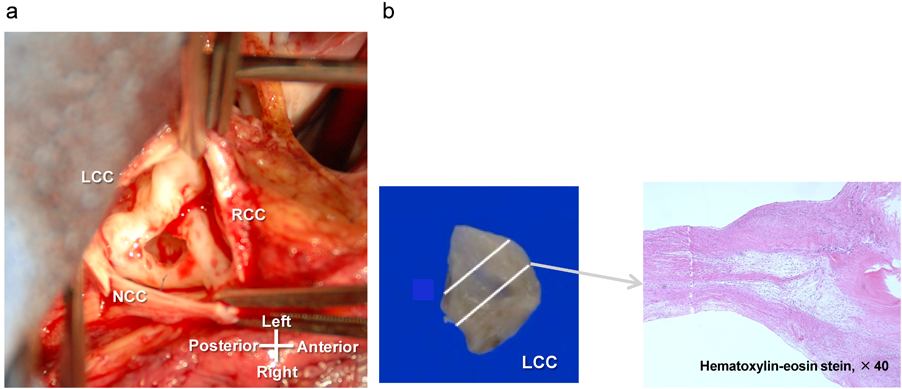
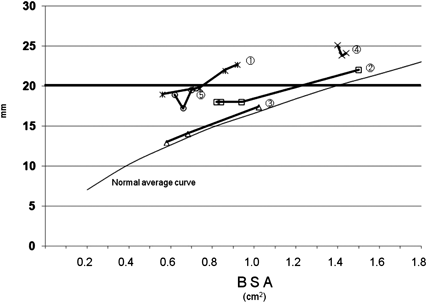
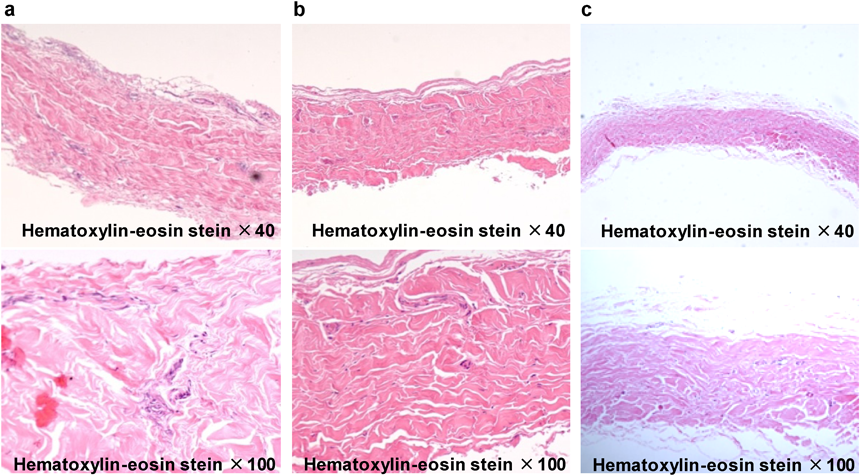
小児大動脈弁疾患に対するグルタールアルデヒド処理自己心膜を用いた大動脈弁形成術Aortic Valve Repair Using a Glutaraldehyde-treated Autologous Pericardial Patch in Children with Aortic Valve Disease
1 兵庫県立尼崎病院心臓センター心臓血管外科Department of Cardiovascular Surgery, Heart Center, Hyogo Prefectural Amagasaki Hospital ◇ 〒660-0828 兵庫県尼崎市東大物町一丁目1番1号Higashi-Daimotsu-cho 1-1-1, Amagasaki-shi, Hyogo 660-0828, Japan
2 兵庫県立尼崎病院心臓センター小児循環器内科Department of Pediatric Cardiology, Heart Center, Hyogo Prefectural Amagasaki Hospital ◇ 〒660-0828 兵庫県尼崎市東大物町一丁目1番1号Higashi-Daimotsu-cho 1-1-1, Amagasaki-shi, Hyogo 660-0828, Japan
3 真星病院小児科Department of Pediatrics, Mahoshi Hospital ◇ 〒651-1242 兵庫県神戸市北区山田町上谷上字古々谷12番地3Yamada-cho Kami-Tanigami Kokoyama 12-3, Kita-ku, Kobe-shi, Hyogo 651-1242, Japan