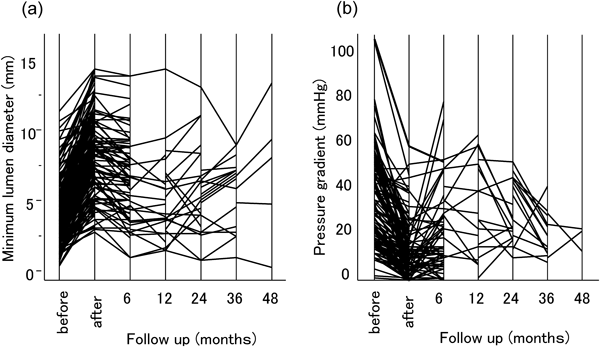
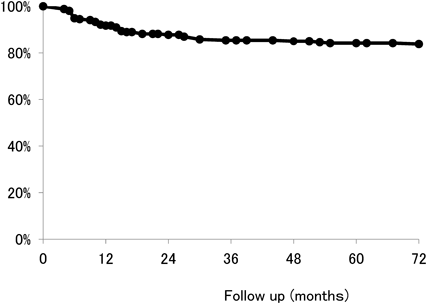
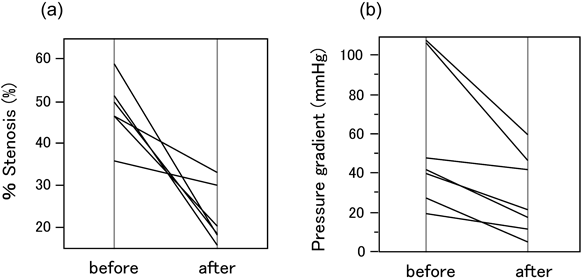
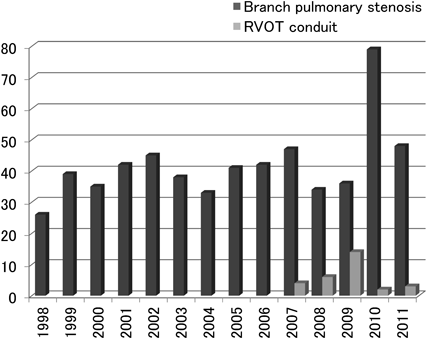
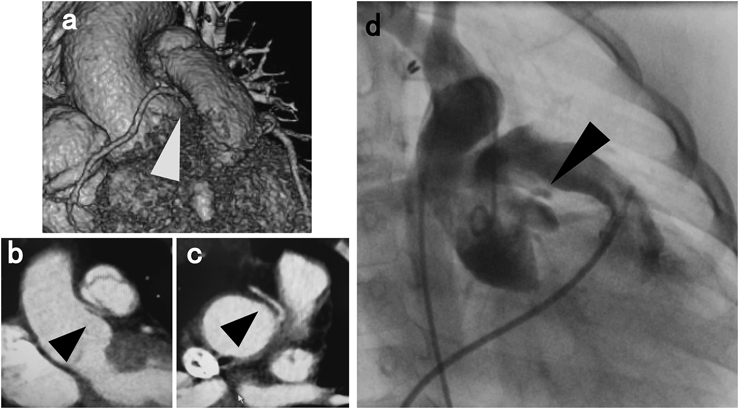
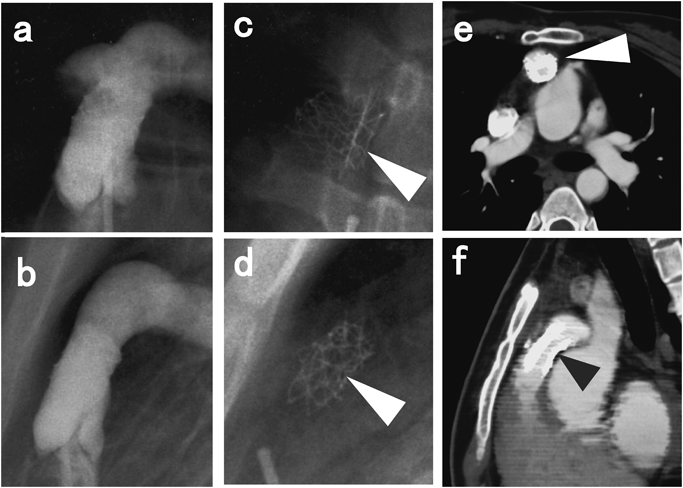
二心室修復における右室流出路の人工導管狭窄に対するステント留置Stenting for Right Ventricular Outflow Tract Conduits in the Biventricular Heart
1 昭和大学横浜市北部病院循環器センターCardiovascular Center, Showa University Northern Yokohama Hospital ◇ 〒224-8503 神奈川県横浜市都筑区茅ケ崎中央35番1号Chigasaki-Chuo 35-1, Tsuzuki-ku, Yokohama-shi, Kanagawa 224-8503, Japan
2 岡山大学病院小児循環器科Division of Pediatric Cardiology, Okayama University Hospital ◇ 〒700-8558 岡山県岡山市北区鹿田町二丁目5番1号Shikata-cho 2-5-1, Kita-ku, Okayama-shi, Okayama 700-8558, Japan
3 埼玉医科大学国際医療センター心臓病センター小児心臓科Department of Pediatric Cardiology, Heart Center, Saitama Medical University International Medical Center ◇ 〒350-1298 埼玉県日高市山根1397番地1Yamane 1397-1, Hidaka-shi, Saitama 350-1298, Japan
4 公益財団法人日本心臓血圧研究振興会附属榊原記念病院小児循環器科Department of Pediatric Cardiology, Sakakibara Heart Institute, Japan Research Promotion Society for Cardiovascular Diseases ◇ 〒183-0003 東京都府中市朝日町三丁目16番1号Asahi-cho 3-16-1, Fuchu-shi, Tokyo 183-0003, Japan
5 静岡県立こども病院循環器科Department of Cardiology, Shizuoka Children's Hospital ◇ 〒420-8660 静岡県静岡市葵区漆山860番地Urushiyama 860, Aoi-ku, Shizuoka-shi, Shizuoka 420-8660, Japan