最近の20年で,複雑先天性心疾患の手術治療成績は大きな飛躍を遂げたが,十分な心房間交通を有さないHLHS,重症Ebstein奇形,大きな右室冠動脈瘻を有するPA/IVS,根治術後狭窄を繰り返すTAPVC等の手術成績は未だ十分とは言えない.これらの疾患群の治療成績は手術や周術期管理の質もさることながら,術前の心臓・肺の状態や手術に対する異常な組織反応という,その患者が生下時から本質的に有している因子に左右される面も大きく,手術手技や周術期管理の改善からのアプローチでは行き詰っている.もし安全を担保したうえで,胎児期手術介入が可能であれば,より正常な心臓や肺の発達を促し,生後の生存率とQOLを向上する可能性が高いと思われる.Table 1に胎児手術の対象となるPrimary Lesionとそれに伴うSecondary Lesion,および考えうる胎児手術手技を示した.筆者は2011年7月から2014年3月にかけて,米国スタンフォード大学にて体外循環使用胎児手術の開発に携わる機会を得た.その経験踏まえ,これまでの胎児手術開発の知見と今後の展望を概説する.
Table 1 The primary lesions and the secondary lesions that can be treated by fetal cardiac surgery| Primary Lesion | Secondary Lesion | Possible Fetal Cardiac Surgery |
|---|
| Critical Aortic Valve Stenosis | Dysfunction of LV, Endocardial fibroelastosis | Aortic Valvotomy |
| Pulmonary Atresia/Critical Pulmonary Valve Stenosis | Hypoplastic RV, Endocardial fibroelastosis, CA-RV fistula | Pulmonary Valvotomy |
| Absent/Restrictive PFO | Hypoplastic LV/Aorta, Lung Parenchymal Abnormalities | ASD creation/enlargement |
| TAPVC | Lung Parenchymal Abnormalities | TAPVC repair |
| TOF with APV | Aneurysmal PAs, Bronchial Obstruction | RVOT reconstruction, PA plasty |
| Premature Closure of Ductus Arteriosus | RV failure, Hydrops | Aortopulmonary shunt |
| Severe Ebstein’s Anomaly/Severe isolated TR | RV failure, Bronchial Obstruction | TV repair |
| Severe Mitral Anomalies | LV failure | MV repair |
| ASD; atrial septal defect, APV; absent pulmonary valve, CA-RV; coronary artery-right ventricle, LV; left ventricle, MV; mitral valve, PA; pulmonary artery, PFO; patent ductus arteriosus, RV; right ventricle, RVOT; right ventricular outflow tract, TAPVC; total anomalous of pulmonary venous connection, TOF; Tetralogy of Fallot, TR; tricuspid regurgitation, TV; tricuspid valve. |
胎児治療の歴史は,Lileyらが胎児水腫に対し,輸血を試みたことから始まる1).その後,横隔膜ヘルニア・水腎症を中心に非心臓胎児奇形を有する胎児への手術介入に関する動物実験が1980年頃まで行われ,実用化された2,3).Lileyらの実験から25年間,胎児循環への理解を深める実験は多くなされたが,心臓への胎児期手術治療の開発はこれらの実験よりかなり遅れて始まった.1978年にいくつかの先天性心疾患動物モデルの作成に成功した報告がなされ4),1985年には人工的に作成した胎児期肺動脈狭窄を胎児手術で修復に成功した報告がなされた5).1996年にReddyらは羊胎児にDKS吻合とAortopulmoanry shuntをoff-pump下で施行して単心室型循環動態を作成し,子宮に戻し,出産させることに成功したと報告している6).1984年には胎児に深部低体温循環停止を試みた報告がある7).1985年,Richterらが初めて胎児に体外循環を導入した実験を発表し8),胎児期人工心肺使用心臓手術の開発が幕を開けた.しかし,体外循環離脱後に胎児は長期生存せず,その後の苦難を予見させるものであった.
胎児体外循環の実験を行うにあたり,胎児循環の各種パラメーターの正常値と胎児循環の特徴を理解しておかなくてはならない.胎児循環の基本的な説明は割愛するが,胎盤で酸素化された臍帯静脈血流は主に卵円孔を通って上半身へ,一方,酸素化されていない上大静脈の血液は,主に下半身と臍帯動脈へ向かうことは念頭に置いておかなくてはならない.
胎児の正常平均動脈圧はLast Trimesterで40~45 mmHgと言われている9).胎児の心拍出量は450 mL/kg/min程であると言われ10),その約1/2が胎盤を循環している11).胎児心機能は非常に未熟で,後負荷にも前負荷にも弱い12,13).安静時心拍数は180/min程で,心拍数250~300/minぐらいまでは心拍出量が増えるが,その増加は20%程でしかなく,心予備能は極端に低い.胎児心筋のエネルギー供給源は95%以上がCarbohydrateである.
胎児の血管抵抗コントロールも特殊である.酸素は胎児の重要な血管抵抗コントロール因子である.胎児の上半身のSaO2は55%~60%で,低酸素は冠動脈,脳,副腎の血管抵抗を低下させ,肺血管抵抗を上昇させる.酸素濃度が上昇すると,肺血管抵抗は低下し,動脈管が収縮する14).胎盤の血管は正常酸素濃度では拡張を保っているが,低酸素で収縮する.胎盤の血管に自己調節機能はなく,基本的に最大限拡張されており,血管抵抗は非常に低い15,16).胎盤の血管は自律神経系の支配も受けていない.
胎児に体外循環を導入すると,血中のカテコラミン17),レニン18),バソプレッシン19),各種サイトカイン20)が上昇し,胎児・胎盤の血管抵抗が上昇,胎盤のガス交換能が障害される17).胎盤機能が障害されると,胎児は高度な低酸素状態に陥り,組織のアシドーシスが進む.これが,胎児心機能低下を誘発し,さらに胎盤血流低下,胎盤機能低下するという悪循環に陥っている.また,出血と血液希釈による貧血,母体麻酔によるストレスもこの悪循環に拍車をかけている.また,胎児体外循環導入そのものによる炎症反応等が胎児心機能を阻害している可能性が高い(Fig. 1).また,胎児循環中の重要因子にアラキドン酸カスケードの亢進がある.胎児に大量のインドメサシン(シクロオキシゲナーゼ阻害薬)を投与し,体外循環を導入すると,体外循環による胎盤機能障害が大きく改善される21).アラキドン酸カスケードのシクロオキシゲナーゼステップより下流のトロンボキサンや各種プロスタグランディンが胎児体外循環中の胎盤機能の悪化に関与していることが示唆されるが,トロンボキサンの阻害剤を使用しても胎児体外循環の成績を改善することはできず17),さらにはシクロオキシゲナーゼの産物の一つであるプロスタグランディンE2やI2は妊娠中の胎児の血管拡張を担う重要な物質であり22),その産生を阻害することは妊娠の維持の観点から矛盾するので,なぜインドメサシンに効果があるのか詳細は不明である.また,アラキドン酸カスケードを含む様々な炎症反応物質産生を広範囲に阻害する高容量ステロイド投与も胎児循環中の胎盤機能障害を改善する23).胎児のSpO2は通常55%~60%であり,胎児は通常30分の体外循環離脱後30~60分で高度の低酸素血症,高二酸化炭素血症とそれに伴うアシドーシス,心機能低下にて死亡するが,これらの薬を使用すると体外循環離脱後2時間以上の生存が可能となる.しかし,子宮に戻さず,放置していると徐々に代謝性アシドーシスが進行し,体外循環離脱後6~8時間で死亡する17).
また,胎盤は非常に大きな胎児循環のCapacitorでもある.胎児体外循環中は大きなVolumeシフトが起きており,胎児血管内に血液Volumeが保たれておらず,しかも原因は胎盤浮腫ではない.持続的な胎児体外循環中のVolume Resuscitationが必要である24).
胎児体外循環の心機能悪化は右室有意であり,胎児体外循環後のトロポニンI崩壊も右室有意である25).胎児心機能障害の原因としては,胎盤障害による心筋の酸素化障害や急激な後負荷の上昇が考えられるが,体外循環導入そのものが何らかの障害を与えている可能性も高い.胎児心停止手技に関しては,常温下で通常の漿液性心筋保護液で30分の心停止26),心室細動27)が可能である.
近年では軸流ポンプや遠心ポンプの小型化が著しく,胎児体外循環への応用が期待される.1996年,Reddyらは軸流ポンプとローラーポンプを比較し,軸流ポンプは胎児体外循環後の生存率を向上したと報告している27).また,Sebastianらは小型遠心ポンプ(TinyPump)とローラーポンプを比較し,TinyPump群では従来の実験より在胎週数の短い羊胎児(在胎週数104±4.5日)を使用したにもかかわらず,ローラーポンプ群(在胎週数119±4.5日)よりも,有意に低いPaCO2値と有意に低い血中Lactate値を維持できたと報告している28).各種医療工学技術の進歩により胎児体外循環の成績向上を望める余地は未だ大きいと考えられる.
胎児手術の理想的な麻酔法は,ストレス反応を完全にブロックし,胎児心機能を保ち,胎児の血管抵抗バランスを崩さない麻酔法である.研究初期に用いられたハロタンは子宮筋のリラックス効果を有するが,心機能抑制作用があり,鎮痛作用がないため,胎児手術の結果を悪化させる29).FentonらはTotal Spiral Anesthesia(TSA)が胎児体外循環による胎児のストレス反応抑制に有用であることを報告している30).TSAは大槽にテトラカイン等を注入し,脊椎全体を麻酔する方法で,胎児心機能と胎盤血流を良好に維持することができるが,とても侵襲的な麻酔法であり,ヒトへの応用へはリスクが高い.現在では,前述のようにイソフルランとケタミンが容易に胎盤を通過する性質があり,胎児手術の実験で主に用いられている.
胎児手術中の母体の麻酔・循環管理も重要である.胎児体外循環を導入すると,母体の心拍出量が変化しなくても,子宮動脈の血流が減少する.体外循環導入後の母体低Ca血症を補正すると子宮動脈の血流は回復したと報告されている31).子宮動脈の血流を確実に保つために母体の血管抵抗と心機能の管理が重要である.胎児体外循環に関する実験の多くは,胎児側に焦点が当てられており,母体管理に関してのデータは非常に少ない.
胎児ヘモグロビン(HbF)は酸素親和性がHbAより高く,低酸素下での組織への酸素運搬を補助している.通常のHbAの輸血でHb値を上げるだけでは十分に酸素運搬能を回復することができない.現状ではHbFの輸血は困難であるため,通常のHbA輸血を行い血中Hb値を高く保つことが勧められる.その他,輸血をしながら,HbAの酸素親和性をOrtho-iodo sodium benzoate等の薬物を用いて高めるという方法も有用である可能性がある.
上記のごとく,胎児に必要な循環血流量は450mL/kg/minと言われる.しかし,小さい胎児で,この血流量を出すことは非常に困難である.一つの解決法として,臍帯動静脈を胎児循環補助中はクランプするという手段がある.胎盤は30分の常温虚血に耐える組織であり32),Fentonらは,臍帯動静脈を常温で30分間クランプし,再還流させたところ正常なガス交換能を回復したと報告している33).しかし,臍帯動静脈遮断中は人工肺を使用しなくてはならず,Priming Volumeの増大により胎児輸血が必須となることが問題である.その他,Vacume-Assisted Venous Drainageを使用する手段もあるが,400 mL/kg/minのポンプ血流量を獲得したにもかかわらず予後はむしろ悪化したと報告されおり34),よい手段とは言えない.
1994年,Reddyらは世界で初めて羊胎児に30分人工心肺を常温下で回し,胎児を子宮に戻して出産させ,89%という驚くべき生存率を得た35).また,ヒトへの応用前段階として,2002年,Ikaiらはバブーンに胎児循環を導入し,Non-human Primateの胎児体外循環管理は可能であると報告している36).しかしながら,その後ヒトの胎児で成功した報告はない.ヒトへの応用のための倫理的な問題を解決するためには,現在一部の病院で行われている,ヒト胎児への横隔膜縫縮術と同等レベルの安全性確立が必要と考えられる.
現在のスタンフォード大学における基本的な実験モデル
羊の在胎満期は147日前後である.若すぎると組織が脆弱で手術失敗の可能性が高く,満期に近づくと新生児期に手術を行う場合と大差なく,胎児期に手術を行う意義が薄れるため,在胎115~125日の羊を用いることが多い.羊は単胎が多く,在胎115~125日の胎児の体重が2~3 kgとほぼヒトの大きさに近いこと,歴史的にスタンフォード大学の研究チームが羊の扱いに慣れていることが羊を用いる理由として挙げられる.妊娠羊を扱う場合はQ feverに注意しなくてはならない.
現在,母羊の麻酔はケタミン筋注で導入,維持はイソフルラン1~2 ppmで行っている.ケタミンとイソフルランは胎盤を容易に通過し37,38),胎児に移行する.母体は頸動脈に動脈圧ライン,頸静脈に中心静脈ラインをCut Down法で留置し,心電図,直腸音,SpO2をモニタリングする.
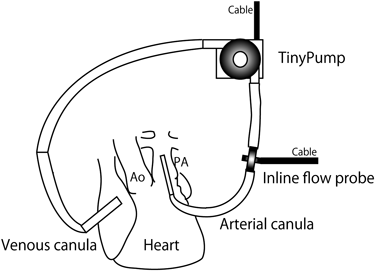
腹部正中切開で子宮を露出,切開後,胎児を露出しガーゼ等で固定する.まず右側臥位で左側腹部を切開し,後腹膜経由で臍帯動脈に血流計を固定し,左側腹部の創は閉創する.腹部大動脈血流は臍帯動脈血流とほぼパラレルに相関するため,腹部大動脈に血流計を置いて臍帯動脈血流の指標としてもよい.続いて,胸部正中切開を行い,脱血管を右房,送血管を主肺動脈に挿入し,体外循環を開始する.ACTは300秒以上に管理する.送血管は6~10Fr,脱血管は10~18Frを用いている.以前は,リザーバー付きのローラーポンプを使用していたが,最近の実験では,東京医科歯科大学の高谷教授が開発したTinyPumpを用いている(Fig. 2).Primingは10 mLの細胞外液を用い,輸血を避けることが可能である.人工心臓の血流は通常200 mL/kg/min前後が得られる.大動脈遮断は通常行わず自己心臓による拍動流も維持される.血管作動薬,カテコラミンは使用しない.ボリューム負荷は10 mL/hr+出血回収血の随時返血のみで,積極的な容量負荷は行わない.羊の大動脈弓分枝は1本であり,ここから両側の総頸動脈と鎖骨下動脈が分枝している.よって腕頭動脈に血流計を置くと,頭部への血流の指標となる.血液の酸素化は胎盤を介して行われ,通常人工肺は使用しない.
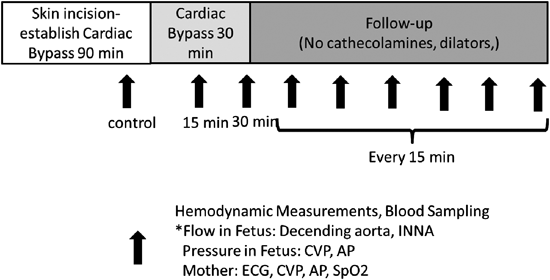
基本的な実験プロトコールをFig. 3に示す.母体の皮膚切開から体外循環まで通常60~90分かかる.体外循環開始前にControlとなる採血を行う.体外循環を30分回し,体外循環開始後15分と30分で採血を行う.その後体外循環を停止し,送脱血カニューレを抜去し,15分ごとに採血を行う.最近では,胎児と母体の各種パラメーターはPowerLabシステムとLabChartソフトウェア(ADInstruments, Inc., Denver, Colorado Springs, CO, USA)を用いて連続的にモニタリングしている.本プロトコールにて,成績向上に役立つ薬物,方法を種々検討中である.
羊とヒトでは胎盤の構造が全く異なり,ヒトではHemochorial Placenta,羊ではEpitheliochorial Placentaである.よって血液ガス交換効率,各種ストレスへの反応や薬物への反応も異なる可能性がある.
スタンフォード大学では実際の手術の状況を再現したいと考え,胎児の胸骨正中切開によるアプローチを用いている.この方法は胎児への侵襲が大きく,手術侵襲そのものが胎児の体外循環後の生存時間に大きい影響を与える.シンシナティ大学のグループは,手術を2段階に分け,初めの手術で胎児に各種ラインを留置し,2度目の手術では胸部を開けず頸部動静脈から体外循環を導入する手法をとり,各種測定前の手術による侵襲を最低限におさえてデータを取る手法を採用している39).実験モデルとして,どちらがよいのかはケースバイケースである.
人工心肺を利用した胎児開心術は技術的には実現可能なレベルまで開発が進んでいる.しかし,心臓血管外科黎明期に比べて社会が求める手術成績のハードルは著しく高く,ヒトへの導入を社会が承諾するレベルには達していない.また,体外循環導入可能時間も30分と限られており,現時点で実現可能な手術手技は非常に限られる.今後さらなる研究を進め,安全性を高め,社会の理解を得られるかどうかが,臨床導入への鍵となると考えられる.
本論文の要旨は,第50回日本小児循環器学会総会・学術集会(2014年7月,岡山)にて発表した.
引用文献References
1) Liley AW: Intrauterine transfusion of fetus in hemolytic disease. BMJ 1963; 2: 1107–1109
2) Harrison MR, Adzick NS, Longaker MT, et al: Successful repair in utero of a fetal diaphragmatic hernia after removal of herniated viscera from the left thorax. N Engl J Med 1990; 322: 1582–1584
3) Crombleholme TM, Harrison MR, Langer JC, et al: Early experience with open fetal surgery for congenital hydronephrosis. J Pediatr Surg 1988; 23: 1114–1121
4) Fishman NH, Hof RB, Rudolph AM, et al: Models of congenital heart disease in fetal lambs. Circulation 1978; 58: 354–364
5) Slate RK, Verrier ED, Stevens MR, et al: Intrauterine repair of pulmonary stenosis in fetal lambs. Surg Forum 1985; 36: 246–247
6) Reddy VM, Liddicoat JR, Fineman JR, et al: Fetal model of single ventricle physiology: Hemodynamic effect of oxygen, nitric oxide, carbon dioxide, and hypoxia in the early postnatal period. J Thorac Cardiovasc Surg 1996; 112: 437–449
7) Adzick NS, Harrison MR, Slate RK, et al: Surface cooling and rewarming the fetus: A technique for experimental fetal cardiac operation. Surg Forum 1984; 35: 313–316
8) Richter RC, Slate RK, Rudolph AM, et al: Fetal cardiac bypass alters regional blood flows, arterial blood gases and hemodynamics in sheep. Am J Physiol 1992; 263: H919–H928
9) Rudolph AM, Heymann MA: Circulatory changes during growth in the fetal lamb. Circulation 1970; 26: 289–299
10) Heymann MA, Creasy RK, Rudolph AM: Quantitation of blood flow patterns in the fetal lamb in utero, in Combine KS, Cross KW, Dawes GS, et al (eds): Proceedings of the Sir Joseph Barcroft Centenary Symposium. Cambridge, Cambridge University Press, 1973, pp 129–135
11) Rudolph AM, Heymann MA: Circulation of the fetus in uterus. Methods for studying distribution of blood flow, cardiac output and organ blood flow. Circ Res 1967; 21: 163–184
12) Friedman WF: The intrinsic physiology properties of the developing heart, in Friedman WF, Lesch M, Sonnenblick EH (eds): Neonatol Heart Disease. New York, Grune & Stratton, 1973, pp 21–29
13) Gilbert RD: Control of fetal cardiac output during changes in blood volume. Am J Physiol 1980; 238: H80–H86
14) Peters LLH, Sheldon RE, Jones MD Jr., et al: Blood flow to fetal organs as a function of arterial oxygen content. Am J Obstet Gynecol 1979; 135: 637–646
15) Parisi VM, Walsh SW: Fetal vacular response to prostacyclin. Am J Obstet Gynecol 1989; 160: 871–878, discussion, 871–878
16) Parisi VM, Walsh SW: Arachidonic acid metabolites and regulation of placental and other vascular tone during preganncy. Semin Perinatol 1986; 10: 288–298
17) Hanley FL: Fetal Cardiac Surgery. Adv Card Surg 1994; 5: 47–74
18) Broughton-Pipkin F, Lumbers ER, Mott JC, et al: Factors influencing plasma renin and angiotensin II in the conscious pregnant ewe and its fetus. J Physiol 1974; 243: 619–636
19) Baker RS, Lam CT, Heeb EA, et al: Dynamic fluid shifts induced by fetal bypass. J Thorac Cardiovasc Surg 2009; 137: 714–722
20) Reddy VM, McElhinney DB, Rajasinghe HA, et al: Cytokine response to fetal bypass. J Materm Fetal Invest 1998; 8: 46–49
21) Sabik JF, Assad RS, Hanley FL: Prostaglandin synthesis inhibition prevents placental dysfunction after fetal cardiac bypass. J Thorac Cardiovasc Surg 1992; 103: 732
22) Everett RB, Worley RJ, MacDonald PC, et al: Effect of prostaglandin synthetase inhibitors on pressor response to angiotensin II in human pregnancy. J Clin Endocrinol Metab 1978; 46: 1007–1010
23) Sabik JF, Heinemann MK, Assad RS, et al: High dose steroids prevent placental dysfunction after fetal cardiac bypass. J Thorac Cardiovasc Surg 1994; 107: 116–124, discussion, 124–125
24) Baker RS, Lam CT, Heeb EA, et al: Dynamic fluid shifts induced by fetal bypass. J Thorac Cardiovasc Surg 2009; 137: 714–722
25) Duffy JY, Petrucci O, Baker RS, et al: Myoucardial function after fetal cardiac bypass in an ovine model. J Thorac Cardiovasc Surg 2011; 141: 961–968
26) Reddy VM, Liddicoat JR, Klein JR, et al: Fetal cardiac bypass using an in-line axial flow pump to minimize extracorporeal surface and avoid priming volume. Ann Thorac Surg 1996; 62: 393–400
27) Petrucci O, Baker RS, Lam CT, et al: Fetal right ventricular myocardial function is better preserved by fibrillatory arrest during fetal cardiac bypass. Ann Thorac Surg 2010; 90: 1324–1331
28) Sebastian VA, Ferro G, Kagawa H, et al: Fetal intervention: Improved results of fetal cardiac bypass in immature fetuses using TinyPump device. J Thorac Cardiovasc Surg 2013; 145: 1460–1464
29) Sabik JF, Assad RS, Hanley FL: Halothane as an anesthetic for fetal surgery. J Pediatr Surg 1993; 28: 542–546, discussion, 546–547
30) Fenton KM, Heinemann MK, Hickey PR, et al: The stress response during fetal surgery is blocked by total spine anesthesia. Surg Forum 1992; 43: 631–634
31) Eghtesady P, Sedgwick JA, Schenbeck JL, et al: Maternal-fetal interactions in fetal cardiac surgery. Ann Thorac Surg 2006; 81: 249–256, discussion, 255–256
32) Assad KM, Lee FY, Sabik J, et al: Tolerance of the placenta to normothermic umbilical circulatory arrest. J Matern Fetal Investig 1992; 2: 145–150
33) Fenton KM, Heinemann MK, Hanley FL: Exclusion of the placenta during fetal cardiac bypass allows improved systemic perfusion and provides important information about the mechanism of placental injury. J Thorac Cardiovasc Surg 1993; 105: 502–512
34) Crucean A, Murzi B, Giorgi A, et al: Cardiopulmonary bypass in ewe’s fetus: advances and setbacks in our learning curve. ASAIO J 2005; 51: 649–653
35) Reddy VM, Liddicoat JR, Klein JR, et al: Long-term outcome after fetal cardiac bypass: Fetal survival to full term and organ abnormalities. J Thorac Cardiovasc Surg 1996; 111: 536–544
36) Ikai A, Riemer RK, Ramamoorthy C, et al: Preliminary results of fetal cardiac bypass in nonhuman primate. J Thorac Cardiovasc Surg 2005; 129: 175–181
37) Ellingson A, Haram K, Sagen N, et al: Transplacental passage of ketamine after intravenous administration. Acta Anaesthesiol Scand 1977; 21: 41–44
38) Reddy VM, McElhinney DB, Rajasinghe HA, et al: Cytokine response to fetal bypass. J Materm Fetal Invest 1998; 8: 46–49
39) Lam CT, Baker RS, Clark KE, et al: Changes in fetal ovine metabolism and oxygen delivery with fetal bypass. Am J Physiol Regul Integr Comp Physiol 2011; 301: R105–R115